Sifat-Sifat Unsur Pada Susunan Berkala 2
Diunggah oleh
anditenriuji11Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Sifat-Sifat Unsur Pada Susunan Berkala 2
Diunggah oleh
anditenriuji11Hak Cipta:
Format Tersedia
Jelaskan sifat-sifat unsur pada susunan berkala sehubungan dengan jari-jari atom, potensial
ionisasi, elektronegativitas, dan afinitas elektron. Buat dalam bentuk tabel. Jelaskan mengapa
sifat-sifat tersebut demikian pada susunan berkala.
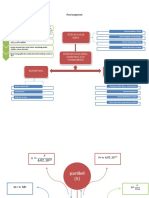
Jari-jari Atom Jari-jari atom atau radius atom adalah setengah dari jarak
antara dua int atom yang sejenis yang berikatan secara
kovalen. Misalnya di dalam molekul Cl, jarak di antara dua
inti atom klor (CI) adalah 198 pm; satuan pm adalah
singkatan dari pikometer (1 A= 100 pm).
Potensial Ionisasi Konfigurasi elektron misalnya sebuah elektron pada kulit
valensi atau kulit terlalu berenergi rendah dapat melompat
atau berpindah ke orbital berenergi lebih tinggi jika menyerap
energi jika energi yang diserap cukup besar maka elektron
tersebut tidak hanya dapat berpindah tempat tetapi juga dapat
lepas meninggalkan atom menjadi sebuah ion Sejumlah
energi yang diperlukan untuk memindahkan atau melepaskan
elektron dari kulit terluar orbital atomnya disebut energi
ionisasi atau potensial sense.
Elektronegativitas Elektronegativitas dalam susunan berkala, bertambah dari sisi
kiri ke kanan dan pada umumnya berkurang dari atas ke
bawah. Fluor (F) adalah unsur yang paling elektronegativ
(4,0) sedangkan fransium (Fr) merupakan unsur yang paling
rendah elektronegativitasnya (0,7) Gas mulia yang dianggap
sebagai unsur yang paling stabil, mempunyai harga
elektronegativitas sama dengan nol.
Afinitas elektron Pada penambahan elektron kedua afinitas elektron bernilai
positif, yaitu energi yang harus ditambah pada saat
penambahan elektron yang kedua pada anion seperti halnya
energi ionisasi, afinitas elektron pada umumnya juga
memperlihatkan keteraturan yang berhubungan dengan
konfigurasi elektron dari bermacam-macam unsur kita dapat
memahami bahwa semakin kecil ukuran atom, akan semakin
mudah inti atom menarik elektron sehingga harga afinitas
elektron semakin besar. Meskipun ada beberapa
pengecualian, dalam susunan berkala afinitas elektron pada
umumnya bertambah besar dari sisi kiri ke arah kanan,
demikian pula afinitas elektron cenderung turun dari atas ke
bawah.
Anda mungkin juga menyukai
- DISKUSI 3 - STOIKIOMETRI - A.Tenri Uji - 045268305Dokumen10 halamanDISKUSI 3 - STOIKIOMETRI - A.Tenri Uji - 045268305anditenriuji11Belum ada peringkat
- 1240 2384 3 PBDokumen7 halaman1240 2384 3 PBanditenriuji11Belum ada peringkat
- SSR Bakti Uso Template 3103021 - Add - VsatDokumen45 halamanSSR Bakti Uso Template 3103021 - Add - Vsatanditenriuji11Belum ada peringkat
- Suhu Dan KalorDokumen49 halamanSuhu Dan Kaloranditenriuji11Belum ada peringkat