Relatório 5 - Purificação Do NaCl
Diunggah oleh
ThalesFernandoDiasJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Relatório 5 - Purificação Do NaCl
Diunggah oleh
ThalesFernandoDiasHak Cipta:
Format Tersedia
PRURIFICAO DE CLORETO DE SDIO
Isabela de Castro Corteletti e Thales Fernando Dias Pereira Departamento de Cincias Naturais UFSJ, Campus Dom Bosco Praa Dom Helvcio, 74 36.301-160 So Joo Del Rei Minas Gerais
Abstract: The experiment uses small samples of potassium chloride (KCl), potassium bromide (KBr) and potassium iodide (KI) solids and in solution to obtain some compounds of the halogens. The verification of physical and chemical properties of these compounds was made by means of visual observations of physical changes of the solutions and chemical equations of reactions involved. Copyright2012 DCNAT/UFSJ
Keywords: Obtainment, halogens, properties
Resumo: O experimento utiliza pequenas amostras de cloreto de potssio (KCl), brometo de potssio (KBr) e iodeto de potssio (KI) slidas e em soluo para obteno de alguns compostos de halognios. A verificao das propriedades fsicas e qumicas destes compostos foi feita por meio de observaes de mudanas fsicas visuais das solues e de equaes qumicas das reaes envolvidas. Copyright2012 DCNAT/UFSJ
Palavras Chaves: Obteno, halognios, propriedades.
INTRODUO
As reaes estudadas em qumica no resultam de uma converso completa de reagentes em produtos, pois todas elas tendem a alcanar um equilbrio, mesmo que isto nem sempre seja evidente. No estado de equilbrio a razo entre a concentrao de reagentes e produtos constante. O que significa dizer que a velocidade da reao direta igual velocidade da reao inversa e, por isso, no mais observado modificaes macroscpicas do sistema em estudo. Diz-se que o equilbrio qumico dinmico, pois as reaes direta e inversa continuam a ocorrer, com velocidades iguais,
porm opostas. As concentraes das substncias em equilbrio, numa determinada temperatura, guardam entre si uma relao definida que expressa pela equao genrica da constante de equilbrio qumico, K.[1]
( ) ( ) ( ) ( )
A relao da concentrao no equilbrio qumico, ou seja, a posio do equilbrio, independente da forma
como este equilbrio foi alcanado. Entretanto, esta posio alterada pela aplicao de foras externas, que podem ser mudanas de temperatura, de presso (se houver reagentes ou produtos gasosos) de volume ou na concentrao total de um reagente ou produto.[1] No ano de 1888 o qumico francs Henri Louis Le Chtelier postulou o seguinte princpio: Se um sistema no estado de equilbrio perturbado por uma mudana na temperatura, presso, ou concentrao de um dos componentes, o sistema ir mudar a sua posio de equilbrio, de modo a contraria o efeito da perturbao. Isto significa que se houver aumento da temperatura de um sistema reacional, provoca-se a reao qumica que contribui para resfriar o sistema (consumindo energia trmica). Ou ainda, se houver o aumento proposital de um dado reagente ou produto, o equilbrio favorecer a reao de consumo desta substncia em excesso at que seja retomado um novo estado de equilbrio. Entretanto, ressalta-se que o excesso de reagente ou produto adicionado ao sistema, nunca completamente consumido, para que a constante de equilbrio (K) permanea constante, desde que a temperatura no mude. Da mesma forma, quando um componente removido do sistema em equilbrio, ocorrer um deslocamento para repor este componente, sendo que esta reposio nunca total para que K permanea constante. Reaes envolvendo o equilbrio de precipitao so importantes, pois atravs da teoria e dos clculos que envolvem a formao dos precipitados pode-se prever a solubilidade de um determinado sal e controlar a formao de um precipitado, de forma a auxiliar na purificao de qualquer sistema atravs da separao de ctions ou nions de interesse.
Figura 1. Filtrao simples da soluo saturada de NaCl.
Foi transferido 150 mL da soluo filtrada para o bquer D de 250 mL e mediu-se o pH da soluo, com auxlio de um papel tornassol, cujo valor foi 7,0. Na capela foi colocado 100 mL de cido clordrico (HCl) concentrado a no kitassato gerador A de 250 mL e 100 mL de cido sulfrico (H2SO4) concentrado no funil de separao B de haste comprida. Ento a aparelhagem da Figura 2 foi montada.
OBJETIVOS
O objetivo deste experimento consiste em ilustrar a purificao de um sal de cozinha comercial aplicando conceitos de equilbrio qumico, por meio de tcnicas de filtrao a vcuo, lavagens e secagens de substncias qumicas.
3 3.1
EXPERIMENTAL Obteno de uma corrente contnua de gs clordrico, precipitao e purificao do cloreto de sdio
Figura 2. Montagem do sistema para gerao de gs clordrico e precipitao e purificao de NaCl.
Uma soluo saturada de cloreto de sdio (NaCl) comercial foi preparada, pesando-se na balana semianaltica (MARTE, AL 500C) 100,2g de sal e dissolvendo-se em cerca de 350 mL de gua destilada num bquer de 500 mL. A soluo foi filtrada por filtrao simples para eliminar alguma impureza insolvel presente no sal, como mostra a Figura 1.
Para a montagem do sistema referente Figura 2, foram tomados os devidos cuidados, como assegurar-se de que a haste do funil B quase tocasse no fundo do kitassato A para que pudesse permanecer mergulhada no HCl durante todo o procedimento. O tubo de ltex C foi ajustado na sada do kitassato A e do funil de vidro E, este estava mergulhado cerca de 4 cm na soluo de NaCl do bquer D. Certificou-se de que a rolha F estava completamente ajustada para impedir qualquer vazamento.
Foi iniciado em seguida o procedimento. O H2SO4 a 0,1 molL-1 foi adicionado lentamente sobre o HCl a 0,1 molL-1 e o gs clordrico foi produzido rapidamente e em grande quantidade. Aps algum tempo de borbulhamento na soluo do bquer D, comearam a se formar cristais de NaCl que se precipitaram, conforme a Figura 3 demosntra.
Figura 5. Ilustrao do sal secando na trompa de vcuo.
Depois os cristais foram transferidos para uma cpsula de porcelana, que foi levada para a estufa (Figura 6) a 200C por trinta minutos.
Figura 3. Precipitao dos cristais de NaCl.
A passagem da corrente de gs continuou at o trmino do H2SO4, pois antes disso ainda estava ocorrendo precipitao. Logo aps, mediu-se o pH da soluo cujo valor foi 1,0. O precipitado foi filtrado sob vcuo (Figura 4) e lavado com pequenas pores de etanol gelado vrias vezes.
Figura 6. Ilustrao da estufa de secagem (Nova tica, 4004ND).
Depois a mesma foi retirada da estufa e colocada para esfriar no dessecador (Figura 7), provido de um material secante.
Figura 4: Ilustrao do sistema para filtrao sob vcuo.
Secou-se o sal sob vcuo por certo tempo como possvel ver na Figura 5.
Figura 7. Ilustrao do dessecador que continha a cpsula de porcelana com o sal.
Depois de frio, pesou-se na balana semi-analtica a quantidade de sal obtida, cujo valor foi 32,117g.
R 64%
Discusso do rendimento
3.2
Outros itens 5 CONCLUSES
Caso sejam necessrios mais itens use sempre esta formatao para sub-itens.
4 4.1
RESULTADOS E DISCUSSO Obteno de uma corrente contnua de gs clordrico, precipitao e purificao do cloreto de sdio
REFERNCIAS
A equao da reao qumica que ocorre no kitassato A a equao (1):
H2 SO4(l ) 2HCl(l ) H 2 SO4(l ) 2HCl( g ) (1)
A equao da reao qumica que acontece no bquer D a equao (2):
2NaCl( s ) H 2O(l ) Na2O(l ) 2HCl(l ) (2)
A equao da reao qumica que ocorre quando o gs clordrico entra e contato com a soluo de NaCl a equao (3):
Na2O(l ) 2HCl( g ) Na2Cl( s ) H 2O(l ) (3)
Para saber o rendimento (R) da purificao do sal, temos que de modo geral:
2NaCl( s ) (impuro) NaCl( s ) ( puro) (4)
Levando isso em considerao temos que a massa terica de sal puro que deveria ser obtida dada pela equao (5):
mSal Puro
mSal Puro
mSal Impuro ( M Sal nSal Puro ) (nSal Impuro M Sal )
(5)
100 ,2 g (58,5 g / mol 1mol ) (2mols 58,5 g / mol )
mSal Puro 50 ,1g
Ento o rendimento dado pela equao (6):
mSal Puro 100 % (6) mSal Im puro
32 ,117 g 100 % 50 ,1g
Anda mungkin juga menyukai
- Cinética da Reação de Saponificação do Acetato de EtilaDokumen10 halamanCinética da Reação de Saponificação do Acetato de EtilaHaniel HonoratoBelum ada peringkat
- OBTENÇÃO DO BENZOATO DE METILA RelatórioDokumen9 halamanOBTENÇÃO DO BENZOATO DE METILA RelatórioJoão Paulo BrunettiBelum ada peringkat
- Apostila - Gestão de Sucata Ferrosa Na SiderurgiaDokumen151 halamanApostila - Gestão de Sucata Ferrosa Na SiderurgiaRogério SantosBelum ada peringkat
- Relatorio 6 Equilíbrio QuímicoDokumen10 halamanRelatorio 6 Equilíbrio QuímicoRenato AzevedoBelum ada peringkat
- Teoria do ConhecimentoDokumen116 halamanTeoria do ConhecimentoAdil_son100% (8)
- Equilíbrio Químico: Fatores e ReaçõesDokumen8 halamanEquilíbrio Químico: Fatores e ReaçõesAdrian Mendy100% (2)
- Plano de Negócios para Pecuária de CorteDokumen11 halamanPlano de Negócios para Pecuária de CorteScribdTranslationsBelum ada peringkat
- Appr - Seminario MarinasDokumen87 halamanAppr - Seminario MarinasRicardo Gomes100% (1)
- RELATÓRIO Equilibrio QuimicoDokumen8 halamanRELATÓRIO Equilibrio QuimicoNana Rol100% (1)
- Princípio de Le ChatelierDokumen18 halamanPrincípio de Le ChatelierstandbrotherBelum ada peringkat
- Relatório Equilíbrio QuímicoDokumen8 halamanRelatório Equilíbrio QuímicoIan BarretoBelum ada peringkat
- Material de Apoio - Quimica Analitica - Set2018Dokumen94 halamanMaterial de Apoio - Quimica Analitica - Set2018Maria Luisa GomesBelum ada peringkat
- Prática 01 - Perturbando Equilíbrio.1Dokumen4 halamanPrática 01 - Perturbando Equilíbrio.1Adriano MedeirosBelum ada peringkat
- Equilíbrio Químico e Lei de Le ChâtelierDokumen7 halamanEquilíbrio Químico e Lei de Le ChâteliereritaniarangelBelum ada peringkat
- Experimento 4 Equilbrio Quimico RTE2021Dokumen5 halamanExperimento 4 Equilbrio Quimico RTE2021Leticia BrazBelum ada peringkat
- Equilíbrio Químico ExperimentalDokumen4 halamanEquilíbrio Químico ExperimentalWelligton QueirozBelum ada peringkat
- Equilíbrio químico e solubilidade de solutosDokumen4 halamanEquilíbrio químico e solubilidade de solutosCarlos Frederico Santos MartinsBelum ada peringkat
- Equilibrio QuimicoDokumen13 halamanEquilibrio QuimicoanaluizaemerencianoBelum ada peringkat
- Tema 2 - Cinética QuímicaDokumen29 halamanTema 2 - Cinética QuímicaEduardo AlbinoBelum ada peringkat
- UFMG Química EquilíbrioDokumen8 halamanUFMG Química EquilíbrioÍtalo Coutinho100% (1)
- 1a Lista de Exercícios QUI126 Oficial 2Dokumen5 halaman1a Lista de Exercícios QUI126 Oficial 2Eugenio ManuelBelum ada peringkat
- Equilíbrio químico e Le ChatelierDokumen3 halamanEquilíbrio químico e Le ChatelierAlex junioBelum ada peringkat
- 07.relatorio - Equilibrio QuimicoDokumen16 halaman07.relatorio - Equilibrio QuimicoJéssika MouraBelum ada peringkat
- Lista de Exercícios - Equilíbrio QuímicoDokumen7 halamanLista de Exercícios - Equilíbrio QuímicoIzabelleBelum ada peringkat
- Equilíbrio Químico Cromato DicromatoDokumen9 halamanEquilíbrio Químico Cromato Dicromatobininha89Belum ada peringkat
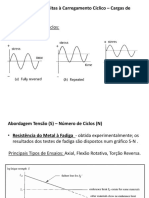
- Aula 6Dokumen3 halamanAula 6Maysa Thais PellenzBelum ada peringkat
- Relatório Quim - AnalíticaDokumen12 halamanRelatório Quim - AnalíticaCamy SantosBelum ada peringkat
- Constante de equilíbrio química em reações gasosasDokumen7 halamanConstante de equilíbrio química em reações gasosasLéllis BarbozaBelum ada peringkat
- Equilíbrio Químico e Princípio de Le Chatelier na Disciplina de Química AnalíticaDokumen6 halamanEquilíbrio Químico e Princípio de Le Chatelier na Disciplina de Química AnalíticaGisele Deconto50% (2)
- Prova Fisico QuímicaDokumen8 halamanProva Fisico QuímicaChanéle KaminskiBelum ada peringkat
- Equilibrios ConstantesDokumen6 halamanEquilibrios ConstantesFred DiasBelum ada peringkat
- Química - EquilíbrioDokumen5 halamanQuímica - EquilíbrioEzequiel CalixtoBelum ada peringkat
- Equilíbrio químico de iões cromato e dicromatoDokumen15 halamanEquilíbrio químico de iões cromato e dicromatoAldair FreireBelum ada peringkat
- Estudo do equilíbrio químico entre cromato e dicromatoDokumen8 halamanEstudo do equilíbrio químico entre cromato e dicromatolivros LivrosBelum ada peringkat
- EXERCÍCIOSDokumen17 halamanEXERCÍCIOSAlexssan drive100% (1)
- Lista - Propriedades Coligativas e Soluções IDokumen2 halamanLista - Propriedades Coligativas e Soluções Ibrn28Belum ada peringkat
- Rela. CassioDokumen4 halamanRela. CassioSAMYLE CAVALCANTE DA CRUZBelum ada peringkat
- Cinética e Equilíbrio QuímicoDokumen8 halamanCinética e Equilíbrio QuímicoBruna FerreiraBelum ada peringkat
- Simulado sobre equilíbrios químicosDokumen7 halamanSimulado sobre equilíbrios químicosJoão Paulo SousaBelum ada peringkat
- As Velocidades Das Reações QuímicasDokumen12 halamanAs Velocidades Das Reações QuímicasjustroherBelum ada peringkat
- Equilíbrio QuímicoDokumen11 halamanEquilíbrio QuímicoDaniel CordovilBelum ada peringkat
- Decomposição catalítica do H2O2 gera espumaDokumen22 halamanDecomposição catalítica do H2O2 gera espumaCarsantos Clemilson0% (2)
- Preparo e padronização de soluções de NaOHDokumen7 halamanPreparo e padronização de soluções de NaOHGabriel teixeiraBelum ada peringkat
- Relatório 2 (Química) - Manuseio Do Bico de Bunsen, Balança e NaClDokumen7 halamanRelatório 2 (Química) - Manuseio Do Bico de Bunsen, Balança e NaClWillian MarronBelum ada peringkat
- Ensaio de precipitação e solubilidadeDokumen3 halamanEnsaio de precipitação e solubilidadeGeovane SouzaBelum ada peringkat
- DL 50Dokumen11 halamanDL 50Rita Sofia Ramos MesquitaBelum ada peringkat
- Equilíbrio Químico: Constante de Equilíbrio e ReaçõesDokumen2 halamanEquilíbrio Químico: Constante de Equilíbrio e ReaçõesMiquéias GuimarãesBelum ada peringkat
- isptec_equillibrio_heterogeneo (1)Dokumen35 halamanisptec_equillibrio_heterogeneo (1)Mafuta LandamaBelum ada peringkat
- Exercícios de Equilíbrio Químico - L1Dokumen2 halamanExercícios de Equilíbrio Químico - L1Paulo LedgerBelum ada peringkat
- PRÁTICA 11 - SÍNTESE DO CLORETO DE PENTAMINCLOROCOBALTO (III) - (Co (NH3) 5Cl) Cl2Dokumen6 halamanPRÁTICA 11 - SÍNTESE DO CLORETO DE PENTAMINCLOROCOBALTO (III) - (Co (NH3) 5Cl) Cl2Pedro HenriqueBelum ada peringkat
- Aula Prática 1 - Equilíbrio QuímicoDokumen2 halamanAula Prática 1 - Equilíbrio QuímicoNáthaly CoelhoBelum ada peringkat
- Espcex - Lista 14 Equilíbrio QuímicoDokumen3 halamanEspcex - Lista 14 Equilíbrio Químico27.marcos9521Belum ada peringkat
- Equilíbrio Químico: Lista de Exercícios de 2o AnoDokumen8 halamanEquilíbrio Químico: Lista de Exercícios de 2o Anomatheus xexeuBelum ada peringkat
- Relatório Equilibrio QuimicoDokumen8 halamanRelatório Equilibrio QuimicoJuliana GiantiniBelum ada peringkat
- 06 - Equilíbrio QuímicoDokumen3 halaman06 - Equilíbrio Químicocleyton_775918781Belum ada peringkat
- 02-Relatório de Química - Aula 07 01Dokumen8 halaman02-Relatório de Química - Aula 07 01Joseane SantosBelum ada peringkat
- Relatório Quali EquilíbrioDokumen16 halamanRelatório Quali EquilíbrioAnnelíesi Lopes100% (1)
- 1 Roteiro - EquilibrioDokumen2 halaman1 Roteiro - EquilibrioAna ResendeBelum ada peringkat
- Lista1 - Fisicoquimica FarmaciaDokumen23 halamanLista1 - Fisicoquimica FarmaciapatriciamartinsBelum ada peringkat
- Cenro Universitário de Sete LagoasDokumen13 halamanCenro Universitário de Sete LagoasElizangela GomesBelum ada peringkat
- Crioscopia de Ácidos - ∆Tf e KeqDokumen3 halamanCrioscopia de Ácidos - ∆Tf e KeqBreno MacielBelum ada peringkat
- Utilização do lodo gerado na ETA de Alvorada-RS na fabricação de blocos cerâmicosDari EverandUtilização do lodo gerado na ETA de Alvorada-RS na fabricação de blocos cerâmicosBelum ada peringkat
- 01 Estrutura Atômica Origem Dos ElementosDokumen22 halaman01 Estrutura Atômica Origem Dos ElementosThalesFernandoDiasBelum ada peringkat
- Tipos de ConhecimentoDokumen15 halamanTipos de ConhecimentoHerivelto CarvalhoBelum ada peringkat
- CientificoDokumen7 halamanCientificoJackes David Lemos LemosBelum ada peringkat
- Relátorio Org. Exp. 1 IMPRIMIRDokumen10 halamanRelátorio Org. Exp. 1 IMPRIMIRThalesFernandoDiasBelum ada peringkat
- Metodologia Engenharia PDFDokumen53 halamanMetodologia Engenharia PDFThalesFernandoDiasBelum ada peringkat
- Voltametria: conceitos e técnicas para análise de traçosDokumen21 halamanVoltametria: conceitos e técnicas para análise de traçoshenriquefaccinBelum ada peringkat
- Análise química por injeção em fluxo contínuoDokumen5 halamanAnálise química por injeção em fluxo contínuoThalesFernandoDiasBelum ada peringkat
- Cinema No Mundo Indústria Política e Mercado África Org Alessandra MeleiroDokumen217 halamanCinema No Mundo Indústria Política e Mercado África Org Alessandra MeleiroTaylon ProtásioBelum ada peringkat
- Cálculo tempo reverberação sala aulaDokumen7 halamanCálculo tempo reverberação sala aulaIsabela Constante100% (1)
- Cimento resistente a altas temperaturasDokumen3 halamanCimento resistente a altas temperaturasAna Júlia Capila PrattiBelum ada peringkat
- Unidades Condensadoras Micro Canal DanfossDokumen24 halamanUnidades Condensadoras Micro Canal Danfosssgt_glauber4666Belum ada peringkat
- Treinamento de segurança sobre caldeiras elétricasDokumen15 halamanTreinamento de segurança sobre caldeiras elétricasMarcos GrisiBelum ada peringkat
- Refratários em Convertedor LDDokumen19 halamanRefratários em Convertedor LDRafael Cruz100% (1)
- Manual Forno Vipão 1.9 - REV01Dokumen22 halamanManual Forno Vipão 1.9 - REV01Fernando Santos100% (1)
- Aula - 9B Propriedades Mecânicas Das Madeiras PDFDokumen38 halamanAula - 9B Propriedades Mecânicas Das Madeiras PDFViana VianaBelum ada peringkat
- Tabela de Preços DER/PB com Descrição de Serviços de Terraplenagem e PavimentaçãoDokumen8 halamanTabela de Preços DER/PB com Descrição de Serviços de Terraplenagem e PavimentaçãoLincoln JúniorBelum ada peringkat
- 2T Q14.15Dokumen4 halaman2T Q14.15conceicaoBelum ada peringkat
- Especificação de LubrificantesDokumen9 halamanEspecificação de LubrificantesJuliano S. Guolo100% (1)
- Tecnologia: Novas Abordagens, Conceitos, Dimensões e Gestão: J C T SDokumen14 halamanTecnologia: Novas Abordagens, Conceitos, Dimensões e Gestão: J C T SLeticia BernardesBelum ada peringkat
- Optimization and Validation of An RP-HPLC Method For The Estimation of 6-Mercaptopurine in Bulk and Pharmaceutical FormulationsDokumen8 halamanOptimization and Validation of An RP-HPLC Method For The Estimation of 6-Mercaptopurine in Bulk and Pharmaceutical FormulationsdiahfaradinaBelum ada peringkat
- Manual PUBDokumen31 halamanManual PUBRodrigo AndradeBelum ada peringkat
- Fadiga Parte 2Dokumen27 halamanFadiga Parte 2lucaspenalva123Belum ada peringkat
- Solda Mig - Mag - Trabalho EscolarDokumen21 halamanSolda Mig - Mag - Trabalho EscolarklausahlfBelum ada peringkat
- Orçamento Completo - Execução de Sistema de Abastecimento de ÁguaDokumen41 halamanOrçamento Completo - Execução de Sistema de Abastecimento de ÁguaGustavo RodriguesBelum ada peringkat
- Caldeiras: tipos e componentesDokumen22 halamanCaldeiras: tipos e componentesVívia CastroBelum ada peringkat
- Conjuntos Didáticos SomaDokumen86 halamanConjuntos Didáticos SomaMario DuarteBelum ada peringkat
- Wilson Dizard Jr. A Nova Mídia. A Comunicação de Massa Na Era Da Informação. Tradução - ANTONIO QUEIROGA EDMOND JORGE.Dokumen15 halamanWilson Dizard Jr. A Nova Mídia. A Comunicação de Massa Na Era Da Informação. Tradução - ANTONIO QUEIROGA EDMOND JORGE.Beatriz MirandaBelum ada peringkat
- BURNDY Brasil - Catálogo in - 2013Dokumen84 halamanBURNDY Brasil - Catálogo in - 2013Davi SalvatoreBelum ada peringkat
- TCC Dispositivo Adaptador de Furadeira - SENAIDokumen78 halamanTCC Dispositivo Adaptador de Furadeira - SENAIHenrique MeloBelum ada peringkat
- Armazenamento de maçã em atmosfera controladaDokumen29 halamanArmazenamento de maçã em atmosfera controladaGiselePauloSoraBelum ada peringkat
- Cátalogo de Resistências e Aquecedores ANLUZDokumen44 halamanCátalogo de Resistências e Aquecedores ANLUZandreengmecBelum ada peringkat
- 02 - Pca Santa Edwiges 2022Dokumen15 halaman02 - Pca Santa Edwiges 2022aubeciBelum ada peringkat
- Determinação da carga de pressão disponível em ponto de rede de distribuição de águaDokumen29 halamanDeterminação da carga de pressão disponível em ponto de rede de distribuição de águaSilmara SantosBelum ada peringkat
- TORNOS CNC. Centur 30D Centur 35D PDFDokumen12 halamanTORNOS CNC. Centur 30D Centur 35D PDFGuilhermePlacidoBelum ada peringkat