Heterociclica 2
Diunggah oleh
Victor OlveraJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Heterociclica 2
Diunggah oleh
Victor OlveraHak Cipta:
Format Tersedia
COMPUESTOS HETEROCCLICOS
COMPUESTOS
ORGNICOS
CCLICOS
COMPUESTOS CARBOCCLICOS: solo contienen tomos de
carbono en sus anillos
COMPUESTOS HETEROCCLICOS: contienen otros elementos
distintos del carbono (HETEROTOMOS) en sus anillos
COMPUESTOS HETEROCCLICOS
segn el nmero de anillos
MONOCCLICOS
POLICCLICOS
COMPUESTOS HETEROCCLICOS
segn su estructura
AROMTICOS
ALICCLICOS
MONOCCLICOS BICCLICOS
ALICCLICOS AROMTICO
ALICCLICO
AROMTICO
O
THF
O
Oxirano
N
Piridina
N
Quinolina
N
C H
3
Tropano
ESTRUCTURA Y PROPIEDADES MS IMPORTANTES
DE LOS HETEROCICLOS AROMATICOS
1.- SISTEMAS CARBOCICLICOS AROMATICOS
1.1.- Benceno y Naftaleno
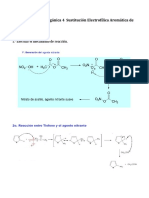
Diferencia en reactividad entre benceno y alquenos:
Benceno reacciona por sustitucin
Alquenos reaccionan por adicin
C C
Br
2
C C
Br
Br
CCl
4
Br
2
FeBr
3
Br
Esta diferencia se debe a que el benceno posee 6 e
-
t en el anillo formando
un orbital molecular conjugado que es ms estable termodinmicamente que
el correspondiente sistema conjugado no cclico.
Esta estabilidad hace que el benceno reaccione por sustitucin, para que
no se pierda el sistema conjugado de 6 e
-
cclico.
Adicin Sustitucin
QUMICA HETEROCCLICA
Hckel (1931) aromaticidad: sistemas cclicos conjugados y planos
con 4n+2 e
-
t (n=0,1,2,...)
En la mayora de los sistemas aromticos monocclicos tanto carbo-
como hetero-aromticos hay 6 e
-
t :
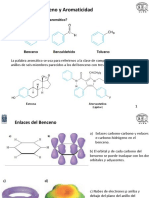
Estructura del benceno:
ngulos C-C-C y H-C-C de 120
Hibridacin sp
2
para los C
Anillo plano con un esqueleto o donde 6C estn unidos
entre s por orbitales sp
2
y cada C con un H
(hexgono regular)
A cada C le queda 1 e
-
en un orbital atmico p
perpendicular al plano del anillo
Los orbitales p interaccionan para generar el Orbital
Molecular (O.M.) t deslocalizado asociado con la
aromaticidad
+ _
H H
H H
H H
H
H
H
H
H
H
.
.
. .
.
.
sp
2
o
QUMICA HETEROCCLICA
Estas dos formas se denominan estructuras cannicas o resonantes y no
tienen por s solas existencia real aunque contribuyen a ilustrar lo que es
el benceno en realidad
H H
H H
H H
H H
H H
H H
.
.
. .
.
.
.
. .
.
. .
El benceno se puede describir como un hbrido de resonancia entre dos formas
extremas que corresponden, en trminos de interacciones orbitalarias, a las
dos formas posibles de aparear sus espines los e
-
de los orbitales p contiguos.
QUMICA HETEROCCLICA
Los compuestos bencenoides se representan muchas veces con un crculo dentro
del hexgono que indica la deslocalizacin de los 6 e
-
en el anillo y la igual
longitud de todos los enlaces (esto solo es cierto en el benceno, los 6 enlaces
C-C son idnticos: 1.39 ).
Para interpretar reacciones se utiliza una de las dos estructuras anteriores
(teniendo en cuenta que no son las reales)
1.39
E
H
E
E
+
+
QUMICA HETEROCCLICA
QUMICA HETEROCCLICA
QUMICA HETEROCCLICA
Estructura del naftaleno:
Un tratamiento similar conduce a tres formas resonantes para el
naftaleno:
El enlace C1-C2 tiene mayor carcter doble, estadsticamente 0.66 (I y
III), y por lo tanto menor longitud: 1.37
El enlace C2-C3 tiene menor carcter doble, estadsticamente 0.33 (II),
y por lo tanto mayor longitud: 1.41
I II III
L
C2-C3
= 1.41
L
C1-C2
= 1.37
QUMICA HETEROCCLICA
Los sistemas bicclicos aromticos, por ejemplo el naftaleno, tienen una E
R
menor que el doble de la del benceno.
Por lo tanto, una reaccin que suponga
la prdida de aromaticidad de uno de
los anillos implica una menor prdida
de estabilidad que en el benceno y por
tanto se produce con ms facilidad.
Es la diferencia de energa entre el estado fundamental de energa del
benceno y la de un hipottico 1,3,5-ciclohexatrieno y corresponde a la
estabilizacin del benceno por la interaccin cclica de los 6 e
-
t.
2.- ENERGA DE RESONANCIA AROMTICA
QUMICA HETEROCCLICA
E
E
R
E
R
<2E
R
Se han calculado E
R
para los sistemas aromticos y los valores absolutos
son distintos segn los clculos y las aproximaciones realizadas. Sin embargo,
en muchos casos lo ms significativo son los valores relativos.
La E
R
de la piridina (117) y del tiofeno (122) son del mismo orden que la
del benceno (150). La del pirrol es menor (90) y an menor es la del furano
(68) (KJ/mol).
La comparacin entre piridina y quinolina es anloga a la que existe entre
benceno y naftaleno y lo mismo sucede con pirrol e indol
QUMICA HETEROCCLICA
ESTRUCTURA DE SISTEMAS
HETEROAROMATICOS DE SEIS MIEMBROS
1.- PIRIDINA
En el N no hay un H sino un par de e
-
no compartido en un orbital sp
2
que es el responsable de las propiedades bsicas de la piridina (pK
a
=5.2)
( El par de e
-
no est implicado en el sextete aromtico !!)
Anloga al benceno, el cambio de CH por N origina unas diferencias entre
ambos compuestos, de las que cabe destacar:
Debido a la presencia del heterotomo, no es un hexgono regular, los
enlaces C-N son ms cortos
N
H
H
H
H
H
:
. .
.
. .
.
QUMICA HETEROCCLICA
Posee un fuerte momento dipolar debido a la mayor electronegatividad
del N en comparacin con la del C ( =2.2 D)
Debido a la electronegatividad del N se origina una polarizacin por el
efecto I en el esqueleto o (fundamentalmente) y tambin en el sistema
t estabilizando el N aquellas formas resonantes con separacin de cargas
que siten la carga negativa en el N:
N N N N N
+
+
+
- - -
QUMICA HETEROCCLICA
Como el efecto inductivo (-I) y el conjugativo (-K) operan en el mismo sentido,
la piridina est polarizada permanentemente hacia el N:
En posiciones o- y - existe una mayor deficiencia de carga
N
o
o
o o
Debido a esta deficiencia electrnica en los C de la piridina, a ella y a
los heterociclos relacionados con ella se les denomina HETEROCICLOS
POBRES EN e
-
o HETEROCICLOS t-DEFICIENTES
Tambin por esta causa, la piridina reacciona con reactivos nuclefilos en
las posiciones o- y - y con reactivos electrfilos en el N y con ms
dificultad en la posicin |-:
N
o
|
QUMICA HETEROCCLICA
QUMICA HETEROCCLICA
ESTRUCTURA-REACTIVIDAD
N
Nu
-
Nu
-
Nu
-
E
+
E
+
E
+
DIFERENCIAS CON SISTEMAS BENCNICOS:
EXPERIMENTA CON DIFICULTAD REACCIONES CON ELECTRFILOS
EXPERIMENTA CON FACILIDAD REACCIONES CON NUCLEFILOS
o + o +
o +
o
Comparando el de la piridina con el de la piperidina, nos damos idea de
la polarizacin asociada al esqueleto o y de la asociada con la distorsin
del sistema t :
Las longitudes de enlace en la piridina son:
N
1.40
1.39
1.34
N N
H
2.2D
1.17D
QUMICA HETEROCCLICA
Son heterociclos de seis miembros con dos Nitrgenos en el anillo.
2.- DIAZINAS
Sus estructuras son anlogas a la de la piridina:
Su basicidad es menor que la de la piridina debido al efecto -I del
segundo nitrgeno que desestabiliza el catin monoprotonado
N N
N
N
N
N
N
pK
a
5.2 2.3 1.3 0.65
N
N
H
H
H H
N
N
H
H H
H
N N
H
H H
H
:
.
.
.
.
. .
.
.
:
.
.
. .
.
. .
.
:
.
.
. .
.
.
:
QUMICA HETEROCCLICA
En estos compuestos existen ms formas resonantes con separacin de
carga, pues hay 2 N que pueden estabilizar la carga en vez de uno.
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
- - -
+
+
+
+
+
+
- - -
N
N
o
o
o
o
o
o
PIRIDAZINA
QUMICA HETEROCCLICA
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
- - -
+
+ +
+
+
+
- - -
N
N
o
o
o
o
o
PIRIMIDINA
QUMICA HETEROCCLICA
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
- - -
+
+
+
+
+ +
- - -
N
N
o
o
o
o
o
o
PIRAZINA
LAS DIAZINAS:
NO EXPERIMENTAN S
E
Ar. CON E
+
REACCIONAN EN EL N
REACCIONAN BIEN CON NUCLEFILOS
QUMICA HETEROCCLICA
3.- SALES DE PIRIDINIO Y DE PIRILIO
La adicin electroflica al N piridnico genera IONES PIRIDINIO. El
ms sencillo es el 1H-piridinio, isoelctrico con el benceno con la nica
diferencia de poseer un N cargado positivamente.
La carga positiva del N hace ms deficitarias en carga a las posiciones
o- y - con respecto a la piridina ms reactivas frente a nuclefilos.
La densidad electrnica en la posicin |- tambin es menor que en la
piridina.
Los cationes piridinio son aromticos, tienen 6 e
-
t
N
H
H
H H
H
H
N H
+
. .
.
. .
.
+
N
H
N
H
N
H
N
H
N
H
+ +
+
. . . . . .
+
+
QUMICA HETEROCCLICA
LAS SALES DE PIRIDINIO:
SON MS REACTIVAS FRENTE A NUCLEFILOS QUE LA PIRIDINA
N
H
+
o + o +
o +
Nu
-
Nu
-
Nu
-
QUMICA HETEROCCLICA
ESTRUCTURA-REACTIVIDAD
En el CATIN PIRILIO, el oxgeno cargado positivamente an posee un
par de e
-
en un orbital sp
2
en el plano del anillo, igual que la piridina:
La carga positiva se deslocaliza de nuevo en las posiciones 2-, 4- y 6-:
O
H
H
H H
H
O
+
:
:
.
.
. .
.
.
O O O O O
+ +
+
+
+
Como el O es ms electronegativo que el N, tolera peor la carga positiva
catin pirilio menos estabilizado que el catin piridinio
QUMICA HETEROCCLICA
4.- PIRIDONAS Y PIRONAS
Las piridinas con un OH en 2- en 4- existen predominantemente como
tautmeros carbonlicos conocidos como PIRIDONAS.
QUMICA HETEROCCLICA
N
O
H
N
O
H
N
O
H
N
O
H
N
O
H
+
_
+
_
+
_
PIRIDONA
QUMICA HETEROCCLICA
Los estudios acerca del grado de aromaticidad de estos compuestos han
conducido a diversos resultados. El grado de aromaticidad depende de
la contribucin de las estructuras dipolares (tienen 6 e
-
t) a la estructura
total.
Las PIRONAS son los anlogos oxigenados de las piridonas y para ellas
no es posible el tautmero hidroxlico.
Las pironas son menos aromticas que las piridonas
Poseen una mayor tendencia a dar reacciones de adicin
La estructura dipolar aromtica de la pirona estabiliza peor la carga
positiva en el O ms electronegativo) que la de la piridona en el N
O O
O O O O
O O
+
_
+
_ _
+
..
.. ..
..
..
PIRONA
QUMICA HETEROCCLICA
ESTRUCTURA DE SISTEMAS
HETEROAROMATICOS DE CINCO MIEMBROS
H
H H
H
.
. .
.
El ANIN CICLOPENTADIENILO es un sistema aromtico carbocclico con
6 e
-
t generado a partir del ciclopentadieno por la prdida de un protn y
aunque est estabilizado por resonancia es muy reactivo.
El ciclopentadieno tiene un pK
a
~ 14, es mucho ms cido que un simple dieno
debido a la estabilizacin del anin resultante por resonancia:
-
-
-
- -
QUMICA HETEROCCLICA
Es isoelectrnico con el anin ciclopentadienilo pero elctricamente neutro
1.- PIRROL
N
H
H
H
H
H
.
. .
.
En el pirrol las cinco formas resonantes no son equivalentes: hay una
sin separacin de cargas y dos pares de formas cannicas equivalentes
en las que existe separacin de cargas y que indican que la densidad
electrnica se aleja del nitrgeno
La contribucin de las formas resonantes es distinta:
I > III = IV > II = V
N
H
N
H
N
H
N
H
N
H
+ + +
+
-
- -
-
..
I II III IV V
QUMICA HETEROCCLICA
N
H
o
o
o
o o
La carga negativa parcial se reparte ente los carbonos y el N posee
una carga parcial positiva
La distribucin electrnica en el pirrol es un balance de los dos efectos
contrapuestos, siendo el mesomrico el ms significativo
El efecto inductivo desplaza carga hacia el N debido a su mayor
electronegatividad
N
H
N
H
1.57D
1.55 (2.15)D
segn el disolvente
1.37
1.43
1.38
Las longitudes de enlace son concordantes con esto: L
C3-C4
> L
C2-C3
QUMICA HETEROCCLICA
Debido a que en el pirrol la densidad electrnica se aleja del N hacia
los C se dice que es un Heterociclo rico en e
-
o Heterociclo t-
excedente
El par de electrones forma parte del sextete aromtico:
N
H
H
H
H
H
.
. .
.
QUMICA HETEROCCLICA
Sus estructuras son anlogas a las del pirrol, salvo que el NH est
reemplazado por un S o por un O
2.- TIOFENO Y FURANO
Tienen:
1 par de e
-
en un orbital sp
2
(plano del anillo)
1 par de e
-
en el sextete aromtico
Z
H
H
H
H
:
. .
. .
Z = O FURANO
Z = S TIOFENONO
En ambos casos se pueden escribir formas cannicas anlogas a las del
pirrol
S
o
o
o
o o
O
o
o
o
o o
QUMICA HETEROCCLICA
Debido a la mayor electronegatividad del O y del S las formas con
separacin de carga (carga + en O en S) tienen una menor
contribucin
El efecto I del heterotomo es en ambos casos superior al efecto
mesomrico y esto hace que sean dipolos dirigidos hacia el heterotomo
S S
1.87D 0.52
1.37
1.42
1.71
O O
1.68D 0.71
1.35
1.44
1.37
El mayor tamao del tomo de S es uno de los motivos que hace al
tiofeno ms estable (ms aromtico) que al pirrol o al furano:
Los ngulos de enlace son mayores y se evita la tensin angular
Otra contribucin significativa a la estabilizacin del tiofeno
radica en la participacin de los orbitales d del AZUFRE
QUMICA HETEROCCLICA
S
H
H
H
H
:
. .
. .
O
H
H
H
H
:
. .
. .
QUMICA HETEROCCLICA
z
o
o o
o o
PIRROL, FURANO Y TIOFENO:
EXPERIMENTAN S
E
Ar. CON E
+
REACCIONAN EN LOS C
(las condiciones de reaccin dependen del heterotomo)
REACCIONAN MAL CON NUCLEFILOS
E
+
E
+
E
+
E
+
ESTRUCTURA-REACTIVIDAD
QUMICA HETEROCCLICA
Los 1,3- y los 1,2-azoles son heterociclos de cinco eslabones con dos
heterotomos
3.- AZOLES
N
N
H
S
N
O
N
N
N
H
S
N
O
N
IMIDAZOL
TIAZOL OXAZOL
ISOXAZOL ISOTIAZOL
PIRAZOL
1,3-AZOLES
1,2-AZOLES
QUMICA HETEROCCLICA
N
N
H
H
H
H
.
.
.
.
. .
S
N
H
H
H
.
.
.
.
. .
:
O
N
H
H
H
.
.
.
.
. .
:
IMIDAZOL TIAZOL OXAZOL
N
N
N
N
N
N
N
N
H
N
N
H H H H
N
N
H
N
N
H
N
N
H
-
+ +
+
-
-
-
+
..
-
+
.. - +
.. -
+
..
N
Y
o
o
o
o
1,3-AZOLES
Uno de los heterotomos es anlogo a los del pirrol, furano y tiofeno
y el otro (un N) es del tipo azometnico (como en la piridina)
N
Y
o
o
o
o
E
+
E
+
Nu
-
QUMICA HETEROCCLICA
ESTRUCTURA-REACTIVIDAD
IMIDAZOL, TIAZOL Y OXAZOL:
EXPERIMENTAN S
E
Ar CON E
+
REACCIONANDO EN N-3 Y EN C-5
REACCIONES CON NUCLEFILOS EN C-2
QUMICA HETEROCCLICA
N
N
N
N
N
N
N
H
N
N
N
N
H
N
H H H H
N
H
N
N
H
N
N
H
N
-
+ +
+
- -
-
+
..
.. ..
-
+
..
-
+ ..
-
+
PIRAZOL ISOTIAZOL ISOOXAZOL
N
N
H
H
H
H
.
. .
.
. .
O
N
H
H
H
.
. .
.
. .
:
S
N
H
H
H
.
. .
.
. .
:
Y
N
o
o
o
o
o
1,2-AZOLES
Uno de los heterotomos es anlogo a los del pirrol, furano y tiofeno
y el otro (un N) es del tipo azometnico (como en la piridina)
QUMICA HETEROCCLICA
ESTRUCTURA-REACTIVIDAD
o
N
N
H
o
o
E
+
E
+
o
o
IMIDAZOL, TIAZOL Y OXAZOL:
EXPERIMENTAN S
E
Ar CON E
+
REACCIONANDO EN N-2 Y EN C-4
REACCIONES CON NUCLEFILOS EN C-5 MEJOR QUE EN C-3
Nu
-
Nu
-
Son anlogas al naftaleno con un anillo de piridina y otro de benceno
fusionados:
ESTRUCTURA DE SISTEMAS HETEROAROMATICOS
BICCLICOS CONDENSADOS
QUMICA HETEROCCLICA
1.- QUINOLINA (QUINOLEINA) e ISOQUINOLINA
(ISOQUINOLEINA)
N
H
H
H
H
H
H
H
.
.
.
. .
.
.
.
. .
.
.
N
H
H
H
H
H
H
.
.
.
. .
.
.
.
. .
.
.
QUINOLINA ISOQUINOLINA
QUMICA HETEROCCLICA
2.- INDOL
Es un sistema fusionado con un anillo de pirrol y otro de benceno:
N
H
H
H
H
H
.
.
.
.
. .
.
.
Las formas resonantes de estos biciclos condensados se pueden escribir de
acuerdo a las del benceno y a las de los heterociclos correspondientes
Las formas cannicas en que se pierde la aromaticidad de ambos anillos
tienen muy escasa contribucin
N
ESTRUCTURA-REACTIVIDAD
QUMICA HETEROCCLICA
N N N N N
+
- - -
+
....
+
QUINOLINA
N
o
o
o
o
Nu
-
Nu
-
E
+
E
+
N
ESTRUCTURA-REACTIVIDAD
ISOQUINOLINA
QUMICA HETEROCCLICA
N N N N N
+
-
- -
+
....
+
N
o
o
o
Nu
-
Nu
-
o
E
+
E
+
N
H
ESTRUCTURA-REACTIVIDAD
QUMICA HETEROCCLICA
N
H
N
H
N
H
N
H
-
-
+
....
+
..
N
H
o
o
o
E
+
E
+
INDOL
QUMICA HETEROCCLICA
Cuando dos centros alternativos para la protonacin son
heterotomos, normalmente se establecen equilibrios en disolucin
por transferencia intermolecular rpida de protones entre un tomo de
N del anillo y un sustituyente con O, S N.
TAUTOMERA EN COMPUESTOS HETEROCCLICOS
N X
H
N XH N
H
X
N
XH
X = O, N, S
Muchos compuestos heterocclicos pueden existir en 2 o ms
formas tautomricas
Este es el caso de las piridinas con grupos OH, -SH y NH
2
en posiciones 2- y 4-:
QUMICA HETEROCCLICA
El predominio de uno de los tautmeros en disolucin, se
puede establecer por tcnicas espectroscpicas por comparacin de sus
espectros con los de sus alquilderivados.
Por ejemplo, el UV de la 2-piridona es anlogo al de la 1-
metil-2-piridona (en distintos disolventes) pero es muy distinto del de
la 2-metoxipiridina:
N O
H
N O
Me
N OMe
max(EtOH) (log c ) 229 (3.85) 230 (3.78) 270 (3.55)
300 (3.70) 305 (3.70)
El equilibrio 2-Piridona 2-Hidroxipiridina se encuentra
muy desplazado (~9:1) hacia el tautmero cetnico en estas condiciones
Por ejemplo, en el sistema 2-Hidroxipiridina/2-Piridona el tautmero
que predomina en disolucin muy diluida ( 10
-7
M ) o en fase gaseosa es la
Hidroxipiridina. En disolventes no polares predomina la Piridona pues se
asocia dimericamente por enlace de hidrgeno.
QUMICA HETEROCCLICA
Cuando X=S tambin es la tiona el tautmero predominante
Cuando X=NH el tautmero predominante es la aminopiridina
Estas consideraciones son tambin vlidas para otros sistemas
heterocclicos aromticos de seis eslabones
La posicin de estos equilibrios se puede ver afectada por:
La concentracin de la disolucin
La naturaleza del disolvente
En los compuestos aromticos existen otros tipos de tautomera
prototrpica:
La interconversin entre estructuras totalmente aromticas por
protonacin y desprotonacin sobre diferentes tomos de N del
anillo es, en general, un proceso muy rpido de baja energa.
Un ejemplo es el 1,2,4-Triazol:
N
OH
N
O
H
+
_
N
N N
H
N
N N
H
N
N N
H
QUMICA HETEROCCLICA
El equilibrio entre la 3-Hidroxipiridina y el xido de piridinio se
encuentra, en disolucin, perfectamente balanceado pues no existe
un tautmero cetnico:
Tautomera en Imidazoles
En los imidazoles se presenta el fenmeno de
la tautomera:
N
N
H
N
N
H
En algunos casos uno de los tautmeros es el predominante en el equilibrio:
N
H
N
O
2
N
N
NH
O
2
N
400 : 1
4(5)-Nitroimidazol
Esta caracterstica hace que los imidazoles sustituidos asimtricamente existan
como dos especies inseparables en equilibrio. Un ejemplo es el 4-metilimidazol en
equilibrio con el 5-metilimidazol, por convenio se denominan 4(5)-Metilimidazol:
N
H
N
C H
3
N
NH
C H
3
N
N
H
C H
3
1
1
1
2
2 2
3
3
3
4
4
4
5
5
5
QUMICA HETEROCCLICA
Tautomera en Pirazoles
En los pirazoles se presenta, igual que en los imidazoles,
el fenmeno de la tautomera:
N
N
H
N
N
H
Esta caracterstica hace que los pirazoles sustituidos asimtricamente existan
como dos especies inseparables en equilibrio. Un ejemplo es el 3-metilimidazol en
equilibrio con el 5-metilimidazol, por convenio se denominan 3(5)-Metilipirazol:
N
H
N
CH
3
N
NH
CH
3
N
N
H
C H
3
1
1
1
2
2
2
3
3
3
4
4 4
5
5
5
QUMICA HETEROCCLICA
N
H
OEt
N
H
H
OEt
Es posible generar y caracterizar en disolucin los tautmeros
enlicos de los heterociclos de 5 miembros que se representan a
continuacin aunque sean inestables:
QUMICA HETEROCCLICA
La interconversin de tautmeros por protonacin y desprotonacin
sobre el C puede ser un proceso con alta E
a
lo que permite el
aislamiento por separado de los tautmeros puros:
Z = S predomina I
Z = O predomina II
Z
OH
Z
O
H
H
I II
El establecimiento de las formas tautomricas es de gran importancia
en las bases pricas y pirimidnicas que forman parte del ADN y ARN
las cuales, a travs de enlaces de hidrgeno que involucran al oxgeno
carbonlico, proporcionan el mecanismo para el apareamiento de las
bases
QUMICA HETEROCCLICA
N N
O
H
N
N
NH
H
N
N
CH
3
O
H
H
N N
H
N
N
O
H
N
N
O
H
N
H
H
N
H
H
T
A
C
G
Aunque todas las formas resonantes posean cargas nominales
positivas y negativas, estos compuestos no se comportan como sales
sino como compuestos neutros. Se disuelven en los disolventes habituales
de las sustancias orgnicas. Ejemplos:
O
N
N
O
Ph
O
N
N
O
-
Ph
O
N
N
O
-
Ph
O
N
N
O
Ph
O
N
N
O
Ph
+ + + + +
-
-
-
N
N
Me
O
-
N
N
Me
O
-
N
N
Me
O
N
N
Me
O
+
+ +
-
etc.
-
+
Debido a sus estructuras dipolares, los compuestos mesoinicos participan
en reacciones de cicloadicin como 1,3-dipolos
QUMICA HETEROCCLICA
SISTEMAS MESOINICOS
Son aquellas sustancias aromticas para las cuales no es posible escribir
estructuras cannicas no polarizadas
QUMICA HETEROCCLICA
LUIS ANTONIO MARTINEZ A.
JOSE G. GARCIA ESTRADA
FACULTAD DE ESTUDIOS SUPERIORES-C
UNAM
Anda mungkin juga menyukai
- Síntesis 3-carbetoxicumarinaDokumen11 halamanSíntesis 3-carbetoxicumarinaTatiana CastañoBelum ada peringkat
- Prev IndolesDokumen9 halamanPrev IndolesRodary Dymarcuz75% (4)
- IsoxazolonaDokumen12 halamanIsoxazolonaFer AlonsoBelum ada peringkat
- Síntesis de pirrol mediante modificación de Paal-Knorr usando bentonitaDokumen4 halamanSíntesis de pirrol mediante modificación de Paal-Knorr usando bentonitaAngel ZurielBelum ada peringkat
- Síntesis de 5,5-DifenilhidantoínaDokumen2 halamanSíntesis de 5,5-DifenilhidantoínajuanBelum ada peringkat
- Analisis Preliminar Fitoquimica RomeroDokumen4 halamanAnalisis Preliminar Fitoquimica RomeroHéctor Balmori100% (1)
- Química Orgánica 3: Reacciones del grupo carboniloDokumen240 halamanQuímica Orgánica 3: Reacciones del grupo carboniloWendy Núñez BedollaBelum ada peringkat
- 2 Nitrotiofeno 2Dokumen7 halaman2 Nitrotiofeno 2anon_506134490Belum ada peringkat
- Práctica 2Dokumen2 halamanPráctica 2Cecilia ValdiviaBelum ada peringkat
- PiridinaDokumen86 halamanPiridinaLulu CastilloBelum ada peringkat
- Sintesis de 2,4 Dietoxicarbonil 3,5 DimetilpirrolDokumen1 halamanSintesis de 2,4 Dietoxicarbonil 3,5 Dimetilpirrolangie creyesBelum ada peringkat
- Previo 3 Orgánica 4Dokumen5 halamanPrevio 3 Orgánica 4dany_289Belum ada peringkat
- Síntesis de 1-Fenil-3-metilpirazol-5-onaDokumen2 halamanSíntesis de 1-Fenil-3-metilpirazol-5-onaMonse BlanquelBelum ada peringkat
- Heterociclos de 6 MiembrosDokumen49 halamanHeterociclos de 6 MiembrosDaniel Ryūku Nishimura100% (1)
- Lab 10. Sintesis de La Anilina A P-NitroanilinaDokumen5 halamanLab 10. Sintesis de La Anilina A P-NitroanilinaJulieth BarriosBelum ada peringkat
- Los HeterociclosDokumen16 halamanLos HeterociclosTerry DawsonBelum ada peringkat
- Pirrol, Furano y TiofenoDokumen17 halamanPirrol, Furano y TiofenoJuan Yujra CárdenasBelum ada peringkat
- 1,2 DihidropiridinaDokumen6 halaman1,2 DihidropiridinaDaniela IbarraBelum ada peringkat
- Seminario FURFURALDokumen35 halamanSeminario FURFURALHéctor BalmoriBelum ada peringkat
- Reactividad de PiridinasDokumen109 halamanReactividad de PiridinasDemian Apokalyptyk100% (2)
- Reporte Practica 1 FINAL INDOLESDokumen11 halamanReporte Practica 1 FINAL INDOLESpukadalyBelum ada peringkat
- Separación ADN electroforesis agarosaDokumen15 halamanSeparación ADN electroforesis agarosaNeftalí MorenoBelum ada peringkat
- TropinonaDokumen5 halamanTropinonaMoises Valdivia BaldomeroBelum ada peringkat
- Síntesis de PirazolesDokumen3 halamanSíntesis de PirazolesEduardo Alejandro Guzmán CuevasBelum ada peringkat
- Previo 2 NitrotiofenoDokumen4 halamanPrevio 2 NitrotiofenoAngelicaBaezBelum ada peringkat
- Azoles 1,3 y 1,2: introducción a las reacciones químicas de adición y sustituciónDokumen16 halamanAzoles 1,3 y 1,2: introducción a las reacciones químicas de adición y sustituciónJahuey Unalesco100% (1)
- Propiedades y usos del indolDokumen5 halamanPropiedades y usos del indolrafael valdesBelum ada peringkat
- 2 Informe S2 - G3Dokumen17 halaman2 Informe S2 - G3Ruth Benavidez CarbajalBelum ada peringkat
- 3E8 DiosgeninaDokumen13 halaman3E8 DiosgeninaJuanManuelAmaroLuisBelum ada peringkat
- Sintesis de CumarinaDokumen2 halamanSintesis de CumarinaLia_Rainmoon0% (1)
- Practica 6.1química Orgánica IVDokumen8 halamanPractica 6.1química Orgánica IVLizziezamBelum ada peringkat
- Síntesis de FischerDokumen7 halamanSíntesis de FischerDav AlessiaBelum ada peringkat
- Fotorreduccion de La BenzofenonaDokumen8 halamanFotorreduccion de La BenzofenonaLinda Ramirez Anaya100% (1)
- Sintesis de IndolesDokumen4 halamanSintesis de IndolesVale Enriquez100% (1)
- RolandoDokumen4 halamanRolandoEfraínBelum ada peringkat
- Practica 8 Quimica Organica IIIDokumen7 halamanPractica 8 Quimica Organica IIINoel ReyesBelum ada peringkat
- Informe Reacción de HenryDokumen10 halamanInforme Reacción de HenryJhon GalloBelum ada peringkat
- CumarinasDokumen2 halamanCumarinasMarsel TrujilloBelum ada peringkat
- INFOGRAFIA PRÁCTICA 3 y 4 AZOLESDokumen3 halamanINFOGRAFIA PRÁCTICA 3 y 4 AZOLESFernando ValdezBelum ada peringkat
- SEA nitración tiofenoDokumen3 halamanSEA nitración tiofenoabdielo88Belum ada peringkat
- Informe 1 Sintesis Org.Dokumen7 halamanInforme 1 Sintesis Org.Omar Jhusset Quintero CastroBelum ada peringkat
- Previo 9. Ácido FenoxiacéticoDokumen4 halamanPrevio 9. Ácido FenoxiacéticoSofia López GarcíaBelum ada peringkat
- FenolftaleínaDokumen8 halamanFenolftaleínaRichardDiazChucosBelum ada peringkat
- Investigación Previa Practica No.3Dokumen12 halamanInvestigación Previa Practica No.3Alvarado Fernández Juan CarlosBelum ada peringkat
- OXIDACIÓN DE n-BUTANOL A n-BUTIRALDEHIDODokumen12 halamanOXIDACIÓN DE n-BUTANOL A n-BUTIRALDEHIDOKaz MeloBelum ada peringkat
- HidantoínasDokumen9 halamanHidantoínasNaty TitiBelum ada peringkat
- Adsorbentes porosos y no porosos: influencia de la naturaleza de la superficieDokumen3 halamanAdsorbentes porosos y no porosos: influencia de la naturaleza de la superficieYoali Asiain LeconaBelum ada peringkat
- Tema 7Dokumen45 halamanTema 7Daniel100% (1)
- Pirroles Sintesis y AplicacionesDokumen3 halamanPirroles Sintesis y AplicacionesAnonymous kpcIWGgLeBelum ada peringkat
- Clase Nº13 - Compuestos HeterocíclicosDokumen67 halamanClase Nº13 - Compuestos HeterocíclicosAlex Yuri Orellana Cortez100% (1)
- Síntesis de 3-metil-1-fenil-1,2-dihidropirazol-5-onaDokumen8 halamanSíntesis de 3-metil-1-fenil-1,2-dihidropirazol-5-onaNadia E Zepeda RodriguezBelum ada peringkat
- Azoles 11346Dokumen158 halamanAzoles 11346Karla VT100% (1)
- Antecedentes 2Dokumen3 halamanAntecedentes 2Julio Cesar FeruizBelum ada peringkat
- Practica 6Dokumen3 halamanPractica 6Diana Angelica Espinoza AguilarBelum ada peringkat
- Practica 1 Sintesis de FurfuralDokumen6 halamanPractica 1 Sintesis de FurfuralLuis Armando Velázquez CorralesBelum ada peringkat
- 6 Aromaticidad y SNADokumen25 halaman6 Aromaticidad y SNAsofia garcia moralesBelum ada peringkat
- Compuestos AromáticosDokumen41 halamanCompuestos AromáticosGENESIS GOMEZBelum ada peringkat
- Compuestos AromaticosDokumen19 halamanCompuestos AromaticosKarol Verenice Amaya MartinezBelum ada peringkat
- Compuestos AromaticosDokumen38 halamanCompuestos AromaticosMarianny Cuello BautistaBelum ada peringkat
- solicitado y tiene menos de como se pidióDokumen30 halamansolicitado y tiene menos de como se pidióAharónVázquez0% (1)
- (Isaac Asimov) Como Descubrimos El PetroleoDokumen25 halaman(Isaac Asimov) Como Descubrimos El PetroleoanyelgarciaBelum ada peringkat
- Antalogia Zonas Predominio en El Anal QuimDokumen214 halamanAntalogia Zonas Predominio en El Anal Quimsofia2006Belum ada peringkat
- Almacenamiento Agentes QuimicosDokumen22 halamanAlmacenamiento Agentes QuimicosVictor OlveraBelum ada peringkat
- BiosenalizacionDokumen44 halamanBiosenalizacionVictor OlveraBelum ada peringkat
- Códigos Secretos Del Samsung Galaxy S III Mini I8190LDokumen13 halamanCódigos Secretos Del Samsung Galaxy S III Mini I8190LHéctor Quincho ZevallosBelum ada peringkat
- Heterociclos Aromáticos y Saturados en FarmacosDokumen21 halamanHeterociclos Aromáticos y Saturados en FarmacosVictor OlveraBelum ada peringkat
- ProtecciónDokumen5 halamanProtecciónVictor OlveraBelum ada peringkat
- 2 Nomenclatura Anillos FusionadosDokumen24 halaman2 Nomenclatura Anillos FusionadosVictor OlveraBelum ada peringkat
- 2 Nomenclatura Anillos FusionadosDokumen24 halaman2 Nomenclatura Anillos FusionadosVictor OlveraBelum ada peringkat
- NOMENCLATURADokumen30 halamanNOMENCLATURAGuisella CervantesBelum ada peringkat
- Del Tequesquite Al AdnDokumen89 halamanDel Tequesquite Al Adnarcadia_hb75% (16)
- Presupuesto-184-19 Venta de Repuestos Municipalidad de Monzon - 290G-LC - 500 Horas ..Dokumen2 halamanPresupuesto-184-19 Venta de Repuestos Municipalidad de Monzon - 290G-LC - 500 Horas ..Miguel Angel Perales GuerraBelum ada peringkat
- Nota de Aula de Avionica AviocarDokumen99 halamanNota de Aula de Avionica Aviocarmayosti rodriguezBelum ada peringkat
- San Maximo El Confesor - Centurias Sobre La CaridadDokumen16 halamanSan Maximo El Confesor - Centurias Sobre La Caridadjorbar87Belum ada peringkat
- Cuaderno 220 IRAMDokumen182 halamanCuaderno 220 IRAMDanielMuñoz100% (5)
- Competencias que desarrolla el estudiante según la LOMLOEDokumen14 halamanCompetencias que desarrolla el estudiante según la LOMLOEOscal AndresBelum ada peringkat
- Lista 84 TemasDokumen3 halamanLista 84 TemasVanessa GutierrezBelum ada peringkat
- Sergio: ExitosoDokumen10 halamanSergio: ExitosoEstefany ZitarrozaBelum ada peringkat
- Guía 1 Simce OctavoDokumen8 halamanGuía 1 Simce OctavoIsmael Andres Vilches RebolledoBelum ada peringkat
- Puente peatonal Avenida Murillo VidalDokumen9 halamanPuente peatonal Avenida Murillo VidalRuben Xavier Hernandez SanchezBelum ada peringkat
- DestruyeDokumen22 halamanDestruyeChery CastilloBelum ada peringkat
- Desarrollo embrionario semanalDokumen9 halamanDesarrollo embrionario semanalJiménez Otamendi IsraelBelum ada peringkat
- GFPInFn135nGuian7nAuditornna 4360886e18c2952Dokumen13 halamanGFPInFn135nGuian7nAuditornna 4360886e18c2952Melany RuizBelum ada peringkat
- América y Las CrónicasDokumen14 halamanAmérica y Las CrónicasGema López MoralesBelum ada peringkat
- Aeropuerto de Berlín Willy BrandtDokumen8 halamanAeropuerto de Berlín Willy BrandtAna DCBelum ada peringkat
- Memoria DescriptivaDokumen37 halamanMemoria Descriptivayamilet839Belum ada peringkat
- Manual Concoa PDFDokumen4 halamanManual Concoa PDFMonica MezaBelum ada peringkat
- Il Parcial de Costos I 2do Trimestre. 2021Dokumen5 halamanIl Parcial de Costos I 2do Trimestre. 2021Valentina MoyaBelum ada peringkat
- Apunte Termodinamica - ASIMOV 06 - Resumen de FormulasDokumen17 halamanApunte Termodinamica - ASIMOV 06 - Resumen de FormulasDelfina100% (1)
- Teorema de Liouville (Mecánica Hamiltoniana)Dokumen3 halamanTeorema de Liouville (Mecánica Hamiltoniana)CARMEN MARIA BILLALOGOSBelum ada peringkat
- LA GUADALUPANA, UNA INTERPRETACIOìN PSICOANALIìTICADokumen19 halamanLA GUADALUPANA, UNA INTERPRETACIOìN PSICOANALIìTICAVALERIA AGUILARBelum ada peringkat
- PT-DIN-MV-004 Traslado de Compresora Con Motoniveladora V005Dokumen8 halamanPT-DIN-MV-004 Traslado de Compresora Con Motoniveladora V005andrecormeBelum ada peringkat
- DISTRIBUCIONESDokumen7 halamanDISTRIBUCIONESWincy Paez100% (1)
- Programa de Perforacion de Un Pozo ExploratorioDokumen104 halamanPrograma de Perforacion de Un Pozo ExploratorioCesar Bernal100% (2)
- Final BNDokumen4 halamanFinal BNandres penaBelum ada peringkat
- StratteraDokumen9 halamanStratteraAntonieta NunesBelum ada peringkat
- Infome ElectricidadDokumen44 halamanInfome ElectricidadTellez Erik100% (1)
- Can FDDokumen6 halamanCan FDnicolas pugaBelum ada peringkat
- Líneas de Transmisión PDFDokumen69 halamanLíneas de Transmisión PDFFernando FloresBelum ada peringkat
- Foro Choco FresaDokumen28 halamanForo Choco FresalarobertbandorquestaBelum ada peringkat
- Juegos de MesaDokumen19 halamanJuegos de Mesaeduardopineros100% (1)