Yelvi Erida FST
Diunggah oleh
Diamanta Vion Devona0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
16 tayangan90 halamanJudul Asli
Yelvi Erida Fst
Hak Cipta
© Attribution Non-Commercial (BY-NC)
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Attribution Non-Commercial (BY-NC)
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
16 tayangan90 halamanYelvi Erida FST
Diunggah oleh
Diamanta Vion DevonaHak Cipta:
Attribution Non-Commercial (BY-NC)
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 90
KARAKTERISASI ENZIM EKSTRASELULER
DAN PRODUK BIOSOLUBILISASI BATUBARA HASIL IRADIASI
GAMMA OLEH KAPANG Penicillium sp. DAN Trichoderma sp.
YELVI ERIDA
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARI HIDAYATULLAH
JAKARTA
2010 M / 1431 H
KARAKTERISASI ENZIM EKSTRASELULER
DAN PRODUK BIOSOLUBILISASI BATUBARA HASIL IRADIASI
GAMMA OLEH KAPANG Penicillium sp. DAN Trichoderma sp.
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains
Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah J akarta
YELVI ERIDA
106095003217
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARI HIDAYATULLAH
JAKARTA
2010 M / 1431 H
Bismillaahirrahmaanirrahiim
Sesungguhnya pada pertukaran malam dan siang itu dan pada apa
yang diciptakan Allah di langit dan di bumi, benar-benar terdapat tanda-
tanda (kekuasaan-Nya) bagi orang-orang yang bertakwa (QS. Yunus: 6)
Pengetahuan diperlikan karena ia adalah akar, tempat bertaut cabang.
Setiap sayap tak akan mampu terbang melintasi kekuasaan samudra.
Hanya ilmu yang terlimpah lansung dari Allah dapat mengantarkan
seseorang dari haribaan-Nya (Anonim)
Skripsi ini dipersembahkan
Teruntuk kedua orang tua dan keluarga tercinta
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI BENAR-
BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJ UKAN
SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI
ATAU LEMBAGA MANAPUN.
J akarta, Desember 2010
Yelvi Erida
106095003217
YELVI ERIDA
Karakterisasi Enzim Ekstraseluler dan Produk
Biosolubilisasi Batubara Hasil Iradiasi Gamma
oleh Kapang Penicillium sp. dan Trichoderma sp.
J AKARTA
2010 M / 1431 H
ABSTRAK
Karakterisasi Enzim Ekstraseluler dan Produk Biosolubilisasi Batubara Hasil
Iradiasi Gamma oleh Kapang Penicillium sp. dan Trichoderma sp.
Biosolubilisasi adalah teknologi yang memiliki potensi untuk mengubah padatan
batubara menjadi bahan bakar cair atau kimia. Tujuan dari penelitian ini adalah
untuk mengkarakterisasi enzim ekstraseluler dan mengetahui produk
biosolubilisasi batubara hasil iradiasi gamma oleh kapang Penicillium sp. dan
Trichoderma sp. Dosis iradiasi gamma yang digunakan pada batubara adalah 5
kGy dan batubara yang tidak diiradiasi. Parameter yang diukur adalah uji
kualitatif enzim ekstraseluler kapang (fenoloksidase, lignin peroksidase, dan Mn-
peroksidase), pH medium, nilai absorbansi hasil biosolubilisasi batubara (
250 nm
and
450 nm
), pengukuran hidrolisis FDA, pengukuran kadar protein ekstraseluler
kapang dengan metode Lowry, analisis senyawa hasil biosolubilisasi batubara
dengan GC-MS dan karakteristik enzim ekstraseluler dengan SDS-PAGE. Hasil
penelitian menunjukkan bahwa kedua kapang memiliki ketiga jenis enzim dan
iradiasi gamma pada batubara (5 kGy) tidak mempengaruhi pH medium,
biosolubilisasi, hidrolisis FDA dan kadar protein ekstraseluler kecuali pada
karakteristik enzim ekstraseluler kapang Trichoderma sp. Enzim yang terdeteksi
pada kapang Penicillium sp. adalah mangan peroksidase (BM=48 KDa) dan
lakase (BM=56 KDa) baik pada batubara yang tidak diiradiasi (0 kGy) dan
batubara yang diiradiasi (5 kGy), sedangkan pada kapang Trichoderma sp.
terdeteksi hanya lakase (BM=56 KDa) pada batubara yang diiradiasi (5 kGy)
dan mangan peroksidase (BM=48 KDa) dan lakase (BM=56 KDa) pada batubara
yang tidak diiradiasi (0 kGy). Produk solubilisasi menunjukkan kecenderungan
setara bensin pada perlakuan batubara yang diiradiasi dan tidak diiradiasi untuk
Trichoderma sp., sedangkan Penicillium sp. hanya pada batubara yang tidak
diiradiasi.
Kata kunci: batubara, biosolubilisasi, enzim ekstraseluler, iradiasi gamma,
Penicillium sp. dan Trichoderma sp.
ABSTRACT
Characterization of Extracellular Enzyme And Biosolubillization Product of
Gamma Irradiation Coal By Penicillium sp. and Trichoderma sp.
Biosolubilization is a technology that has a potential for converting solid coal into
liquid fuel or chemical. The objectives of this research were to characterize
extracellular enzyme and to know biosolubillization products of gamma
irradiation coal by Penicillium sp. and Trichoderma sp. The dosages which has
been used for gamma irradiation were 5 kGy and unirradiated coal. The
parameters were the qualitative test of extracellular enzyme enzyme
(phenoloxidase, peroxidase, and Mn-peroxidase), pH of medium, absorbance of
the coal biosulubilization (
250 nm
and
450 nm
), hydrolysis of FDA, protein
concentration by Lowry method, analysis of coal biosolubilization product by
GC-MS, and characteristics of the extracellular enzyme by SDS-PAGE. The result
showed both of fungi were positive for all enzymes test and the gamma irradiated
did not effect on the pH medium, biosolubilization, FDA hydrolysis and
extracellular protein concentration but effected on the characteristic of
extracellular enzyme from Trichoderma sp. The enzymes detected from
Penicillium sp. were manganese-peroxidase (MW =48 KDa) and laccase (MW =
56 KDa) in both irradiated coal (5 kGy) and unirradiated coal (0 kGy), whereas on
Trichoderma sp. was detected only laccase (MW =56 KDa) in irradiated coal (5
kGy), and manganese-peroxidase (MW =48 KDa) and laccase (MW =56 KDa)
in unirradiated coal (0 kGy). The biosolubilization product showed the similarity
with gasoline in irradiated and unirradiated coal for Trichoderma sp., but for
Penicillium sp. only occurred on unirradiated coal .
Keywords: biosolubilzation, coal, extracellular enzyme, gamma iradiation,
Penicillium sp., and Trichoderma sp.
KATA PENGANTAR
Puji syukur yang dalam penulis sampaikan kehadiran Allah Yang Maha
Pemurah, karena berkat kemurahan-Nya skripsi ini dapat penulis selesaikan sesuai
dengan yang diharapkan, dalam skripsi ini penulis mengambil judul tentang
Karakterisasi Enzim Ekstraseluler dan Produk Biosolubilisasi Batubara
Hasil Iradiasi Gamma oleh Kapang Penicillium sp. dan Trichoderma sp.
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada Program
Studi Biologi Universitas Islam Negeri Syarif Hidayatullah J akarta.
Shalawat dan salam senantiasa tercurahkan kepada junjungan Nabi
Muhammad SAW beserta para sahabat, keluarga, dan pengikut-pengikut beliau
hingga hari akhir.
Pada kesempatan ini penulis tidak lupa mengucapkan terima kasih yang
sebesar-besarnya atas bimbingan dan saran-saran serta pentunjuk kepada :
1. `Dr. Sopiansyah J aya Putra, M.Sis, selaku Dekan Fakultas Sains dan
Teknologi Universitas Islam Negeri Syarif Hidayatullah J akarta.
2. Dr. Lily Surraya Eka Putri, M.Env.Stud selaku Ketua Program Studi
Biologi Fakultas sains dan Teknologi.
3. Irawan Sugoro, M.Si dan Megga Ratnasari Pikoli, M.Si selaku
Pembimbing I dan Pembimbing II, yang dengan sabar memberikan
petunjuk serta bimbingan, sehingga penulis dapat menyelesaikan
penelitian dan penyusunan skripsi ini.
4. Dra. Nani Radiastuti, M.Si dan La Ode Sumarlin, M.Si, selaku Penguji I
dan II pada seminar proposal dan seminar hasil yang telah memberikan
pengarahan dalam penyusunan skripsi ini.
5. Dr. Lily Surraya Eka Putri, M.Env.Stud dan Dasumiati, M.Si, selaku
Penguji I dan II pada sidang Munagosyah yang telah memberikan
pengarahan dalam penyusunan skripsi ini.
6. Kedua orang tua tercinta, Mama dan Papa yang selalu hidup di hati penulis
sampai kapanpun, yang telah memberikan kasih sayang, doa, dan
pengorbanan yang tak terkira demi kehidupan dan masa depan penulis.
i
7. Bang Ary dan Adek-adekku (Ade, Syahrul, Ilham dan Putra) yang telah
memberi perhatian, semangat dan keceriaan pada penulis sehingga segala
kepenatan dapat terobati dalam penulisan skripsi ini (Love You All).
8. Keluarga besar penulis ( Nenek, Kakek, Mak wo, Nte nana, Mama ii, Nte
titi, Nte ja, Ni on, Om yos, Om pen, ka pup dan Uncu) yang selalu
memberi motivasi, kasih sayang, doa maupun materi pada penulis.
9. Keluarga di Citayam (Nte fifi, Om rid, Om al dan Nte adek) yang selalu
memberikan motivasi, doa, perhatian dan kasih sayang kepada penulis.
10. Mitha, Riska, Dede, Astri dan Rian yang menemani penulis dalam
melaksanakan Penelitian di Batan (makasih atas kerjasamanya plend).
11. Biologi Angkatan 2006 khususnya ayang-ayangan (Rinae, Ise, Noe yang
selalu menemeni penulis) dan teman-teman seperjuanganku, Nene, Anggi,
Lidi, Mpit, Nungky, Nita, Zian, Hera, Eko, Ipin, Muhe, Deden, Malik,
Iqbal, Adeng, dan Geleng) tetap kompak sampai kapanpun.
12. Teman masa kecil penulis ( Ami, Yelin dan Ci) atas doa dan perhatiannya.
13. Pihak-pihak lain yang tidak bisa saya sebutkan satu persatu, tapi saya
ucapkan sekali lagi banyak terima kasih karena dengan bantuan semuanya
segala masalah dapat terselesaikan dengan lebih mudah dan mendapatkan
hasil yang baik.
Harapan penulis semoga skripsi ini dapat bermanfaat bagi penulis
khususnya serta para pembaca umumnya dalam melengkapi ilmu pengetahuan
yang berhubungan dengan Karakterisasi Enzim Ekstraseluler dan Produk
Biosolubilisasi Batubara Hasil Iradiasi Gamma oleh Kapang Penicillium sp.
dan Trichoderma sp. Akhir kata hanya kepada Allah SWT dipanjatkan doa
untuk membalas segala budi baik untuk semua pihak yang terkait.
J akarta, 14 November 2010
Yelvi Erida
ii
DAFTAR ISI
Halaman
KATA PENGANTAR ................................................................................ i
DAFTAR ISI ............................................................................................... iii
DAFTAR GAMBAR .................................................................................. vi
DAFTAR TABEL .................................................................................... vii
DAFTAR LAMPIRAN ............................................................................ viii
BAB I PENDAHULUAN
1.1 Latar Belakang ............................................................... 1
1.2 Perumusan Masalah........................................................ 3
1.3 Hipotesis.......................................................................... 4
1.4 Tujuan Penelitian............................................................ 4
1.5 Manfaat Penelitian.......................................................... 5
BAB II TINJAUAN PUSTAKA
2.1 Batubara.......................................................................... 6
2.1.1 Penyusun Batubara.............................................. 6
2.1.2 Klasifikasi Batubara ........................................... 7
2.2 Biosolubilisasi Batubara................................................. 9
2.3 Kapang Pengsolubilisasi Batubara.................................. 10
2.3.1 Kapang Trichoderma sp. .................................... 12
2.3.2 Kapang Penicillium sp. .... ................................. 14
2.4 Enzim.............................................................................. 15
2.5 Kromatografi Gas Spektroskopi Massa (GCMS) ........... 20
2.6 Elektroforesis.................................................................. 21
2.7 Iradiasi Gamma .............................................................. 23
BAB III METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian ....................................... 24
iii
3.2 Alat dan Bahan .............................................................. 24
3.3 Cara Kerja ..................................................................... 25
3.3.1 Persiapan Serbuk Batubara ................................ 25
3.3.2 Pembuatan Medium .... ...................................... 25
3.3.2.1 Medium Potato Dextrose Agar (PDA) .... 25
3.3.2.2 Medium Minimal Salt (MMS) .... .......... 26
3.3.2.3 Medium Potato Dextrose Agar Minimal
Salt (PDAM) .... ..................................... 26
3.3.2.4 Medium Minimal Salt +Sukrosa (MMSS)
............................................................................ 26
3.3.3 Peremajaan Kultur Kapang ................................ 27
3.3.4 Kultur Inokulum Spora .... ................................. 27
3.3.5 Uji Enzim Ekstraseluler .... ................................ 27
3.3.5.1 Fenoloksidase ........................................ 27
3.3.5.2 Peroksidase ............................................ 27
3.3.5.3 Mangan Peroksidase .... ......................... 28
3.3.6 Pengukuran pH Medium .................................... 28
3.3.7 Pengujian Biosolubilisasi Batubara .................... 28
3.3.7.1 Pengukuran Biosolubilisasi Batubara .... 29
3.3.8 Pengukuran Hidrolisis FDA .............................. 30
3.3.9 Pengukuran Kadar Protein Ekstraseluler
dengan Metode Lowry ....................................... 30
3.3.10 Analisis Hasil Biosolubilisasi Batubara
oleh Kapang Penicilium sp. dan
Trichoderma sp. Dengan Menggunakan
GC-MS................................................................ 31
3.3.11 Karakteristik Enzim Ekstraseluler dengan
Elektroforesis ..................................................... 31
3.4 Analisis Data ................................................................. 33
BAB IV HASIL DAN PEMBAHASAN
4.1 Hasil Analisis Kualitatif Enzim Ekstraseluler Kapang... 34
4.2 Hasil Pengukuran pH Medium Kapang.......................... 35
4.3 Hasil Biosolubilisasi Batubara........................................ 38
iv
4.4 Hasil Hidrolisis FDA ...................................................... 44
4.5 Hasil Kadar Protein Ekstraseluler Kapang...................... 46
4.6 Analisis Senyawa Hasil Biosolubilisasi Batubara
Menggunakan GC-MS.................................................... 49
4.7 Karakteristik Enzim Ekstraseluler Kapang Penicillium sp.
dan Trichoderma sp. ..................................................... 53
BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan..................................................................... 56
5.2 Saran................................................................................ 56
DAFTAR PUSTAKA.................................................................................. 57
LAMPIRAN................................................................................................... 61
.
v
DAFTAR GAMBAR
Halaman
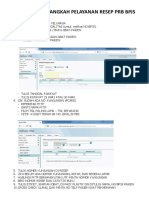
Gambar 1. Klasifikasi Batubara...................................................................... 8
Gambar 2. Kapang Trichoderma sp. ............................................................. 12
Gambar 3. Kapang Penicillium sp. . .............................................................. 15
Gambar 4. Uji kualitatif adanya enzim ekstraseluler kapang Penicillium sp.
dan Trichoderma sp. ..................................................................... 34
Gambar 5. Nilai pH medium kapang Penicillium sp. dan Trichoderma sp.... 37
Gambar 6. Nilai absorbansi supernatan pada panjang gelombang 250 nm
hasil biosolubilisasi kapang Penicillium sp. (A) dan
Trichoderma sp. (B)...................................................................... 39
Gambar 7.Nilai absorbansi supernatan pada panjang gelombang 450 nm
hasil biosolubilisasi kapang Penicillium sp. (A) dan
Trichoderma sp (B)....................................................................... 41
Gambar 8. Nilai absorbansi pada panjang gelombang 490 nm hasil aktivitas
enzim kapang Penicillium sp. (A) dan Trichoderma sp. (B).. . ... 45
Gambar 9. Nilai kadar protein ekstraseluler kapang Penicillium sp.(A) dan
Trichoderma sp. (B)...................................................................... 47
Gambar 10.Karakteristik enzim ekstraseluler kapang Penicillium sp. dan
Trichoderma sp. pada medium yang mengandung batubara yang
tidak diiradiasi (0 kGy) dan batubara yang diiradiasi (5 kGy)...... 54
vi
DAFTAR TABEL
Halaman
Tabel 1. Enzim ekstraseluler pendegradasi lignin dari kapang
pelapuk putih (White Rot Fungi) ..................................................... 18
Tabel 2. Komposisi medium perlakuan ......................................................... 25
Tabel 3. Data perlakuan kultur kapang .......................................................... 29
Tabel 4. Senyawa hasil biosolubilisasi batubara menggunakan GC-MS........ 51
vii
viii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Kerangka berpikir.................................................................... 61
Lampiran 2. Bagan kerja ............................................................................ 62
Lampiran 3. Komposisi medium ................................................................ 63
Lampiran 4. Komposisi reagen Lowry ....................................................... 63
Lampiran 5. Komposi larutan elektroforesis .............................................. 64
Lampiran 6. Hasil pengujian pH medium kapang....................................... 65
Lampiran 7. Hasil pengujian biosolubilisasi batubara................................. 65
Lampiran 8. Hasil pengujian hidrolisis FDA.............................................. 65
Lampiran 9. Hasil pengujian kadar protein ekstraseluler kapang................ 66
Lampiran 10. Kurva standar protein BSA..................................................... 66
Lampiran 11. Kurva standar marker.............................................................. 67
Lampiran 12. Uji statistik analisis varians..................................................... 68
Lampiran 13. Kromatogram hasil GC-MS kontrol ....................................... 70
Lampiran 14. Kromatogram hasil GC-MS biolubilisasi batubara oleh
kapang Penicillium sp. ........................................................... 71
Lampiran 15. Kromatogram hasil GC-MS biosolubilisasi batubara oleh
kapang Trichoderma sp. ........................................................ 72
Lampiran 16. Foto-foto hasil biosolubilisasi batubara. . ............................. 73
BAB I
PENDAHULUAN
1.1. Latar Belakang
Kebutuhan bahan bakar minyak mengalami peningkatan dari tahun ke tahun,
sedangkan cadangan minyak mentah diperkirakan akan habis dalam kurun waktu
20 tahun. Sumber energi yang akan memegang peranan yang penting adalah
batubara. Indonesia memiliki cadangan batubara sekitar 36,3 juta ton dan 49 %
dari cadangan tersebut masih dalam bentuk batubara peringkat rendah.
Penggunaan batubara terutama untuk kebutuhan energi listrik, tetapi Indonesia
tidak mungkin membakar habis batubara dalam bentuk PLTU karena akan
mengotori lingkungan dengan dihasilkannya polutan seperti sulfur oksida (SOx),
nitrogen oksida (NOx), karbondioksida (CO2) dan logam berat. Salah satu solusi
untuk mengatasi masalah kelangkaan bahan bakar minyak adalah dengan
mengolah batubara sehingga menjadi energi bersih seperti melalui proses
pencairan batubara (Novia et al., 2009).
Biosolubilisasi batubara adalah suatu upaya untuk mencairkan batubara
yang nantinya dapat digunakan sebagai bahan bakar pengganti minyak bumi. Pada
umumnya metode yang digunakan dalam proses pencairan batubara adalah
dengan metode kimia dan fisika. Kelemahan metode kimia dan fisika yaitu
membutuhkan biaya operasional yang cukup tinggi karena prosesnya dilakukan
dalam temperatur dan tekanan yang tinggi, memerlukan instalasi yang cukup
rumit dan menghasilkan CO
2
dua kali lipat dari bahan bakar minyak biasa.
1
2
Alternatif lainnya dengan metode biologi yaitu dengan bantuan mikroorganisme.
Pencairan batubara dengan metode biologi relatif dapat menekan biaya
operasional karena tidak dilakukan dalam tekanan dan temperatur yang tinggi
serta lebih ramah lingkungan karena tidak menghasilkan produk sampingan yang
berbahaya (Scott et al., 1991). Hasil biosolubilisasi batubara akan menghasilkan
senyawa yang setara dengan autput minyak bumi (Cohen et al., 1990).
Mikrooganisme dapat diterapkan dalam proses biosolubilisasi batubara
(Laborda et al., 1999). Menurut Cohen dan Gabriele (1982) mikroorganisme
menggunakan material batubara sebagai sumber energi untuk pertumbuhan dan
kemampuannya dalam mensolubilisasi batubara. Mikroorganisme yang digunakan
dalam penelitian ini adalah kapang Penicillium sp. dan Trichoderma sp. Penelitian
Sugoro et al. (2009) membuktikan bahwa kapang Penicillium sp. dan
Trichoderma sp. memiliki nilai absorbansi tertinggi, artinya kapang tersebut telah
melakukan pendegradasian batubara tertinggi dan mampu tumbuh menggunakan
medium batubara. Pembuktian ini diperkuat oleh penelitian Laborda et al. (1999)
membuktikan bahwa kapang Penicillium sp. dan Trichoderma sp. terlibat dalam
proses biosolubilisasi batubara. Biosolubilisasi batubara oleh kapang Penicillium
sp. dan Trichoderma sp. tumbuh dengan adanya batubara.
Biosolubilisasi batubara melibatkan enzim. Enzim-enzim ekstraseluler yang
berperan dalam biosolubilisasi batubara adalah peroksidase, esterase,
fenoloksidase, mangan peroksidase, lignin peroksidase dan lakase (Laborda et al.,
1999; Fakuosa dan Hofrichter, 1999). Enzim peroksidase terdiri dari lignin
peroksidase dan mangan peroksidase. Lignin peroksidase, mangan peroksidase
3
dan lakase, masing-masing mempunyai berat molekul 38-47 KDa, 38-50 KDa,
dan 53-110 KDa (Fakuosa dan Hofrichter, 1999).
Biosolubilisasi dapat ditingkatkan dengan cara praperlakuan terhadap
batubara. Batubara diiradiasi dengan iradiasi gamma. Pemakaian dosis dalam
iradiasi gamma mempengaruhi proses biosolubilisasi batubara karena pada
iradiasi terjadi proses oksidasi yang dapat menghasilkan senyawa asam. Penelitian
ini menggunakan batubara yang tidak diiradiasi (0 kGy) dan batubara yang
diiradiasi (5 kGy) (Selvi, 2009). Pemakaian dosis iradiasi gamma bertujuan untuk
mengubah senyawa kompleks pada batubara menjadi senyawa sederhana sehingga
hasil biosolubilisasi batubara menjadi lebih sempurna. Selain itu, iradiasi gamma
dapat meningkatkan site adsorpsi pada batubara sehingga enzim atau sel dapat
bekerja maksimum (Sugoro, 2009).
Berdasarkan uraian di atas, tujuan dari penelitian ini adalah untuk
mengetahui pengaruh batubara hasil iradiasi gamma terhadap karakteristik enzim
ekstraseluler dari kultur kapang Penicillium sp. dan Trichoderma sp. Hasil
penelitian ini diharapkan dapat memberikan informasi tentang enzim ekstraseluler
yang mampu mensolubilisasi batubara.
1.2. Perumusan Masalah
1. Apakah ada pengaruh iradiasi gamma pada batubara terhadap kadar
protein ekstraseluler kultur kapang Penicillium sp. dan Trichoderma sp.?
4
2. Apakah ada perbedaan karakteristik enzim ekstraseluler kultur kapang
Penicillium sp. dan Trichoderma sp. dalam medium yang mengandung
batubara hasil iradiasi gamma?
3. Apakah ada perbedaan produk biosolubilisasi batubara oleh Penicillium
sp. dan Trichoderma sp. dalam medium yang mengandung batubara hasil
iradiasi gamma?
1.3. Hipotesis
1. Iradiasi gamma pada batubara berpengaruh terhadap kadar protein
ekstraseluler kapang Penicillium sp. dan Trichoderma sp.
2. Karakteristik enzim ekstraseluler kultur kapang Penicillium sp. dan
Trichoderma sp. dalam medium yang mengandung batubara hasil iradiasi
gamma berbeda.
3. Produk biosolubilisasi batubara oleh Penicillium sp. dan Trichoderma sp.
dalam medium yang mengandung batubara hasil iradiasi gamma berbeda.
1.4. Tujuan Penelitian
1. Mengetahui pengaruh iradiasi gamma pada batubara terhadap kadar
protein ekstraseluler kultur kapang Penicillium sp. dan Trichoderma sp.
2. Mengetahui karakteristik enzim ekstraseluler kultur kapang Penicillium
sp. dan Trichoderma sp. dalam medium yang mengandung batubara hasil
iradiasi gamma.
5
3. Mengetahui perbedaan produk biosolubilisasi batubara oleh Penicillium
sp. dan Trichoderma sp. dalam medium yang mengandung batubara hasil
iradiasi gamma.
1.5. Manfaat Penelitian
Karakteristik enzim ekstraseluler kultur kapang Penicillium sp. dan
Trichoderma sp. diharapkan dapat memberikan informasi tentang enzim-enzim
yang mampu mensolubilisasi batubara.
BAB II
TINJAUAN PUSTAKA
2.1. Batubara
Batubara adalah mineral organik yang dapat terbakar, terbentuk dari sisa
tumbuhan purba yang mengendap yang selanjutnya berubah bentuk akibat proses
fisika dan kimia yang berlangsung jutaan tahun. Oleh karena itu, batubara
termasuk dalam kategori bahan bakar fosil, proses yang mengubah tumbuhan
menjadi batubara tadi disebut dengan pembatubaraan. Batubara adalah batuan
yang mudah terbakar yang lebih dari 50%-70% berat volumenya merupakan
bahan organik. Bahan organik utamanya yaitu tumbuhan yang dapat berupa kulit
pohon, daun, akar, spora, polen, dan lain-lain. Selanjutnya bahan organik tersebut
mengalami berbagai tingkat pembusukan (dekomposisi) sehingga menyebabkan
perubahan sifat-sifat fisik maupun kimia baik sebelum ataupun sesudah tertutup
oleh endapan lainnya (Speight, 1994).
2.1.1. Penyusun Batubara
Menurut Speight (1994) batubara berasal dari sisa tumbuhan diperkuat
dengan ditemukannya fosil tumbuhan di dalam lapisan batubara. Dalam
penyusunannya batubara diperkaya dengan berbagai macam polimer organik yang
berasal dari antara lain karbohidrat, lignin, dan protein.
Lignin merupakan suatu unsur yang memegang peranan penting dalam
mengubah susunan sisa tumbuhan menjadi batubara. Sementara ini susunan
6
7
molekul umum dari lignin belum diketahui dengan pasti, namun susunannya dapat
diketahui dari lignin yang terdapat pada berbagai macam jenis tanaman. Sebagai
contoh lignin yang terdapat pada rumput (Hatakka, 2001).
Karbohidrat terdiri dari disakarida, trisakarida, ataupun polisakarida. Jenis
polisakarida inilah yang umumnya menyusun batubara, karena dalam tumbuhan
jenis inilah yang paling banyak mengandung polisakarida (khususnya selulosa)
yang kemudian terurai dan membentuk batubara (Speight, 1994)
Protein merupakan bahan organik yang mengandung nitrogen yang selalu
hadir sebagai protoplasma dalam sel mahluk hidup. Struktur dari protein pada
umumnya adalah rantai asam amino yang dihubungkan oleh rantai amida. Protein
pada tumbuhan umunya muncul sebagai steroid (Laborda et al.,1999).
2.1.2. Klasifikasi Batubara
Batubara diklasifikasikan berdasarkan tingkat pembatubaraan dan tujuan
pemanfaatannya. Misalnya, batubara bituminus banyak digunakan untuk bahan
bakar pembangkit listrik, pada industri baja atau genteng serta industri semen.
Tipe batubara berdasarkan tingkat pembatubaraan ini dapat dikelompokkan yaitu
lignit, subbituminus, bituminus, dan antrasit (American Coal Foundation, 2007).
8
A. B.
C. D.
Gambar 1. Klasifikasi batubara (American Coal Foundation, 2007)
(A. lignit; B. subbituminus; C. bituminus; dan C. antrasit)
Lignit merupakan batubara muda dengan kualitas terendah. Lignit adalah
batubara yang sangat lunak dan mengandung air 70% dari beratnya. Batubara ini
berwarna hitam, sangat rapuh, nilai kalor rendah dengan kandungan karbon yang
sangat sedikit, kandungan abu dan sulfur yang banyak (Gambar 1 A). Batubara
jenis ini dijual secara eksklusif sebagai bahan bakar untuk pembangkit listrik
tenaga uap (PLTU).
Subbituminus merupakan batubara yang berada di antara batubara lignit
dan bituminus, terutama digunakan sebagai bahan bakar untuk PLTU. Batubara
9
subbituminus mengandung sedikit karbon dan banyak air, oleh karena itu menjadi
sumber panas yang tidak efisien (Gambar 1 B).
Bituminus adalah batubara yang tebal, biasanya berwarna hitam
mengkilat, terkadang coklat tua (Gambar 1 C). Batubara bituminus mengandung
86% karbon dari beratnya dengan kandungan abu dan sulfur yang sedikit.
Umumnya dipakai untuk PLTU, tapi dalam jumlah besar juga dipakai untuk
pemanas dan aplikasi sumber tenaga dalam industri.
Antrasit adalah batubara peringkat teratas, biasanya dipakai untuk bahan
pemanas ruangan di rumah dan perkantoran. Batubara antrasit berbentuk padat,
keras dengan warna hitam mengkilat dan mengandung antara 86% 98% karbon
dari beratnya, terbakar lambat, dengan nyala api berwarna biru dengan sedikit
sekali asap (Gambar 1 D).
2.2. Biosolubilisasi Batubara
Biosolubilisasi adalah proses pelarutan dalam suatu medium dengan bantuan
mikroorganisme. Biosolubilisasi dapat berupa upaya untuk mencairkan batubara
yang nantinya dapat digunakan sebagai bahan bakar pengganti minyak bumi. Di
samping untuk mencairkan batubara, biosolubilisasi dapat pula digunakan untuk
mengurangi kandungan sulfur atau logam toksik pada batubara (Faison et al.,
1989).
Batubara cair yang dihasilkan dari proses biosolubilisasi adalah berupa
campuran senyawa yang larut dalam air, senyawa-senyawa polar dengan berat
molekul relatif lebih tinggi. Teknologi ini memiliki potensi besar, tetapi masih ada
sejumlah masalah yang harus dipecahkan tanpa adanya air atau pelarut yang
10
cocok, produk yang dihasilkan tetap padat. Produk terlarut ini memiliki
kandungan energi tinggi dan memungkinkan digunakan sebagai bahan bakar,
tetapi belum dapat digunakan sebagi bahan bakar sarana transportasi. Selain itu,
kebanyakan mikroorganisme membutuhkan gula dan media pertumbuhan lebih
dari dua minggu. Media murah dan mampu mempercepat pertumbuhan
mikroorganisme untuk aplikasi komersial. Produksi batubara cair dapat dilakukan
dengan memanfaatkan enzim hasil isolasi mikroorganisme (Liu et at., 1989).
2.3. Kapang Pengsolubilisasi Batubara
Kapang (mould/filamentous fungi) merupakan mikroorganisme anggota
Kingdom Fungi yang membentuk hifa (Carlile dan Watkinson 1994). Kapang
bukan merupakan kelompok taksonomi yang resmi, sehingga anggota-anggota
dari kapang tersebar ke dalam filum Glomeromycota, Ascomycota, dan
Basidiomycota (Hibbett et al., 2007).
Sifat-sifat fisiologi kapang dipengaruhi oleh kebutuhan air, suhu
pertumbuhan, kebutuhan oksigen dan pH, makanan, dan komponen penghambat.
Pada umumnya kebanyakan kapang membutuhkan aw minimal untuk
pertumbuhan lebih rendah. Kapang bersifat mesofilik, yaitu tumbuh baik pada
suhu kamar. Suhu optimum pertumbuhan kapang adalah sekitar 25-30C, tetapi
ada beberapa dapat tumbuh pada suhu 35-37C atau lebih tinggi, misalnya
Aspergillus. Semua kapang bersifat aerofilik, yaitu membutuhkan oksigen untuk
pertumbuhannya. Kebanyakan kapang dapat tumbuh pada kisaran pH yang luas,
yaitu pH 2-8,5 tetapi biasanya pertumbuhannya akan lebih baik pada kondisi asam
11
atau pH rendah. Kapang dapat menggunakan berbagai komponen makanan dari
yang sederhana sampai kompleks. Kapang memproduksi enzim hidrolitik,
misalnya amilase, pektinase, proteinase, dan lipase. Kapang mengeluarkan
komponen yang dapat menghambat organisme lainnya. Komponen ini disebut
antibiotik. Pertumbuhan kapang biasanya berjalan lambat bila dibandingkan
pertumbuhan bakteri dan khamir (Fardiaz, 1989).
Habitat kapang sangat beragam, namun pada umumnya kapang dapat
tumbuh pada substrat yang mengandung sumber karbon organik (Carlile dan
Watkinson 1994). Kapang yang tumbuh dan mengkolonisasi bagian-bagian di
dalam ruangan telah banyak diteliti. Kapang tersebut mudah dijumpai pada
bagian-bagian ruangan yang lembab, seperti langit-langit bekas bocor, dinding
yang dirembesi air, atau pada perabotan lembab yang jarang terkena sinar
matahari. Genus kapang yang sering dijumpai tumbuh di dalam ruangan adalah
Cladosporium, Penicillium, Alternaria, dan Aspergillus (Mazur et al., 2006).
Kapang melakukan reproduksi dan penyebaran menggunakan spora. Spora
kapang terdiri dari dua jenis, yaitu spora seksual dan spora aseksual (Carlile dan
Watkinson 1994). Menurut Champe et al. (1981) dan Carlile dan Watkinson
(1994), spora aseksual dihasilkan lebih cepat dan dalam jumlah yang lebih banyak
dibandingkan spora seksual. Spora aseksual memiliki ukuran yang kecil (diameter
1-10 m) dan ringan, sehingga penyebarannya umumnya secara pasif
menggunakan aliran udara.
Sejumlah strain jamur dan bakteri berfilamen diketahui berinteraksi
dengan batubara kualitas rendah, melalui proses ekstraselular untuk menghasilkan
12
medium yang lebih gelap selama proses kultur atau cairan gelap pada permukaan
batubara ketika ditumbuhkan pada permukaan kultur agar. Diketahui bahwa
tedapat beberapa jenis mikroorganisme dari jenis bakteri maupun fungi yang
dapat mengubah batubara padat menjadi produk cair, dengan minimalisasi
hilangnya kandungan energi total awal (Faison et al., 1989).
2.3.1. Kapang Trichoderma sp.
Ciri-ciri spesifik kapang Trichoderma sp. adalah mempunyai konidia,
sterigmata, konidiofora, miselium berseptat (Gambar 2). Koloni kapang
Trichoderma sp. tersebut berumur 7 hari, penampakan koloninya dilihat
menggunakan mikroskop pada perbesaran 400 X (Kuraesin, 2009). Kapang
Trichoderma sp. mempunyai konidiofora bercabang banyak, ujung
percabangannya merupakan sterigma, membentuk konidia bulat atau oval,
berwarna hijau terang, dan berbentuk bola-bola berlendir ( Fardiaz, 1989).
A. Konidia
B. Sterigma
C. Konidiofora
Gambar 2. Kapang Trichoderma sp.( Kuraesin, 2009)
13
Kapang Trichoderma sp. diklasifikasikan menurut sistem nama binomial
yaitu: Kingdom Fungi; Filum Eumycota; Sub Filum Deuteromycota; Kelas
Hyphomycetes; Ordo Hyphomycetales; Famili Moniliaceae; Genus Trichoderma
dan Spesies Trichoderma sp. Koloni dari kapang Trichoderma sp. berwarna putih,
kuning, hijau muda, dan hijau tua. Susunan sel kapang Trichoderma sp. bersel
banyak berderet membentuk benang halus yang disebut dengan hifa. Hifa pada
jamur ini berbentuk pipih, bersekat, dan bercabang-cabang membentuk anyaman
yang disebut miselium. Miseliumnya dapat tumbuh dengan cepat dan dapat
memproduksi berjuta-juta spora, karena sifatnya inilah Trichoderma sp. dikatakan
memiliki daya kompetitif yang tinggi. Dalam pertumbuhannya, bagian permukaan
akan terlihat putih bersih, dan bermiselium kusam. Setelah dewasa, miselium
memiliki warna hijau kekuningan (Carlile dan Watkinson, 1994).
Trichoderma sp. adalah salah satu jamur tanah yang tersebar luas
(kosmopolitan), yang hampir dapat ditemui di lahan-lahan pertanian dan
perkebunan. Trichoderma sp. bersifat saprofit pada tanah, kayu, dan beberapa
jenis bersifat parasit pada jamur lain. Pada spesies saprofit, kapang tumbuh pada
kisaran suhu optimal 22-30C. Suhu optimal untuk pertumbuhan kapang ini
adalah 32-35C dan pH optimal sekitar 4.0. Trichoderma sp. berkembangbiak
secara aseksual dengan membentuk spora di ujung fialida atau cabang dari hifa
(Mazur et al., 2006).
Miselium Trichoderma sp. dapat menghasilkan suatu enzim yang
bermacam-macam, termasuk enzim selulase (pendegradasi selulosa) dan kitinase
(pendegradsi kitin). Oleh karena adanya enzim selulase, Trichoderma sp. dapat
14
tumbuh secara langsung di atas kayu yang terdiri atas selulosa sebagai polimer
dari glukosa. Oleh karena adanya kitinase, Trichoderma sp. dapat bersifat sebagai
parasit bagi jamur yang lainnya. Secara alami seseorang dapat sering menemukan
Trichoderma sp. yang menjadi parasit pada badan buah dan miselia dari jamur
yang lain (Carlile dan Watkinson, 1994).
Penelitian sebelumnya Sugoro et al. (2009) membuktikan bahwa kapang
Trichoderma sp. memiliki nilai absorbansi tertinggi, artinya berarti telah
melakukan pendegradasian batubara tertinggi pada hari ke-2 inkubasi yaitu 1,936.
Kapang Trichoderma sp. mampu tumbuh menggunakan medium batubara dan
memiliki nilai pH medium yang berfluktuasi, artinya telah terjadi proses degradasi
selama proses inkubasi.
2.3.2. Kapang Penicillium sp.
Ciri-ciri spesifik Penicillium sp. (Gambar 3) adalah mempunyai hifa
berseptat, konidia, sterigma , konidiospora (Kuraesin, 2009). Kapang Penicillium
sp. mempunyai hifa berseptat, miselium bercabang, konidiospora septat dan
muncul di atas permukaan, kepala yang membawa spora berbentuk seperti sapu
dengan sterigma muncul dalam berkelompok, dan konidia membentuk rantai
(Fardiaz, 1989).
15
A. Konidia
B. Sterigma
C. Konidiofora
Gambar 3. Kapang Penicillium sp. (Kuraesin, 2009)
Kapang Penicillium sp. diklasifikasikan menurut sistem nama binomial
yaitu: Kingdom Fungi; Filum Ascomycota; Kelas Eurotiomycetes; Ordo
Eurotiales; Famili Trichocomaceae; Genus Penicillium dan Spesies Penicillium
sp. Kapang Penicillium sp. banyak tersebar di alam. Penicillium juga digunakan
dalam industri untuk memproduksi antibiotik, misalnya penisilin yang diproduksi
oleh Penicillium notatum dan Penicillium chrysogenum (Fardiaz, 1989).
Pada hasil penelitian Sugoro et al. (2009) membuktikan bahwa kapang
Penicillium sp. memiliki nilai absorbansi tertinggi, artinya berarti telah melakukan
pendegradasian batubara tertinggi, mampu tumbuh menggunakan medium
batubara dan memiliki nilai pH medium yang berfluktuasi, artinya telah terjadi
proses degradasi selama proses inkubasi.
2.4. Enzim
Enzim adalah biokatalis atau substansi yang dapat mempercepat atau
membantu suatu reaksi kimia tanpa harus ikut terlibat di dalam reaksi itu sendiri.
Enzim ditemukan dalam setiap sel hidup, mulai dari organisme bersel tunggal
16
sederhana sampai organisme multiseluler yang kompleks, termasuk manusia.
Enzim termasuk molekul protein. Reaksi biokimia yang paling sering saat
mengaplikasian enzim secara industri adalah peruraian hidrolitik komponen bahan
pangan yang memiliki berat molekul (BM) tinggi seperti pati, protein, selulosa,
dan sebagainya (Poedjiadi dan Supriyanti, 2006). Setiap jenis enzim memiliki
kisaran pH tertentu yang sangat menentukan enzim beraktivitas secara optimal.
Enzim bersifat spesifik artinya hanya mengkatalisis suatu reaksi yang dirancang
khusus untuk enzim tertentu, misalnya pektinase hannya dapat mendegradasi
pektin, bukan pati atau selulosa. Sekitar 80% dari enzim industrial adalah enzim
hidrolitik, yang digunakan untuk depolimerisasi (pemecahan molekul-molekul
yang kompleks menjadi yang lebih sedarhana) bahan-bahan alami (Hidayat et al.,
2006).
Mikroba merupakan sumber penting dari beberapa jenis enzim. Sebagai
sumber enzim, mikroba memiliki beberapa kelebihan jika dibandingkan dengan
hewan maupun tanaman, yaitu : produksi enzim pada mikroba lebih murah,
kandungan enzim dapat diprediksi dan dikontrol, pasokan bahan baku terjamin,
dengan komposisi konstan dan mudah dikelola (Hidayat et al., 2006). Ada 3
keuntungan yang berkaitan dengan enzim ekstra sel : pertama, tidak memerlukan
proses penghancuran sel saat memanen enzim (proses penghancuran sel tidak
selalu mudah dilakukan dalam skala besar). Kedua, enzim protein yang
disekresikan keluar sel umumnya terbatas jenisnya. Ini berarti enzim ekstrim sel
terhindar dari kontaminasi berbagai jenis protein. Ketiga, secara alami enzim
disekresikan keluar sel umumnya lebih tahan terhadap proses denaturasi.
17
Ada tiga golongan utama sumber enzim yaitu tanaman, hewan, dan mikroba.
Enzim tanaman pada dasarnya diperoleh dari tanaman. Di antara kelompok ini
yang sudah dikenal luas yaitu papain, bromelin, ficin, dan enzim amilolitik dari
sereal, lipoksigenase dari kedelai dan specialized enzymes dari buah jeruk.
Sebagian besar enzim tanaman tersedia dalam bentuk unpurified powder extracts,
meski demikian ada juga yang tersedia dalam bentuk lain seperti papain dalam
bentuk stabilized dan purified liquid. Enzim dari hewan umumnya di peroleh dari
glandula. Sedangkan enzim mikrobial adalah diperoleh dari mikroba misalnya
yang bersumber dari fungi, bakteria maupun khamir seperti amilase, diastase,
lipase, dan sebagainya. Enzim yang berasal dari fungi menempati urutan teratas,
disusul dari bakteri dan khamir (Hidayat et al., 2006).
Penggolongan enzim berdasarkan tempat bekerjanya adalah endoenzim
dan eksoenzim. Endoenzim disebut juga enzim intraseluler, yaitu enzim yang
bekerjanya di dalam sel. Umumnya merupakan enzim yang digunakan untuk
proses sintesis di dalam sel dan untuk pembentukan energi (ATP) yang berguna
untuk proses kehidupan sel, misalnya dalam proses respirasi. Eksoenzim disebut
juga enzim ekstraseluler, yaitu enzim yang bekerjanya di luar sel. Umumnya
berfungsi untuk mencernakan substrat secara hidrolisis untuk dijadikan molekul
yang lebih sederhana dengan BM lebih rendah sehingga dapat masuk melalui
membran sel. Energi yang dibebaskan pada reaksi pemecahan substrat di luar sel
tidak digunakan selama proses kehidupan sel (Lehninger, 1982).
Kapang mendegradasi batubara menggunakan enzim ekstraseluler, hal
tersebut diperkuat dengan penelitian bahwa proses solubilisasi pada batubara
18
dikatalis melalui aktifitas enzim ekstratseluler (Ward, 1990). Enzim ekstraseluler
adalah enzim yang diekskresikan oleh kapang ke luar tubuhnya untuk
mendegradasi substrat. Enzim ekstraseluler tersebut akan menghasilkan medium
yang lebih gelap selama proses kultur cair atau cairan gelap pada permukaan
batubara ketika ditumbuhkan pada permukaan kultur agar (Faison et al., 1989).
Tabel 1. Enzim ekstraseluler pedegradasi lignin dari kapang pelapuk putih (white
rot fungi) (Akhtar et al., 1997).
Enzim Tipe enzim
Peran dalam
degradasi
Kerja bersama
dengan
Berat
Molekul
(KDa)
pH
optimum
LiP
(Lignin
peroksidase)
Peroksidase
Degradasi unit
nonfenolik
H
2
O
2
38-47
2,5-3,0
MnP
(Mangan
peroksidase)
Peroksidase
Degradasi unit
fenolik dan
non-fenolik
dengan lipid
H
2
O
2,
lipid
38-50
4,0-4,5
Lakase
Fenol
oksidase
Oksidasi unit
fenolik dan non
fenolik dengan
mediator
O
2,
mediator : 3-
hidroksibenzotriazol
53-110
3,5-7
Enzim pendegradasi lignin secara umum terdiri dari dua kelompok utama
yaitu lakase dan peroksidase yang terdiri dari lignin peroksidase dan mangan
peroksidase. Ketiga enzim tersebut bertanggung jawab terhadap pemecahan awal
polimer lignin dan menghasilkan produk dengan berat molekul rendah, larut
dalam air dan CO
2
(Akhtar et al., 1997). Mangan peroksidase (MnP), lignin
peroksidase (LiP) atau lakase mampu mendegradasi komponen aromatik di
batubara dan mendepolimerisasinya menjadi komponen yang kaya oksigen dan
dapat melarut ke dalam air (Holker et al., 2002).
19
Lignin peroksidase (LiP) merupakan enzim utama dalam proses degradasi
lignin karena mampu mengoksidasi unit non fenolik lignin. Unit non fenolik
merupakan penyusun sekitar 90 persen struktur lignin. Oksidasi substruktur lignin
yang dikatalis oleh LiP dimulai dengan pemisahan satu elektron cincin aromatik
substrat donor dan menghasilkan radikal aril. LiP memotong ikatan C-C
molekul lignin, pemotongan tersebut merupakan jalur utama perombakan lignin
oleh berbagai kapang pelapuk putih (Hammel, 1996).
Mangan peroksidase (MnP) berperan dalam oksidasi unit fenolik, sehingga
LiP dan MnP dapat bekerja secara sinergis. Siklus katalitik MnP dimulai dengan
pengikatan H2O2 atau peroksida organik dengan enzim ferric alami dan
pembentukan kompleks peroksida besi. Pemecahan ikatan oksigen peroksida
membutuhkan Fe okso-porpirin-radikal kompleks dalam pembentukan MnP-
komponen I, kemudian ikatan dioksigen dipecah dan dikeluarkan satu molekul air.
Reaksi berlangsung sampai terbentuk MnP-komponen II, ion Mn
2+
bekerja
sebagai donor 1-elektron untuk senyawa antara porfirin dan dioksidasi menjadi
Mn
3+
. Mn
3+
merupakan oksidasi kuat yang dapat mengoksidasi senyawa fenolik
tetapi tidak dapat menyerang unit non fenolik lignin (Perez et al., 2002).
Lakase ditemukan pada kapang, khamir, dan bakteri. Enzim ini tidak
membutuhkan H2O2 tetapi menggunakan molekul oksigen. Lakase mereduksi
oksigen menjadi H2O dalam substrat fenolik melalui reaksi satu elektron
membentuk radikal bebas yang dapat disamakan dengan radikal kation yang
terbentuk pada reaksi MnP (Kersten et al., 1990).
20
2.5. Kromatografi Gas Spektroskopi Massa (GC-MS)
Kromatografi Gas-Spektroskopi Massa atau sering disebut GCMS (Gas
Chromatography Mass Spectrometry) adalah teknik analisis yang
menggabungkan dua metode analisis yaitu Kromatografi Gas dan Spektroskopi
Massa. Kromatografi gas adalah metode analisis, dimana sampel terpisahkan
secara fisik menjadi bentuk molekul-molekul yang lebih kecil (hasil pemisahan
dapat dilihat berupa kromatogram). Sedangkan spektroskopi massa adalah metode
analisis, dimana sampel yang dianalisis akan diubah menjadi ion-ion gasnya, dan
massa dari ion-ion tersebut dapat diukur berdasarkan hasil deteksi berupa
spektrum massa (Hermanto, 2008).
Pada GC hanya terjadi pemisahan untuk mendapatkan komponen yang
diinginkan, sedangkan bila dilengkapi dengan MS (berfungsi sebagai detektor)
akan dapat mengidentifikasi komponen tersebut, karena bisa membaca spektrum
bobot molekul pada suatu komponen, juga terdapat reference pada software
(Hermanto, 2008).
Pemisahan komponen senyawa dalam GCMS terjadi di dalam kolom
(kapiler) GC dengan melibatkan dua fase, yaitu fase diam dan fase gerak. Fase
diam adalah zat yang ada di dalam kolom, sedangkan fase gerak adalah gas
pembawa (Helium maupun Hidrogen dengan kemurnian tinggi, yaitu 99,995%).
Proses pemisahan dapat terjadi karena terdapat perbedaan kecepatan alir dari tiap
molekul di dalam kolom. Perbedaan tersebut dapat disebabkan oleh perbedaan
afinitas antar molekul dengan fase diam yang ada di dalam kolom. Selanjutnya
komponen-komponen yang telah dipisahkan tersebut masuk ke dalam ruang MS
21
yang berfungsi sebagai detektor secara instrumentasi, MS adalah detektor bagi GC
(Hermanto, 2008).
2.6. Elektroforesis
Elektroforesis merupakan proses bergeraknya molekul bermuatan pada suatu
medan listrik. Kecepatan molekul yang bergerak pada muatan listrik tergantung
pada muatan, bentuk dan ukuran (Lehninger, 1982). Dengan demikian
elektroforesis dapat digunakan untuk separasi makromolekul (seperti protein dan
asam nukleat). Posisi molekul yang terseparasi pada gel dapat dideteksi dengan
pewarnaan.
Menurut Yuwono (2005), elektroforesis adalah suatu teknik pemisahan
molekul seluler berdasarkan atas ukurannya, dengan menggunakan medan listrik
yang dialirkan pada suatu medium yang mengandung sampel yang akan
dipisahkan. Kecepatan gerak molekul tergantung pada nisbah (rasio) muatan
terhadap massanya, serta tergantung pula pada bentuk molekulnya.
Kegunaan elektroforesis adalah menentukan berat molekul (estimasi).
Penetapan BM secara lebih teliti dapat dilakukan dengan ultrasentrifuge,
meskipun dengan elektroforesis cukup memenuhi syarat, dapat mendeteksi
terjadinya pemalsuan bahan, dapat mendeteksi terjadinya kerusakan bahan seperti
protein dalam pengolahan dan penyimpanan, untuk memisahkan spesies molekul
yang berbeda secara kualitatif, yang selanjutnya masing-masing spesies dapat
dianalisis dan menetapakan titik isoelektrik protein (Lehninger, 1982).
22
Salah satu jenis elektroforesis adalah elektroforesis SDS-PAGE. Sodium
Sodecyl Sulphate Polyacrylamide Gel Electrophoresis (SDS-PAGE) terutama
dilakukan untuk mengetahui apakah suatu protein monometrik ataukah
oligometrik, selain itu untuk menetapkan berat molekul dan jumlah rantai
polipeptida sebagai subunit atau monomer.
Pada mekanisme SDS-PAGE, protein bereaksi dengan SDS yang merupakan
deterjen anionic membentuk kompleks yang bermuatan negatif. Protein akan
terdenaturasi dan terlarut membentuk kompleks berikatan dengan SDS, berbentuk
elips atau batang, dan berukuran sebanding dengan berat molekul protein. Protein
dalam bentuk kompleks yang bermuatan negatif ini dipisahkan berdasarkan
muatan negatif ini dipisahkan berdasarkan muatan dan ukurannya secara
elektroforesis di dalam matriks gel poliakrilamid. Berat molekul protein dapat
diukur dengan menggunakan protein standar yang telah diketahui berat
molekulnya (Ummubalqis, 2000).
SDS-PAGE dilakukan pada pH normal. Pada metoda ini digunakan
anionic deterjent yang bersama dengan beta-merkaptoetanol dan pemanasan
menyebabkan rusaknya struktur tiga dimensi protein menjadi konfigurasi random
coil. Hal ini menyebabkan oleh terpecahnya ikatan disulfida yang selanjutnya
tereduksi menjadi gugus-gugus sulfihidril. SDS akan membentuk kompleks
dengan protein dan komleks ini bermuatan negatif karena gugus-gugus anion dari
SDS. Pada pH 7, SDS 1% dan merkaptoetanol 0,1 M sebagian besar rantai protein
mengikat sekitar 1,4 gr SDS per gram protein, dengan demikian jumlah SDS
yang terikat oleh protein adalah tetap. Oleh karena itu protein dapat dipisahkan
23
hanya berdasarkan ukurannya (BM) di dalam kompleks SDS protein yang lebih
besar mempunyai mobilitas yang lebih kecil dibandingkan dengan kompleks yang
lebih kecil (Hames, 1998).
2.7. Iradiasi Gamma
Iradiasi merupakan pemancaran suatu energi elektromagnetik atau partikel-
partikel dengan kecepatan tinggi. Iradiasi dapat dibedakan menjadi dua macam,
yaitu iradiasi panas dan iradiasi pengion. Iradiasi panas menggunakan frekuensi
rendah atau dengan panjang gelombang tinggi, misalnya infra merah. Iradiasi
pengion menggunakan frekuensi tinggi, misalnya sinar alfa (), sinar beta (), dan
sinar gamma (Akhadi, 1997). Aplikasi sumber iradiasi pengion telah meluas
dalam berbagai bidang. Pemanfaatan sumber iradiasi misalnya bidang kedokteran,
bidang industri dan bidang pertanian. Efek kerusakan yang ditimbulkan
bergantung pada jenis dan kualitas iradiasi karena mempunyai daya tembus yang
rendah dan bermuatan positif, bentuk sinar alfa () merupakan partikel inti He
yang bergerak cepat. Partikel beta () memiliki daya tembus lebih besar
dibandingkan sinar alfa () dan bermuatan negatif (Darussalam, 1996).
Sinar gamma merupakan jenis iradiasi yang bisa digunakan dalam berbagai
bidang karena muatan netral, panjang gelombang pendek dan daya tembus paling
tinggi sehingga energi sinar gamma yang dipancarkan sumber terhadap target
dapat menimbulkan perubahan pada komposisinya. Perubahan dapat terjadi secara
acak dan tiba-tiba. Besar kecilnya efek iradiasi gamma tergantung dari energi dan
jarak sumber radioaktif (Lehninger, 1994).
24
BAB III
METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian.
Penelitian ini dilakukan pada bulan April sampai dengan bulan J uli tahun
2010 dan bertempat di Badan Tenaga Nuklir Nasional, Pasar J umat J akarta.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah timbangan analitik,
mikropipet, refrigerator, sentrifuse, pH meter, spektrofotometer Uv-vis, autoklaf,
pipet tetes, Gas Chromatograph Mass Spectrometer (GC-MS) Shimadzu dan Mini
Protein-Gel Elektroforesis Atto.
Bahan yang digunakan dalam penelitian ini adalah batubara subbituminus,
kertas whatman No.1, alkohol 70 %, NaCl 0,85 %, isolat kapang Penicillium sp.
dan Trichoderma sp. koleksi dari BATAN (Irawan Sugoro), aseton, akuades,
medium Potato Dextrose Agar (PDA), Medium Minimal Salt (MMS), agar bakto,
sukrosa 1 %, Lowry I ( 2% Na
2
CO
3
dalam NaOH 0,1 N ; 2,7% K.Na tartat; 2%
CuSO
4
), Lowry II (Folin dan akuades (1:1) ), Larutan Standar BSA, buffer
sampel, Separating Gel (10%) dan Stacking Gel (45%), tanin, methylene blue,
manganese chloride, dan fluorescien diacetate.
25
3.3. Cara Kerja
3.3.1. Persiapan Serbuk Batubara
Batubara dihaluskan menggunakan mortar secara aseptik, kemudian
disaring menggunakan saringan berukuran 0,2 mm (70 mesh). Serbuk batubara
yang telah siap ditimbang sebanyak 5 gr dan dimasukkan ke dalam plastik
polyetilen. Serbuk batubara ditutup rapat dan diiradiasi gamma (5 kGy) dan tidak
diiradiasi (0 kGy).
3.3.2. Pembuatan Medium
Tabel 2. Komposisi medium perlakuan
No. Nama Medium
PDA
(ml)
Agar
bakto
(gr)
MMS
(ml)
Sukrosa
Serbuk
Batubara
Keterangan
1. Potato Dextrose
Agar Minimal Salt
(PDAM)
75 0,75 75 - -
Untuk peremajaan
kapang
2. Medium Minimal
Salt + Sukrosa
(MMSS
- - 600 1 % 2 %
Untuk proses
biosolubilisasi.
3.3.2.1. Medium Potato Dextrose Agar
Sebanyak 39 gr PDA dilarutkan dalam 1 liter akuades, kemudian
ditambahkan agar bakto sebanyak 10 gr. Medium PDA dipanaskan dengan
menggunakan hot plate dan magnetic stirer agar terlarut. Medium PDA tersebut
disterilisasi menggunakan autoklaf dengan suhu 121C selama 15 menit.
26
3.3.2.2. Medium Minimal Salt (MMS)
Sebanyak 0,52 gr MgSO
4.
7H
2
O; 0,003 gr ZnSO4.7H2O pH 5,5 ; 5 gr
K
2
HPO
4
; 0,005 gr FeSO
4
, dan 1 gr NH
4
(SO
4
) dilarutkan dalam 1 liter akuades,
kemudian dilarutkan sampai homogen. Medium MMS tersebut disterilisasi
menggunakan autoklaf dengan suhu 121C selama 15 menit (Silva et al., 2007).
3.2.2.3. Medium Potato Dextrose Agar Minimal Salt (PDAM)
Medium PDAM dibuat dengan mencampurkan medium PDA dan MMS
dengan perbandingan 1:1 atau 75 ml : 75 ml. Medium PDA ditambahkan 1 %
agar bakto atau 0,75 gr. Medium PDA dan MMS disterilisasi dulu menggunakan
autoklaf dengan suhu 121C dengan waktu 15 menit sebelum dicampurkan.
Medium PDAM dihomogenkan dengan cara pengadukan. Sebanyak 5 ml
dimasukkan tabung reaksi untuk peremajaan kapang pada tabung reaksi (agar
miring).
3.2.2.4. Medium Minimal Salt + Sukrosa (MMSS)
Sebanyak 600 ml MMS ditambahkan sukrosa sebanyak 1% (6 gr sukrosa)
lalu dihomogenkan, kemudian 100 ml MMSS dimasukkan ke dalam erlenmeyer.
MMSS disterilisasi menggunakan autoklaf dengan suhu 121C dengan waktu 15
menit.
27
3.3.3. Peremajaan Kultur Kapang
Sebanyak 5 ml medium PDAM di masukkan ke dalam tabung reaksi (untuk
agar miring). Kultur stok/isolat kapang diinokulasikan pada medium PDAM
tersebut menggunakan ose. Kultur kapang tersebut diinkubasi pada suhu ruang
sampai kapang menghasilkan spora, selama 5-7 hari pada suhu ruang.
3.3.4. Kultur Inokulum Spora
Kultur spora yang sudah diremajakan pada medium PDAM, kemudian
diambil sporanya menggunakan ose. Kultur spora pada medium ditambahkan 5 ml
NaCl steril 0,85 % sambil dilepaskan sporanya menggunakan ose, kemudian
dimasukkan ke dalam yellow tube steril.
3.3.5. Uji Enzim Ekstraseluler
3.3.5.1. Fenoloksidase
Pengujian berdasarkan reaksi kimia warna Bavendamm. Kapang
ditumbuhkan pada medium PDA yang mengandung tanin 4 mM/L. Lingkaran
warna coklat yang terbentuk menunjukkan adanya ekskresi fenoloksidase kapang
(Tao et al., 2009).
3.3.5.2. Peroksidase
Metode penambahan warna medium untuk pengujian enzim peroksidase.
methylene blue sebanyak 0,1 gr/L ditambahkan kedalam medium PDA dan
kapang ditumbuhkan diatasnya. Pudarnya warna medium memperlihatkan
kehadiran enzim peroksidase (Tao et al., 2009).
28
3.3.5.3. Mangan Peroksidase
Sebanyak 1 gr/L Manganese cloride ditambahkan dalam medium PDA
dan kapang diinokulasikan lalu diinkubasi selama 2 minggu. Selama masa
inkubasi dilakukan pengamatan terhadap titik-titik hitam-coklat yang terbentuk.
MnP mengkatalis terjadinya oksidasi MnCl
2
menjadi MnO
2
yang dihasilkan
warna hitam-coklat (Tao et al., 2009).
3.3.6. Pengukuran pH medium
Medium diukur nilai pHnya dengan menggunakan pH meter. Selanjutnya
dibuat grafik perubahannya.
3.3.7. Pengujian Biosolubilisasi Batubara
Kultur inokulum spora sebanyak 10 % v/v diinokulasikan ke dalam
erlenmeyer yang sudah berisi 100 ml MMSS. Kemudian, ditambahkan sebanyak
2% serbuk batubara (2 gr) dengan masing-masing yang tidak diiradiasi (0 kGy)
dan diiradiasi (5 kGy). Kultur kapang diinkubasi pada suhu ruang. Kultur ini
dinamakan kultur diam tanpa adanya mengocokan selama pertumbuhan kapang
(Gadjar et al., 2006). Pencuplikan sampel kultur kapang dilakukan pada hari ke 0,
7, 14, 21, 28 dan 35 untuk pengukuran biosolubilisasi terhadap batubara (Scott
and Lewis, 1990).
29
Tabel 3. Data perlakuan kultur kapang
Kapang Dosis Iradiasi
Serbuk Batubara
Medium
MMS+ 1 %
Sukrosa
% Inokulum
spora kapang
tanpa batubara 100 ml 10 % v/v
tidak diiradiasi
(0 kGy)
100 ml 10 % v/v
Penicillium sp.
diiradiasi
(5 kGy)
100 ml 10 % v/v
tanpa batubara 100 ml 10 % v/v
tidak diiradiasi
(0 kGy)
100 ml 10 % v/v
Trichoderma sp.
diiradiasi
(5 kGy)
100 ml 10 % v/v
3.3.7.1. Pengukuran Biosolubilisasi Batubara
Sampel pada kultur diam diambil sebanyak 10 ml menggunakan
mikropipet, kemudian dimasukkan ke dalam yellow tube steril. Sampel
disentrifugasi dengan kecepatan 5400 rpm selama 15 menit. Supernatan hasil
sentrifugasi diambil menggunakan pipet tetes kemudian dimasukkan dalam yellow
tube steril, kemudian diukur nilai absorbansinya menggunakan Spektrofotometer
UV-Vis pada panjang gelombang 250 nm dan 450 nm untuk mengetahui tingkat
solubilisasi batubara (Selvi, 2007). Nilai absorbansi yang tinggi berbanding lurus
dengan tingkat solubilisasi batubara yang tinggi pula.
30
3.3.8. Pengukuran Hidrolisis FDA
Supernatan dimasukkan 1 ml ke dalam tabung reaksi, kemudian
ditambahkan 4 ml KH
2
PO
4
buffer (pH 7,6) 60 mM. Reaksi dimulai dengan
menambahkan 40 g FDA (Fluorescien diacetate) dalam 4 ml aseton, kemudian
diinkubasi dalam pengocokan selama 20 menit. Setelah penginkubasian segera
ditambahkan aseton sebanyak 4 ml untuk menghentikan reaksi. Suspensi disaring
dengan kertas Whatman No. 1, filtrat dimasukkan ke dalam tabung reaksi, ditutup
dengan kertas parafilm dan disimpan dalam es batu untuk menguapkan aseton.
Nilai OD ditera dengan menggunakan spektrofotometer pada panjang gelombang
490 nm (Breeuwer, 1996).
3.3.9. Pengukuran Kadar Protein Eketraseluler dengan Metode Lowry
Sebanyak 0,5 ml sampel ditambahkan 2,5 ml larutan Lowry I dan
diinkubasi pada suhu ruang selama 10 menit. Kemudian ditambahkan 0,25 ml
larutan Lowry II, divortek dan diinkubasi pada suhu ruang selam 30 menit.
Setelah itu absorbansi dibaca dengan Spektrofotometer UV-Vis pada panjang
gelombang 750 nm dan dibandingkan dengan standar Bovine Serum Albumin
(BSA) (Apriyanto et al., 1989). Pengukuran kadar protein ekstraseluler bertujuan
untuk mengetahui seberapa besar enzim ekstraseluler diekresikan oleh kapang.
31
3.3.10. Analisis Hasil Biosolubilisasi Batubara oleh Kapang Penicilium sp.
dan Trichoderma sp. Dengan Menggunakan GC-MS
Supernatan dan pelarut dicampurkan dengan perbandingan 1:1. Pelarut
yang digunakan adalah benzena : heksana : dietil eter dengan perbandingan 3:1:1.
Campuran tersebut dimasukkan ke dalam corong Buchner lalu diaduk sampai
bercampur kemudian didiamkan beberapa saat sampai terbentuk fase atas dan
bawah. Fase atas dipakai untuk identifikasi jenis senyawa produk hasil
biosolubilisasi batubara dan menentukan kadarnya dengan menggunakan GC-MS
Shimadzu. Kolom yang digunakan adalah Dimethyl polysiloxana dengan kondisi
suhu kolom oven 50
0
C, suhu injeksi 280
0
C, laju alir 1,54 ml/menit, dan fase
gerak gas helium. Kontrol yang digunakan adalah medium MMSS yang
ditambahkan serbuk batubara yang diiradiasi dan tidak diiradiasi (Silva et al.,
2007).
3.3.11. Karakteristik Enzim Ekstraseluler dengan Elektroforesis
Karakterisasi enzim ekstraseluler dilakukan melalui elektroforesis dengan
menggunakan SDS-PAGE. Adapun tahapan kerja yang dilakukan antara lain:
1. Preparasi sampel
Sebanyak 30 l supernatan ditambahkan 50 l buffer sampel lalu
dipanaskan pada suhu 95 C selama 10 menit. Kemudian sampel disentrifus
dengan 6000 rpm selama 10 menit.
32
2. Preparasi gel elektroforesis
a. Separating gel (10%)
Sebanyak 6 ml Acrylamid 30 % dicampurkan dengan separating
gel buffer (1,5 Tris-HCl, pH 8,8) sebanyak 4,5 ml kemudian akuabides
7,5 ml, SDS 50 l, amonium persulfate (APS) 0,08 ml dan TEMED
0,01 ml.
b. Stacking gel (45%)
Sebanyak 0,9 ml Acrylamid 30 % dicampurkan dengan separating
gel buffer (1,5 Tris-HCl, pH 8,8) sebanyak 1,5 ml kemudian akuabides
3,6 ml, SDS 25 l, amonium persulfate (APS) 0,02 ml dan TEMED
0,01 ml.
3. Proses Elektroforesis
Setelah separating gel dibuat, kemudian dimasukkan sedikit demi
sedikit ke dalam alat elektroforesis dengan mikropipet, lalu ditambahkan
akuades untuk meratakan separating gel tersebut. Setelah separating gel
membeku, akuades dibuang dan dimasukkan stacking gel sedikit demi sedikit,
lalu dipasang sisir pembentuk kolom dan dibiarkan hingga stacking gel
membeku kemudian sisir diangkat.
Sebanyak 600 ml larutan running buffer dimasukkan dalam tangki
elektroforesis. Kemudian sampel sebanyak 10 l dimasukkan ke dalam kolom
gel yang sudah terbentuk lalu dielekroforesis dengan kecepatan 200 Volt dan
kuat arus 40 mA selama lebih kurang 1 sampai 2 jam atau hingga warna biru
sebagai penanda pada sampel mencapai batas bawah gel.
33
Gel diangkat lalu diwarnai dengan staining solution coomassie blue R-
250 kurang lebih selama 24 jam.Gel dicuci dengan larutan destaining yang
terdiri atas methanol 40 %, asam asetat 7,5 % dan akuades kurang lebih
selama 24 jam. Protein yang telah didestaining kemudian discan dan dianalisa
dengan Lab.Image untuk menentukan nilai RF (Retensi Faktor) sebagai
representasi dari profil protein yang dihasilkan dan berat molekulnya.
3.4. Analisa Data
Data penelitian ini dianalisis dengan menggunakan Rancangan Acak
lengkap (RAL) yang dianalisis dengan Analisis Varian (ANOVA) satu arah untuk
mengetahui apakah ada perbedaan atau pengaruh yang signifikan pada tiap
perlakuan. Uji Anaisis Varian ini (ANOVA) dibantu dengan bantuan program
SPSS 16.
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Analisis Kualitatif Enzim Ekstraseluler Kapang
Pengujian enzim ekstraseluler kapang sangatlah penting dilakukan sebelum
proses biosolubilisasi batubara. Pengujian ini bertujuan mengetahui ada atau
tidaknya enzim ekstraseluler kapang yang berperan dalam proses biosolubilisasi
batubara. Uji enzim ini menggunakan substrat atau pereaksi (tanin, methylene blue
dan manganese chloride) yang berbeda untuk setiap enzim.
A.1 A.2 A.3
Fenoloksidase (+) Peroksidase (+) Mangan Peroksidase (+)
B.1 B.2 B.3
Fenoloksidase (+) Peroksidase (+) Mangan Peroksidase (+)
Gambar 4. Uji kualitatif adanya enzim ekstraseluler kapang Penicillium sp. (A)
dan Trichoderma sp. (B)
34
35
Hasil pengujian kualitatif enzim ekstraseluler kapang Penicillium sp. dan
Trichoderma sp. menunjukkan hasil yang positif untuk terdapatnya enzim
fenoloksidase, peroksidase, dan mangan peroksidase (MnP) (Gambar 4). Enzim-
enzim ekstraseluler yang terlibat dalam proses biosolubilisasi batubara adalah
peroksidase, esterase, fenoloksidase atau lakase, MnP dan lignin peroksidase.
Enzim-enzim ini berperan untuk memecah senyawa kompleks menjadi senyawa
yang lebih sederhana, kemudian digunakan sebagai sumber energi untuk
pertumbuhan kapang (Laborda et al., 1999; Fakuosa dan Hofrichter, 1999).
Tao et al. (2009) mengindikasikan perubahan medium untuk mengamati
terjadinya lingkaran coklat oleh fenoloksidase yang dihasilkan oleh kapang
(Gambar 4 A.1 dan B.1). Pada (Gambar 4 A.2 dan B.2) positif terdapatnya enzim
peroksidase karena pudarnya warna medium pada bagian medium yang ditumbuhi
oleh kapang. (Gambar 4 A.3 dan B.3) adanya titik-titik coklat yang terbentuk
sehingga positif terdapatnya enzim MnP. Hal itu terjadi karena MnP mengkatalis
terjadinya oksidasi MnCl
2
menjadi MnO
2
hingga dihasilkan warna coklat.
4.2. Hasil Pengukuran pH Medium Kapang
Pola perubahan pH medium, baik kapang Penicillium sp. dan Trichoderma
sp. cenderung sama (Gambar 5). Nilai pH medium setelah 7 hari inkubasi
mengalami penurunan dan setelah itu mengalami kenaikan sampai hari ke-35
inkubasi. Penurunan pH medium yang mengandung batubara yang tidak diiradiasi
(0 kGy) dan diiradiasi (5 kGy) yang terjadi pada hari ke-7 inkubasi tidak terlalu
besar. Penurunan pH medium disebabkan terbentuknya asam-asam organik hasil
36
biosolubilisasi batubara seperti asam karboksil dan asam fulvat yang merupakan
senyawa humat yang terdapat dalam batubara (Cerniglia,1992).
Menurut penelitian Mustikasari (2009), nilai pH cenderung mengalami
kenaikan seiring dengan bertambahnya masa inkubasi. Kondisi peningkatan pH
medium dapat disebabkan oleh dua kemungkinan. Kemungkinan pertama karena
hasil degradasi lignin menghasilkan berbagai macam senyawa fenolik yang
memiliki gugus OH. Keberadaan gugus tersebut dapat meningkatkan nilai pH
pada masa akhir inkubasi dan kemungkinan kedua adalah terjadinya peningkatan
jumlah sel yang lisis. Menurut Judoamidjojo et al. (1992) sel yang lisis tersebut
terdeaminasi dan menyebabkan peningkatan pH.
Nilai pH medium kapang Penicillium sp. dan Trichoderma sp. selama proses
inkubasi berkisar antara 2,69 - 4,9 pada kontrol (tanpa batubara), pada medium
yang mengandung batubara yang tidak diradiasi (0 kGy) dan yang diradiasi (5
kGy). Nilai pH medium kapang Penicillium sp. berkisar antara 2,71- 4,62
(Gambar 5 A), sedangkan pada medium kapang Trichoderma sp. adalah 2,69- 4,9
(Gambar 5 B). Enzim-enzim ekstraseluler pendegradasi lignin bekerja pada pH
yang optimum. Kondisi pH medium mendukung kerja enzim fenoloksidase atau
lakase yang bekerja optimum pada pH 3,5-7. Lignin peroksidase bekerja optimum
pada pH 2,5-3,0 dan mangan peroksidase bekerja optimum pada pH 4,0-4,5
(Akhtar, 1997). pH medium kultur kapang Penicillium sp. dan Trichoderma sp.
masih pada kisaran pH yang optimum untuk bekerjanya enzim fenoloksidase atau
lakase, lignin peroksidase dan mangan peroksidase.
37
A.
0
0.5
1
1.5
2
2.5
3
3.5
4
4.5
0 7 14 21 28 35
waktu (har i)
p
H
m
e
d
i
u
m
kontrol
0 kGy
5 kGy
B.
0
1
2
3
4
5
6
0 7 14 21 28
waktu (har i)
p
H
m
e
d
i
u
m
35
kontrol
0 kGy
5 kGy
Gambar 5. Nilai pH medium kapang Penicillium sp. (A) dan Trichoderma sp. (B).
( kontrol = tanpa batubara; 0 kGy = batubara tidak diiradiasi dan 5 kGy
= batubara diiradiasi 5 kGy)
Hasil pengujian statistik menunjukkan nilai pH medium kapang Penicillium
sp. menunjukkan perbedaan yang signifikan (probabilitas 0,05) (Lampiran 12).
Selama proses inkubasi, medium yang mengandung batubara yang diiradiasi (5
kGy) nilai pH cenderung lebih tinggi daripada medium yang mengandung
batubara yang tidak diiradiasi (0 kGy). Nilai pH medium yang mengandung
batubara lebih asam daripada medium yang tidak mengandung batubara (kontrol).
Diduga iradiasi menyebabkan terlepasnya senyawa-senyawa fenolik yang
memiliki gugus OH sehingga pH medium cenderung meningkat. Berbeda dari
38
kapang Penicillium sp., hasil pengujian statistik pada penggunaan kapang
Trichoderma sp. tiap perlakuan menunjukkan tidak adanya perbedaan yang
signifikan pada seluruh perlakuan (probabilitas 0,05) (Lampiran 12)
Perubahan pH merupakan hal yang menjadi salah satu faktor pengukuran
dalam proses biosolubilisasi batubara. Nilai pH medium kapang Penicillium sp.
dan Trichoderma sp. cenderung asam, yaitu 2,69- 4,9 dan memiliki pola yang
sama setelah 35 hari inkubasi. Kisaran pH tersebut memungkinkan untuk
pertumbuhan kapang Penicillium sp. dan Trichoderma sp. karena kapang tersebut
dapat tumbuh pada kisaran pH yang luas yaitu pH 2 - 8,5 dan pertumbuhan
kapang akan lebih baik pada kondisi asam atau pH rendah (Fardiaz, 1989).
Dengan pertumbuhan kapang yang lebih baik itu dapat mempengaruhi kadar dan
aktivitas enzim yang dihasilkan oleh kapang selama proses biosolubilisasi
batubara. Nilai pH medium sangat mempengaruhi hasil biosolubilisasi batubara
oleh kapang Penicillium sp. dan Trichoderma sp. sehingga hasilnya dapat dilihat
pada biosolubilisasi batubara pada panjang gelombang 250 nm dan 450 nm.
4.3. Hasil Biosolubilisasi Batubara
Pengukuran nilai absorbansi supernatan pada panjang gelombang 250 nm
bertujuan untuk mendeteksi adanya gugus fenolik produk hasil biosolubilisasi
batubara oleh kapang Penicillium sp. dan Trichoderma sp. Gugus fenolik
terbentuk oleh proses solubilisasi senyawa lignin yang merupakan komponen
penyusun batubara. Penguraian senyawa lignin ini dibantu oleh enzim lignin
peroksidase yang mampu mengoksidasi unit non fenolik lignin (Hammel, 1996).
39
Semakin tinggi nilai absorbansi maka semakin baik pula hasil biosolubilisasi
batubara (Selvi dan Banerjee, 2007).
A.
0
0.5
1
1.5
2
2.5
3
0 7 14 21 28 35
wakt u (har i)
A
b
s
o
r
b
a
n
s
i
0 kGy
5 kGy
B.
0
1
2
3
0 7 14 21 28
waktu (har i)
A
b
s
o
r
b
a
n
s
i
35
0 kGy
5 kGy
Gambar 6. Nilai absorbansi supernatan pada panjang gelombang 250 nm hasil
biosolubilisasi kapang Penicillium sp. (A) dan Trichoderma sp. (B)
Hasil pengukuran supernatan kultur medium kapang Penicillium sp. dan
Trichoderma sp. pada panjang gelombang 250 nm dan 450 nm memiliki pola
yang sama, baik pada batubara yang tidak diiradiasi (0 kGy) maupun batubara
yang diiradiasi (5 kGy) (Gambar 6 dan 7). Hasil pengujian statistik juga
menunjukkan tidak adanya perbedaan yang signifikan pada seluruh perlakuan
(probabilitas 0,05) (Lampiran 12). Pada (Gambar 6) terlihat bahwa nilai
absorbansi supernatan pada medium yang mengandung batubara yang tidak
40
diiradiasi (0 kGy) dan batubara yang diiradiasi (5 kGy) mengalami peningkatan
pada hari ke-7 inkubasi dan setelah itu mengalami penurunan pada panjang
gelombang 250 nm. Pada medium kapang Penicillium sp. yang mengandung
batubara yang diiradiasi (5 kGy) tidak mempengaruhi biosolubilisasi batubara.
Tanpa radiasi gamma, nilai absorbansi kapang Penicillium sp. memililki nilai
absorbansi yang tinggi.
Nilai absorbansi supernatan meningkat dan menurun seiring dengan
bertambahnya masa inkubasi. Nilai absorbansi yang meningkat pada hari ke-7
inkubasi disebabkan karena proses biosolubilisasi batubara padat diurai menjadi
batubara terlarut dan selain itu dihasilkan pula gas CO
2
. Nilai absorbansi yang
menurun pada hari ke-14 dan sampai akhir inkubasi disebabkan karena proses
degradasi atau biosolubilisasi batubara yang sudah melarut kemudian diurai
kembali menjadi komponen-komponen yang lebih sederhana dan dihasilkan pula
gas CO
2
(Ward, 1990). Unit fenolik hasil degradasi lignin dioksidasi oleh enzim
lakase yang berperan dalam oksidasi unit fenolik (Perez et al.,2002).
Tiap kapang memiliki waktu yang berbeda dalam hal memiliki nilai
absorbansi tertinggi pada panjang gelombang 250 nm. Kapang Penicillium sp.
nilai absorbansi tertinggi terjadi pada inkubasi hari ke-7 dalam medium yang
mengandung batubara yang tidak diiradiasi (0 kGy) dan diirasiasi (5 kGy).
Kapang Trichoderma sp. nilai absorbansi tertinggi pada inkubasi hari ke-35 dalam
medium yang mengandung batubara yang tidak diiradiasi (0 kGy) dan diirasiasi (5
kGy).
41
Tingkat biosolubilisasi juga diamati melalui nilai absorbansi pada panjang
gelombang 450 nm. Pengukuran nilai absorbansi pada panjang gelombang
tersebut bertujuan untuk mendeteksi produk hasil biosolubilisasi berupa gugus
karboksil dan hidroksil oleh kapang Penicillium sp. dan Trichoderma sp. karena
karakter lain dari produk biosolubilisasi kaya akan gugus karbonil (C=O) dan
hidroksil (O-H) (Scott dan Lewis, 1990).
A.
0
0.01
0.02
0.03
0.04
0.05
0.06
0.07
0 7 14 21 28 35
wakt u (har i)
A
b
s
o
r
b
a
n
s
i
0 kGy
5 kGy
0
0.05
0.1
0.15
0.2
0.25
0 7 14 21 28 35
waktu (har i)
A
b
s
o
r
b
a
n
s
i
0 kGy
5 kGy
B.
Gambar 7. Nilai absorbansi supernatan pada panjang gelombang 450 nm hasil
biosolubilisasi kapang Penicillium sp. (A) dan Trichoderma sp. (B)
(0 kGy = batubara tidak diiradiasi dan 5 kGy = batubara diiradiasi 5
kGy).
42
Pada (Gambar 7A) terlihat bahwa nilai absorbansi pada masa inkubasi hari ke-
7 dan 28 pada medium yang mengandung batubara yang tidak diiradiasi (0 kGy)
mengalami penurunan. Nilai absorbansi terus meningkat pada masa inkubasi hari
ke-14 dan 21, kemudian nilai absorbansi meningkat lagi pada hari ke-35.
Peningkatan nilai absorbansi tertinggi pada masa inkubasi hari ke-35 yaitu,
sebesar 0,063 pada medium yang mengandung batubara yang tidak diiradiasi (0
kGy). Nilai absorbansi pada medium yang mengandung batubara yang diiradiasi
(5 kGy) pada masa inkubasi dari hari ke-0, 7 dan 14 terus mengalami peningkatan,
kemudian nilai absorbansi menurun lagi pada hari ke-28 dan 35. Peningkatan nilai
absorbansi tertinggi pada masa inkubasi hari ke-35 yaitu, sebesar 0,053 pada dosis
batubara yang diiradiasi (5 kGy). Iradiasi gamma 5 kGy pada batubara tidak
mempengaruhi biosolubilisasi. Hasil pengujian statistik kapang Penicillium sp
menunjukkan tidak adanya perbedaan yang signifikan pada seluruh perlakuan
(probabilitas 0,05) (Lampiran 12).
(Gambar 7 B) terlihat bahwa nilai absorbansi pada medium yang mengandung
batubara yang tidak diiradiasi (0 kGy) dari ke-0, 7, 14, 21 dan 35 terus mengalami
peningkatan, kemudian nilai absorbansi menurun pada hari ke-28 inkubasi.
Peningkatan absorbansi tertinggi pada masa inkubasi hari ke-35 yaitu, 0,220. Nilai
absorbansi pada dosis batubara yang diiradiasi (5 kGy) menurun pada hari ke-7
dan 28. Kemudian meningkat pada hari ke-14 dan ke-21. Nilai absorbansi
meningkat lagi pada hari ke-35 yaitu, sebesar 0,178. Peningkatan nilai absorbansi
tertinggi pada masa inkubasi ke-35. Hasil pengujian statistik kapang Trichoderma
43
sp. menunjukkan tidak adanya perbedaan yang signifikan pada seluruh perlakuan
(probabilitas 0,05) (Lampiran 12)
Jika dibandingkan dengan nilai pH medium (Gambar 5) maka dapat dilihat
adanya hubungan yang berbanding terbalik antara pH medium dengan absorbansi
supernatan. Ketika nilai pH medium meningkat maka nilai absorbansi supernatan
mengalami penurunan sedangkan jika nilai pH menurun maka nilai absorbansi
supernatan menigkat. Hal ini sesuai dengan hasil penelitian yang dilakukan oleh
Selvi dan Banerje (2007), yang menghasilkan biosolubilisasi yang tertinggi pada
pH yang rendah.
Kapang Trichoderma sp. memiliki nilai absorbansi lebih tinggi daripada
kapang Penicillium sp. pada medium yang mengandung batubara yang tidak
diiradiasi (0 kGy) selama proses inkubasi. Hal ini sesuai dengan penelitian Sugoro
et al. (2009) kapang Trichoderma sp. memiliki nilai absorbansi tertinggi atau
memiliki kemampuan tertinggi dalam mendegradasi batubara subbituminus
Sumatera Selatan dibandingkan isolat kapang Penicillium sp., Mucor sp.,
Aspergillus sp. dan isolat lainnya (belum teridentifikasi). Menurut Ward (1990)
perbedaan absorbansi menunjukkan adanya perbedaan pada tingkat biosolubilisasi
batubara oleh kapang melalui aktivitas enzim ekstraseluler menjadi produk yang
dapat larut dan mencair, sehingga dalam penelitian ini perlu dilakukan analisis
hidrolisis FDA.
44
4.4. Hasil Hidrolisis FDA
Nilai absorbansi diukur bertujuan untuk melihat aktivitas dari enzim
intraseluler dan enzim ektraseluler dalam kegiatannya menghidrolisis FDA
(Fluorescien diacetate). FDA dalam pengujian ini merupakan substrat sebagai
pengganti batubara. Jumlah FDA yang terhidrolisis menunjukkan jumlah enzim
intraseluler dan ekstraseluler. Selain ketiga enzim seperti lakase, lignin
peroksidase dan mangan peroksidase ternyata masih ada enzim ektraseluler lain
seperti lipase, protease dan terutama esterase. Aktivitas dari enzim akan
menghasilkan senyawa yang berpendar berwarna kuning (Lampiran 16.5
)(Breeuwer, 1996).
Hasil pengujian statistik kapang Penicillium sp. menunjukkan tidak adanya
perbedaan yang signifikan pada seluruh perlakuan (probabilitas 0,05) (Lampiran
12).(Gambar 8 A) terlihat bahwa nilai absorbansi pada kontrol (tanpa batubara),
batubara yang tidak diiradiasi (0 kGy) dan batubara yang diiradiasi (5 kGy)
mengalami peningkatan pada inkubasi hari ke-7. Pada kontrol (tanpa batubara),
nilai absorbansi menurun pada hari ke-14, dan terus meningkat pada hari ke-21,
28 dan 35, sedangkan pada batubara yang tidak diiradiasi (0 kGy) dan batubara
yang diiradiasi (5 kGy) terus meningkat pada hari ke-14 dan nilai absorbansi
menurun pada hari ke-21, 28, dan 35. Nilai absorbansi tertinggi pada batubara
yang tidak diiradiasi (0 kGy) dan batubara yang diiradiasi (5 kGy) yaitu, pada hari
ke-14 yaitu sebesar 0, 85, sedangkan pada kontrol (tanpa batubara) nilai aborbansi
tertinggi pada masa inkubasi hari ke-35. Meningkat dan menurunnya hidrolisis
45
FDA karena dipengaruh oleh pH medium, disaat hidrolisis FDA terus meningkat
maka nilai pH medium juga meningkat (Gambar 5).
A.
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
0 7 14 21 28 35
waktu (hari )
A
b
s
o
r
b
a
n
s
i
Kontrol
0 KGy
5 KGy
B.
0
0.1
0.2
0.3
0.4
0.5
0.6
0 7 14 21 28
waktu (hari )
A
b
s
o
r
b
a
n
s
i
35
Kontrol
0 KGy
5 KGy
Gambar 8. Nilai absorbansi pada panjang gelombang 490 nm hasil hidrolisis
FDA kapang Penicillium sp. (A) dan Trichoderma sp. (B). ( kontrol
= tanpa batubara; 0 kGy = batubara tidak diiradiasi dan 5 kGy =
batubara diiradiasi 5 kGy).
(Gambar 8 B) terlihat bahwa nilai absorbansi batubara yang tidak diiradiasi (0
kGy) dan batubara yang diiradiasi (5 kGy) mengalami peningkatan pada hari ke-7
sampai hari ke-14, 21 dan 28. Nilai absorbansi hidrolisis FDA menurun pada hari-
35. Pada kontrol nilai absorbansi menurun pada hari ke-7 dan meningkat pada hari
ke-35. Nilai absorbansi tertinggi pada batubara yang tidak diiradiasi (0 kGy) dan
46
batubara yang diiradiasi (5 kGy) yaitu pada masa inkubasi hari ke-28, sedangkan
pada kontrol (tanpa batubara) nilai absorbansi tertinggi pada hari ke-21. Hasil
pengujian statistik kapang Trichoderma sp. menunjukkan perbedaan yang
signifikan (probabilitas 0,05) (Lampiran 12)
Peningkatan nilai absorbansi hidrolisis FDA tiap masa inkubasi karena jumlah
kapang yang terus meningkat sehingga aktivitas enzim juga tinggi, dan menurut
penelitian Indahwati (2009), hasil degradasi batubara yang kompleks menjadi
senyawa yang terlarut dalam medium menyebabkan peningkatan kekeruhan
medium sehingga nilai absorbansi juga meningkat. Menurut Fengel dan Weneger
(1995), enzim-enzim pendegradasi lignin harus bekerja secara aktif untuk
mendegradasi zat-zat makromolekul batubara, untuk itu perlu dilakukan analisis
kadar protein ekstraseluler kapang. Kadar protein ekstraseluler berhubungan
dengan enzim-enzim yang dihasilkan oleh kapang, sehingga bisa dihubungkan
dengan biosolubilisasi.
4.5. Hasil Kadar Protein Ekstraseluler Kapang
Pengukuran kadar protein ekstraseluler kapang Penicillium sp. dan
Trichoderma sp. bertujuan untuk mengetahui seberapa besar enzim ekstraseluler
diekresikan oleh kapang. Hasil uji menunjukkan bahwa kadar protein ektraseluler
yang tinggi menyebabkan warna supernatan akan lebih gelap setelah proses uji
(Lampiran 16.4), karena menurut Faison et al. (1989), biosolubilisasi batubara
oleh kapang melalui proses ektraseluler akan menghasilkan medium yang lebih
gelap selama proses kultur.
47
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0 7 14 21 28 35
wakt u (hari)
m
g
/
m
l
kontrol
0 kGy
5 kGy
A.
0
0,2
0,4
0,6
0,8
1
0 7 14 21
wakt u (hari)
m
g
/
m
l
28 35
kontrol
0 kGy
5 kGy
B.
Gambar 9. Nilai kadar protein ekstraseluler kapang Penicillium sp.(A) dan
Trichoderma sp. (B) (kontrol = tanpa batubara; 0 kGy = batubara
tidak diiradiasi dan 5 kGy = batubara diiradiasi 5 kGy).
(Gambar 9 A), pada kapang Penicillium sp. terlihat bahwa kadar protein
ekstraseluler pada kontrol (tanpa batubara) dan medium yang mengandung
batubara yang tidak diiradiasi (0 kGy) menurun pada hari ke-7 inkubasi dan
meningkat pada hari ke-14 inkubasi. Pada kontrol (tanpa batubara) kadar protein
ekstraseluler tertinggi yaitu pada hari ke-35 inkubasi, sedangkan pada medium
yang mengandung batubara yang tidak diiradiasi (0 kGy) tertinggi pada hari ke-21
inkubasi.
48
Pada medium yang mengandung batubara yang diiradiasi (5 kGy) kadar
protein ekstraseluler menurun pada hari ke-28 inkubasi dan kadar protein
ekstraseluler tertinggi pada hari ke-21 inkubasi yaitu, 0,57 mg/ml. Hasil pengujian
statistik kapang Penicillium sp. menunjukkan tidak adanya perbedaan yang
signifikan pada seluruh perlakuan (probabilitas 0,05) (Lampiran 12). Radiasi
gamma tidak mempengaruhi kadar proein ekstraseluler kapang. Pada hari ke-21
dan ke-28 inkubasi terjadi peningkatan kadar protein ekstraseluler karena kapang
mengekresikan enzim ekstraseluler (Gandjar et al., 2006) dan terjadi juga
degradasi batubara oleh kapang (Sugoro et al., 2009).
(Gambar 9 B), pada kapang Trichoderma sp. kadar protein ekstraseluler pada
kontrol (tanpa batubara), batubara yang tidak diiradiasi (0 kGy ) dan batubara
yang diiradiasi (5 kGy) meningkat pada hari ke-7 inkubasi. Pada kontrol (tanpa
batubara) kadar protein ekstraseluler menurun pada hari ke-28 inkubasi dan kadar
protein ekstraseluler tertinggi pada hari ke-21 inkubasi yaitu, 0,93 mg/ml. Pada
medium yang mengandung batubara yang tidak diiradiasi (0 kGy) kadar protein
ekstraseluler turun pada hari ke-21 inkubasi dan kadar protein ekstraseluler
tertinggi pada hari ke-14 inkubasi yaitu, 0,55 mg/ml. Pada batubara yang
mengandung batubara yang diiradiasi (5 kGy) kadar protein ekstraseluler menurun
pada hari ke-14 inkubasi dan Trichoderma sp. tertinggi pada hari ke-7 yaitu, 0,62
mg/ml. Hasil pengujian statistik kapang Trichoderma sp. menunjukkan perbedaan
yang signifikan (probabilitas 0,05) (Lampiran 12). Kadar protein tertinggi pada
media yang berisi batubara yang diiradiasi (5 kGy) masa inkubasi ke-21 yaitu,
0,58 mg/ml (Gambar 9 A). Kadar protein pada media yang mengandung batubara
49
yang tidak diiradiasi (0 kGy) pada masa inkubasi ke-21. Jika dibandingkan
dengan kontrol (tanpa batubara) kadar protein tertinggi yaitu pada masa inkubasi
hari ke-35.
4.6. Analisis Senyawa Hasil Biosolubilisasi Batubara oleh Kapang Penicillium
sp. dan Trichoderma sp. Menggunakan GC-MS.
Hasil analisis biosolubilisasi menggunakan GC-MS pada pada kontrol
(MMSS+ batubara tanpa kapang) dan perlakuan pada batubara yang tidak
diiradiasi (0 kGy) dan diiradiasi (5 kGy) oleh kapang Penicillium sp. dan
Trichoderma sp. dinyatakan dalam persen area. Hasil analisis biosolubilisasi
tersebut menunjukkan hasil biosolubilisasi batubara yang tidak diiradiasi (0 kGy)
dan diiradiasi (5 kGy) oleh kapang Penicillium sp. dan Trichoderma sp.
menghasilkan senyawa-senyawa hidrokarbon yang terkandung dalam minyak
bumi. Senyawa hidrokarbon adalah senyawa-senyawa organik yang setiap
molekulnya hanya mempunyai unsur karbon dan hidrogen saja (Hardjono, 2001).
Sampel yang digunakan dalam analisis GC-MS adalah berdasarkan nilai
biosolubilisasi yang tinggi yaitu, kapang Penicillium sp. yang mendegradasi
batubara yang tidak diiradiasi (0 kGy dan) dan diiradiasi (5 kGy) pada hari ke-7
inkubasi, sedangkan kapang Trichoderma sp. pada hari ke-14 inkubasi.
Puncak-puncak yang muncul pada kromatogram dari kontrol (MMSS+
batubara tanpa kapang) dibandingkan dengan perlakuan. Ada senyawa-senyawa
yang mengalami peningkatan, pengurangan persen area dan pembentukan
senyawa baru karena proses degradasi batubara (Sugoro et al., 2009). Senyawa
50
hidrokarbon yang terbentuk selama proses biosolubilisasi adalah delapan sampai
dua puluh satu atom karbon (C
8
-C
21
). Menurut penelitian Indahwati (2009),
senyawa hidrokarbon yang terbentuk selama proses biosolubilisasi batubara
adalah tujuh sampai lima puluh empat atom karbon (C
7
-C
54
).
Hasil analisis GC-MS pada kontrol (MMSS+ batubata yang tidak diradiasi (0
kGy) terdeteksi 8 senyawa, sedangkan batubara yang diiradiasi (5 kGy) terdeteksi
12 senyawa. Kapang Penicillium sp. yang mengandung batubara yang tidak
diiradiasi (0 kGy) pada hari ke-7 inkubasi terdapat 4 puncak senyawa
hidrokarbon, sedangkan batubara yang diiradiasi (5 kGy) terdeteksi hanya 2
senyawa. Kapang Trichoderma sp. yang mendegradasi batubara yang tidak
diiradiasi (0 kGy) pada hari ke-14 inkubasi terdeteksi 2 senyawa hidrokarbon,
sedangkan batubara yang diiradiasi (5 kGy) terdeteksi 4 senyawa hidrokarbon
(Tabel 4).
Hasil analisis GC-MS kapang Penicillium sp. yang mendegradasi batubara
yang tidak diiradiasi (0 kGy) pada hari ke-7 inkubasi memiliki 9-21 atom karbon
(C
9
-C
21
). Terjadi pengurangan persen area pada senyawa 2,4-dimetilheptana
(C
9
H
20
) dari 19,43 % menjadi 13,24 % dan n-tetradekana (C
14
H
30
) dari 18,03 %
menjadi 15,02 %. Senyawa baru yang terbentuk adalah 3,7-dimetildekana
(C
12
H
26
) sebanyak 14,97 % dan senyawa 2,6,10,14-tetrametilheptadekana
(C
21
H
32
) terdeteksi paling tinggi sebanyak 56,77 %. Kapang Penicillium sp. yang
mendegradasi batubara yang diiradiasi (5 kGy) pada hari ke-7 inkubasi memiliki
13-14 atom karbon (C
13
-C
14
). Senyawa baru yang terbentuk berbeda dengan
batubara yang tidak diiradiasi yaitu 3,7-dimetilundekana (C
13
H
28
), senyawa
51
tersebut terdeteksi paling banyak, yaitu 65,61 %. Selain itu, terjadi penambahan
persen area pada senyawa n-tetradekana (C
14
H
30
) dari 18,03 % menjadi 34,39 %
(Tabel 4).
Tabel 4. Senyawa hasil biosolubilisasi batubara menggunakan GC-MS
%area/5 l
Perlakuan
Kontrol Penicillium sp. Trichoderma sp.
No Nama Senyawa
0 kGy
H-0
5 kGy
H-0
0 kGy
H-7
5 kGy
H-7
0 kGy
H-14
5 kGy
H-14
1 n-oktana (C8H18) 11,07 6,26 - - - -
2 3,3-dimetilheksana (C8H18) - 23,37 - - - -
3 2,3,3-trimetilpentana (C8H18) - 3,33 - - - -
4 2,4-dimetil-1-heptena (C9H18) - 4,99 - - - -
5 2,4-dimetilheptana (C9H20) 19,43 17,73 13,24 - 67,19 24,41
6 4-metiloktana (C9H20) 4,50 4,93 - - - -
7 2,3,4-trimetilheksana (C9H20) - 9,53 - - - -
8 n-nonena (C9H20) - 2,12 - - - -
9 1-iododekana (C10H21) - 4,52 - - - -
10 6-etil-2-metiloktana (C11H24) - 5,23 - - - -
11 dodekana,1,1-difloro (C12H24) 5,49 - - - - -
12 dodekana (C12H26) 29,22 - - - - -
13 2,4-dimetildekana (C12H26) 6,73 - - - - -
14 3,7-dimetildekana (C12H26) - - 14,97 - - -
15 4,7-dimetilundekana (C13H28) - 16,07 - - - -
16 3,7-dimetilundekana (C13H28) - - 16,61 32,81 22,96
17 n-tetradekana (C14H30) 18,03 - 15,02 34,39 - 20,59
18 n-pentadekana (C15H32) 5,53 1,92 - - -
19 n- heksadekana (C16H34) - - - - - 32,04
20
2,6,10,14-
tetrametilheptadekana (C21H32) - - 56,77 - - -
Total % area 100 100 100 100 100 100
Total senyawa 8 12 4 2 2 4
Keterangan:
Kontrol : MMSS + serbuk batubara tanpa kapang
Perlakuan : MMSS + serbuk batubara + kapang
Hasil analisis senyawa hidrokarbon pada kapang Trichoderma sp. yang
mendegradasi batubara yang tidak diiradiasi (0 kGy) hari ke-14 inkubasi memiliki
9-13 atom karbon (C
9
-C
13
). Senyawa baru yang terbentuk adalah 3,7-
dimetilundekana (C
13
H
28
) sebanyak 32,81 % dan terjadi juga penambahan persen
52
area senyawa 2,4-dimetilheptana (C
9
H
20
) dari 19,43 % menjadi 67,19 %. Kapang
Trichoderma sp. yang mendegradasi batubara yang diiradiasi (5 kGy) hari ke-14
inkubasi memiliki atom karbon dari 9-16 (C
9
-C
16
). Senyawa baru yang terbentuk
adalah 3,7-dimetilundekana (C
13
H
28
) dan n-heksadekana (C
16
H
34
) terdeteksi
paling tinggi sebanyak 32,04 %. Senyawa yang mengalami penambahan persen
area adalah 2,4-dimetilheptana (C
9
H
20
) dari 19,43 % menjadi 24,41 % dan
senyawa n-tetradekana (C
14
H
30
) dari 18,03 % menjadi 20,59 % (Tabel 4).
Formulasi kimia yang masuk ke dalam fraksi bensin memiliki jumlah atom
karbon sebanyak 4-12 (American Petroleum Institute, 2001), sedangkan pada hasil
penelitian Sugoro et al. (2009), degradasi batubara oleh kapang Penicillium sp.
dan Trichoderma sp. berpotensi sebagai energi alternatif pengganti bahan bakar
minyak yang setara dengan bensin karena kedua kapang tersebut mampu
mendegradasi batubara yang kompleks menjadi senyawa dengan rantai karbon
sebanyak 6-12 dengan persentase yang cukup tinggi, yaitu 33,67 % dan 33,33 %.
Pada penelitian ini senyawa dengan rantai karbon 9-12 berpotensi sebagai energi
alternatif pengganti bahan bakar minyak yang setara dengan bensin , yaitu kapang
Trichoderma sp. yang mendegradasi batubara yang tidak diiradiasi (0 kGy)
memiliki persentasi yang lebih tinggi sebanyak 67,19 %. dan batubara yang
diiradiasi (5 kGy) lebih kecil 24,41 %. Kapang Penicillium sp. yang mendegradasi
batubara yang tidak diiradiasi (0 kGy) sebanyak 28,21 %.
Proses biosolubilisasi tidak lepas dari peran enzim. Untuk mengetahui jenis
enzim, maka akan dilakukan karakterisasi enzim ekstraseluler dengan
eloktroforesis SDS-PAGE. Sampel yang akan digunakan adalah supernatan yang
53
mempunyai tingkat solubilisasi yang tinggi nilai absorbansinya pada panjang
gelombang 250 nm dan 450 nm, nilai absorbansi yang tinggi berbanding lurus
dengan tingkat solubilisasi yang tinggi pula (Selvi dan Banerjee, 2007).
Berdasarkan nilai solubilisasi yang tinggi, maka sampel yang akan dianalisis
karakterisasi protein dengan eloktroforesis SDS-PAGE adalah kapang
Penicillium sp. yang mendegradasi batubara yang tidak diiradiasi (0 kGy) dan
batubara yang diiradiasi (5 kGy) pada hari ke-7 inkubasi, sedangkan kapang
Trichoderma sp. pada hari ke-14 inkubasi.
4.7. Karakteristik Enzim Ekstraseluler Kapang Penicillium sp. dan
Trichoderma sp.
Hasil elektroforesis SDS-PAGE memperlihatkan gambaran karakteristik
enzim kapang Penicillium sp. dan Trichoderma sp. Dengan elektroforesis dapat
diketahui berat molekul (BM) enzim ekstraseluler. Karakteristik enzim kapang
Penicillium sp. dan Trichoderma sp. berbeda (Gambar 10).
Pada hari ke-7 inkubasi karakteristik enzim kapang Penicillium sp. pada
batubara yang tidak diiradiasi (0 kGy) dan batubara yang diiradiasi (5 kGy)
tampak sama. Karakteristik enzim kapang Penicillium sp. terdiri atas mangan
peroksidase (BM= 48 KDa) dan lakase (BM= 56 KDa), kedua enzim tersebut juga
terdapat pada uji kualitatif enzim ekstraseluler (Gambar 4). Iradiasi gamma pada
batubara 5 kGy yang disolubilisasi oleh kapang Penicillium sp. tidak
mempengaruhi karakteristik enzim kapang tersebut karena karakteristik enzimnya
sama dengan yang tidak diradiasi (0 kGy).
54
M 1 2 3 4
97,4 KDa
66,2 KDa
45 KDa
31,5 KDa
5 6 KDa
200 KDa
4 8 KDa
2 3 KDa
21,5 KDa
Gambar 10. Karakteristik enzim ekstraseluler kapang Penicillium sp. dan
Trichoderma sp. pada medium yang mengandung batubara yang
tidak diiradiasi (0 kGy) dan batubara yang diiradiasi (5 kGy). M
(marker), 1 (Pe,0 kGy,7 hari,) 2 (Pe,5 kGy,7 hari), 3 (Tr,0 kGy,14
hari), dan 4 ( Tr, 5 kGy, 14 hari).
Pada hari ke-14 inkubasi, karakteristik enzim kapang Trichoderma sp.
batubara yang tidak diiradiasi (0 kGy) dan batubara yang diiradiasi (5 kGy)
menunjukkan karakteristik enzim yang berbeda (Gambar 10). Pada batubara yang
tidak diradiasi (0 kGy) karakteristik enzim kapang Trichoderma sp. terdiri atas
mangan peroksidase (BM= 48 KDa), lakase (BM= 56 KDa) dan belum diketahui
karakteristiknya (23 kDa), sedangkan batubara yang diiradiasi 5 kGy karakteristik
55
enzim kapang Trichoderma sp. terdiri atas lakase (BM= 56 KDa) dan belum
diketahui karakteristiknya (23 kDa). Enzim-enzim ekstraseluler yang terlibat
dalam proses biosolubilisasi batubara adalah peroksidase, esterase, fenoloksidase
atau lakase, mangan peroksidase dan lignin peroksidase (Laborda et al., 1999;
Fakuosa dan Hofrichter, 1999).
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Iradiasi gamma pada batubara (5 kGy) tidak mempengaruhi kadar protein
ekstraseluler kapang Penicillium sp. dan Trichoderma sp.
2. Iradiasi gamma pada batubara (5 kGy) mempengaruhi karakteristik enzim
ekstraseluler kapang Trichoderma sp., tetapi pada kapang Penicillium sp.
sebaliknya. Enzim yang terdeteksi pada kapang Penicillium sp adalah
mangan peroksidase (BM=48 KDa) dan lakase (BM=56 KDa) baik pada
batubara yang tidak diiradiasi (0 kGy) dan batubara yang diiradiasi (5
kGy), sedangkan pada kapang Trichoderma sp. terdeteksi hanya lakase
(BM=56 KDa) pada batubara yang diiradiasi (5 kGy) dan mangan
peroksidase (BM=48 KDa) dan lakase (BM=56 KDa) pada batubara yang
tidak diiradiasi (0 kGy).
3. Produk solubilisasi menunjukkan kecenderungan setara bensin pada
perlakuan batubara yang diiradiasi dan tidak diiradiasi untuk Trichoderma
sp., sedangkan Penicillium sp. hanya pada batubara yang tidak diiradiasi.
5.2. Saran
Perlu dilakukan peningkatan pada dosis batubara hasil iradiasi gamma agar
ditingkatkan biosolubilisasinya dibandingkan dengan yang tidak diiradiasi.
Disamping itu perlu dilakukan optimasi kandungan batubara dan purifikasi enzim
ekstraseluler yang berperan dalam biosolubilisasi batubara.
56
57
DAFTAR PUSTAKA
Akhadi, M. 2007. Pengantar Teknologi Nuklir. PT Reneka Cipta. J akarta.
Akhtar, M., R.A. Blanchette and T.K. Kirk. 1997. Fungal Delignification and
Biomechanical Pulping of Wood. Advances in Biochemical Enginering
Biotechnology 57:138-144.
American Coal Foundation. 2007. Coals Journey. http://www.coaljourney.htm,
(akses 16 Februari 2010)
Apriyanto, A., D. Fardiaz, N.L. Puspitasari, Sedarnawati, S. Budiyanto. 1989.
Analisis Pangan. Penelaah: D. Muchtadi. Departemen Pendidikan dan
Kebudayaan Direktorat J enderal Pendidikan Tinggi Pusat Antar
Universitas Pangan dan Gizi Institut Pertanian Bogor. Bogor.
Breeuwer, P. 1996. Assesment of Viability of Microorganism Employing
Fluorescene Techniques. Wageningen.
Carlile, M.J . dan S.C. Watkinson. 1994. The Fungi. Academic Press. London.
Cerniglia. 1992. Biodegradation of Polycyclic Aromatic Hydrocarbons.
Biodegradation Journal. 3: 227-361
Champe, S.P., M.B. Kurtz, L.N. Yager, N.J . Butnick & D.E. Axelrod. 1981. Spore
formation in Aspergillus nidulans: Competence and other developmental
processes. Dalam: Turian,G. & H.R. Hohl. (eds). 1981. The Fungal Spore:
Morphogenetics Controls. Academic Press. London: 255 276.
Cohen S.M dan P.D Gabriele. 1982. Dedradation of Coal by the Fungi Poliporus
versicolor and Poria monticule. Appl. Environ. Mikrobiol. 44: 23-27.
Darussalam, M. 1996. Radiasi dan Radioisotop: Prinsip Penggunaan dalam
Biologi, Kedokteran, dan Pertanian. Tarsito. Bandung.
Faison, B.D., C.D. Scott and B.H. Davidson. 1989. Biosolubilization of Coal in
aqueous and non-aqueous media. Biotechnol. Bioeng. Symp. Ser. 743-752
Fakuosa, R.M dan M. Hofrichter. 1999. Biotechnology and Microbiology of Coal
Degradation. Appl. Microbiol. Biotechnol. 52: 25-40.
Fardiaz, S. 1992. Mikrobiologi Pangan. PT Gramedia Pustaka Umum. J akarta.
58
Fardiaz, S. 1989. Mikrobiologi Pangan. Penelaah: F.G. Winarno. Departemen
Pendidikan dan Kebudayaan Direktorat J enderal Pendidikan Tinggi Pusat
Antar Universitas Pangan dan Gizi Institut Pertanian Bogor. Bogor.
Fengel, D dan G. Weneger. 1995. Kayu: Kimia, Ultrastruktur, Reaksi-reaksi.
Gajah Mada University Press. Yogyakarta.
Gandjar, I., W. Sjamsuridzal, A. Oetari. 2006. Mikologi: Dasar dan Terapan.
Yayasan Obor Indonesia. J akarta.
Hames,B. D. 1998. Gel Electrophoresis of Protein. Oxford University Press. New
York Tokyo
Hammel, K.E. 1996. Extracelluler Free Radical Biochemistry of Ligninolytic
Fungi. New J. Chem. 20:195-198.
Hardjono, A. 2001. Teknologi Minyak Bumi. Gadjah Mada University Press.
Yogyakarta.
Hatakka, A. 2001. Biodegradation of lignin. In: Steinbuchel, A. (editor).
Biopolymers. (1): 129-180.
Hibbet, D.S., et al. 2007. A Higher-level Phylogenetic Classification of the
Fungi.. Mycological Research. 48: 261-266
Hidayat, N., M.C. Padaga dan S. Suhartini. 2006. Mikrobiologi Industri. Penerbit
Andi. Yogyakarta.
Holker, U., H. Schmiers, S. Grobe, M. Winkelhofer, M. Polsakiewicz, S. Ludwig,
J . Dohse and M. Hofer. 2002. Solubilization of Low-rank Coal by
Trichoderma atroviride Evidence for the Involvement of Hydrolytic and
Oxidative Enzymes by Using
14
C-labelled Lignite. Journal of Industrial
Microbiology and Biotechnology 28: 207-212.
Indahwati, E. 2009. Degradasi Batubara Subbituminus Asal Kalimantan Timur
Menggunakan Fungi Aspergillus sp. dan Penicillium sp. Skripsi. J urusan
MIPA Biologi. Universitas Islam Negeri Syarif Hidayatullah. J akarta.
J udoamidjojo, M., A.A. Darwis dan E.G. Said. 1992. Teknologi Fermentasi.
Rajawali Press. J akarta.
Kersten, P.J ., B. Kalyanaraman, K.E. Hammel, B. Reinhamar and T.K. Kirk.
1990. Comparation of Lignin Peroxidase, Horseradish Peroxidase and
Laccase in the Oxidation of Methoxybenzenes. Biochem. J. 268: 475-480.
59
Kuraesin, T. 2009. Isoloasi Seleksi Fungi Pelaku Solubilisasi Batubara
Subbituminous. Skripsi. J urusan MIPA Biologi. Universitas Islam Negeri
Syarif Hidayatullah. J akarta.
Mazur, L.J ., J . Kim & the Commitee on Environmental Health. 2006. Spectrum of
Noninfectious Healt Effects from Molds. Pediatrics 118: 1909 1926.
Laborda, F., I.F. Monistrol, N. Luna and M. Fernandez. 1999. Processes of
Liquefaction or Solubilization of Spanish Coal by Microorganism. Appl.
Microbiol. Biotechnol. 57: 49-56.
Lehninger, L. A. 1982. Principle of Biochemistry Worth Publisher. Inc. USA.
Lehninger, L. A.1994. Dasar-dasar Biokimia. Erlangga. J akarta.
Liu, R.Q, N.L. J ahson, G.C Magruder, M.D Ackerson, J .L Vega, E.C Clausen dan
J .L Gaddy. 1989. Serial Biological Conversion of Coal Into Liquid Fuels.
Biotechnol. Bioeng. 73: 551-564.
Mustikasari, N.S. 2009. Pengaruh J umlah Inokulum Phanerochaete
chrysosporium dan Konsentrasi Batubara Pada Pencairan (Solubilisasi
Batubara). Skripsi. J urusan Mikrobiologi. Institut Teknologi Bandung.
Bandung.
Novia, L. Cundari, S. Murti, M. Faisal. 2009. Modeling Proses Pencairan
Batubara Menggunakan Software Fluent 6,3 CDF Code. Seminar Nasional
Kimia Indonedia. Bandung.
Perez, J ., J . Munoz-Dorado, T. de la Rubia and J . Martinez. 2002. Biodegradation
and Biological Treatment of Cellulose, Hemicellulose and Lignin.
Introduction Microbiol. 5: 53-63.
Poedjiadi, A. 1994. Dasar-Dasar Biokimia. UI Press. J akarta
Scott, C.D., Faison, B.D., Woodward, C.A. 1991. Anaerobic Liquefaction/
Solubilization of Coal by Microorganism and Isolated Enzyme. Presented
at The Liquefaction Contractor Review Meeting, Dept. of Energi. USA.
Scott, C.D. and S.N. Lewis. 1990. Solubilization of coal by microbial action. In :
Wise, L. D (editor). Bioprocessing and Biotreatment of Coal. Marcel
Dekker Inc. New York.
Selvi, V.A. and Banerjee, R. 2007. Coal Biotechnology: Bio-conversion of
Different Rank Indian Coal for The Extraction of Liquid Fuel and
Fertilizer. Appl. Biochem. Biotechnology 7: 16-21.
60
Selvi, V.A., R. Benerjee, L.C. Ram, G. Singh. 2009. Biodepolymerization Studies
of Low Rank Indian Coals. World J. Microbiol. Biotechnol. 25: 1713-
1720.
Silva, M.E., C.J . Vengadajellum, H.A. J anjua, S.T.L. Harrison, S.G. Burton and
D.A. Cowan. 2007. Degradation of low rank coal by Trichoderma
atroviride ES11. Journal of Industrial Microbiology and Biotechnology.
34:625631.
Speight, J .G. 1994. The Chemistry and Technology of Coal, 2
nd
edition, Revised
and Expanded. Marcel Dekker Inc. New York.
Sugoro, I. 2009. Aplikasi Teknik Nuklir Untuk Biosolubilisasi Batubara. Proposal
Disertasi: ITB. Bandung.
Sugoro, I., T. Kuraesin, M.R. Pikoli, S. Hermanto, P. Aditiawati. 2009. Isoloasi
Seleksi Fungi Pelaku Solubilisasi Batubara Subbituminous. Jurnal biologi
Lingkungan 3(2): 75-87
Tao, X.X., L.Y. Pan, K.Y. Shi, H. Chen, S.D. Yin, Z.F. Luo. 2009.
Biosolubilization of Chinese Lignite I: Exstraseluller Protein Analysis.
Mining Sciene and Technology 16: 358-362.
Ummubalqis. 2000. Karakterisasi Protease dari Ekskretori atau Sekretori Stadium
L3 Ascaridia gall. Jurnal Institut Pertanian Bogor 28-40.
Ward, B. 1985. Isolation and Application of Coal-Solubilizing Microorganism. In:
Wise, L.D (editor). Bioprocessing and Biotreatment of Coal. Marcel
Dekker Inc. New York.
Yuwono, T. 2005. Biologi Molekular. J akarta. Erlangga.
61
LAMPIRAN
Lampiran 1. Kerangka berpikir
Biosolubilisasi batubara
Melimpahnya cadangan
batubara kualitas rendah
di Indonesia
Teknologi alternatif ?
Bagaimana karakteristik enzim
ekstraseluler dan produk
biosolubilisasi batubara
kultur kapang tersebut ?
Serbuk batubara tidak diiradiasi
gamma:
(0 kGy) dan diiradiasi (5 kGy)
Kapang:
Penicillium sp. dan
Trichoderma sp.
Kebutuhan BBM
semakin meningkat
62
Lampiran 2. Bagan kerja
Diinkubasi pada suhu ruang
t: 0, 7, 14,28 dan 35 hari
Parameter
Kadar protein
ekstraseluler dengan
Metode Lowry
Hidrolisis
FDA
pH
medium
Analisis
senyawa dengan
GC-MS
Biosolubilisasi
250 dan 450
nm
Kultur stok kapang Serbuk batubara
Peremajaan kapang Tidak diiradiasi dan
diiradiasi gamma
Kontrol:
tanpa batubara
Kultur spora 0 kGy dan 5 kGy
Medium MMSS
Analisis data
Uji kualitatif
enzim
ekstraseluler
Karakterisasi enzim
ekstraseluler
dengan SDS-PAGE
63
Lampiran 3. Komposisi medium
No. Medium Jumlah
1. Potato Dextrose Agar (PDA)
PDA
1 % agar bakto
Dilarutkan dalam 1 liter
akuades
39 gr
10 gr
2. Medium Minimal Salt (MMS)
MgSO
4.
7H
2
O
ZnSO4.7H2O pH 5,5
K
2
HPO
4
FeSO
4
NH
4
(SO
4
)
Dilarutkan dalam 1 liter
akuades
0,52 gr
0,003 gr
5 gr
0,005 gr
1 gr
Lampiran 4. Komposisi reagen Lowry
No. Reagen Jumlah
1. Reagen Lowry I
2 % Na
2
CO
3
dalam 0, 1 NaOH
2,7 % K.Na Tartat
1 % Cu SO
4
49 ml
0,5 ml
0,5 ml
2. Reagen Lowry II
Folin
Akuades
10 ml
10 ml
64
Lampiran 5. Komposisi larutan elektroforesis
No. Larutan Jumlah
1. Larutan Poliakrilamid 30 %
Akrilamid
BIS (Methylene Bis Acrylamide)
Akuades
22,2 gr
0,8 gr
100 ml
2. Larutan Ammonium Persulfat 10 %
Ammonium persulfat
Akuades
0,1 gr/ml
1 ml
3. Larutan Staining
Coomassie Brilliant Blue R-250
Metanol
Asam asetat
Akuades
1 gr
300 ml
100 ml
600 ml
4. Larutan Destaining
Metanol
Asam asetat
Akuades
300 ml
100 ml
600 ml
5 Gel Separating Buffer (1,5 M Tris-HCl)
Tris (Hydroxymethyl aminomethane)
SDS (Sodium Dedocyl Sulfate)
pH
Akuades
18,2 gr
0,4 gr
8,8
100 ml
6 Gel Stacking Buffer (0,5 M Tris-HCl)
Tris (Hydroxymethyl aminomethane)
SDS (Sodium Dedocyl Sulfate)
pH
Akuades
6,1 gr
0,4 gr
6,8
100 ml
7. Buffer Running
Tris (Hydroxymethyl aminomethane)
SDS (Sodium Dedocyl Sulfate)
Glisin
Akuades
3 gr/l
1 gr/l
14,4 gr/l
1 ml
65
Lampiran 6. Hasil pengujian pH medium kapang
Penicillium sp. Trichoderma sp.
Hari
kontrol 0 kGy 5 kGy kontrol 0 kGy 5 kGy
0 4,62 3,45 3,38 4,90 3,40 3,33
7 2,97 2,71 2,74 2,86 2,69 2,71
14 3,16 2,89 2,92 3,02 2,82 2,78
21 3,53 2,96 3,00 3,13 2,96 2,92
28 3,72 3,00 3,02 3,22 3,00 2,97
35 3,88 3,01 3,02 3,42 3,00 2,95
Kontrol : tanpa serbuk batubara.
Lampiran 7. Hasil pengujian biosolubilisasi batubara
Penicillium sp. Trichoderma sp.
Absorbansi Absorbansi
0 kGy 5 kGy 0 kGy 5 kGy
Hari
250
nm
450
nm
250
nm
450
nm
250
nm
450
nm
250
nm
450
nm
0 0,254 0,032 0,224 0,00 0,229 0,00 0,264 0,033
7 2,402 0,017 2,445 0,021 2,628 0,033 2,620 0,028
14 2,323 0,041 1,978 0,033 2,664 0,051 2,671 0,042
21 2,215 0,048 1,799 0,026 2,684 0,098 2,704 0,077
28 2,085 0,037 1,779 0,028 2,562 0,069 2,594 0,069
35 1,718 0,063 1,692 0,053 2,787 0,220 2,761 0,178
Lampiran 8. Hasil pengujian hidrolisis FDA
Penicillium sp. Trichoderma sp.
Absorbansi Absorbansi
Hari
kontrol 0 kGy 5 kGy kontrol 0 kGy 5 kGy
0 0,15 0,041 0,04 0,27 0,045 0,038
7 0,28 0,195 0,095 0,1 0,05 0,07
14 0,085 0,85 0,85 0,27 0,085 0,1
21 0,185 0,67 0,305 0,5 0,125 0,09
28 0,37 0,05 0.2 0,15 0,3 0,24
35 0,425 0,21 0,21 0,3 0,07 0,1
Kontrol : tanpa serbuk batubara.
66
Lampiran 9. Hasil pengujian kadar protein ekstraseluler kapang
Penicillium sp. Trichoderma sp.
Absorbansi Absorbansi
Hari
kontrol 0
KGy
5
KGy
Kontrol 0
KGy
5
KGy
0 0,23 0,31 0,22 0,28 0,225 0,25
7 0,38 0,275 0,23 0,79 0,45 0,585
14 0,38 0,29 0,24 0,895 0,55 0,57
21 0,38 0,38 0,22 0,93 0,51 0,495
28 0,405 0,28 0,22 0,81 0,47 0,46
35 0,6 0,22 0,225 0,75 0,525 0,44
Kontrol : tanpa serbuk batubara.
Kadar protein y = 0,7097 + 0,2049
Lampiran 10. Kurva standar protein BSA
Kadar protein
(mg/ml)
Absorbansi
1,2 1
0,8 0,85
0,4 0,54
0,2 0,275
y =0.7097x +0.2049
R
2
=0.946
0
0.2
0.4
0.6
0.8
1
1.2
0 0.2 0.4 0.6 0.8 1 1.2 1.4
Kadar prot ein (mg/ ml)
A
b
s
o
r
b
a
n
s
i
Pembuatan kurva standar ditujukan untuk menentukan konsentrasi protein
ekstraseluler kultur kapang Penicillium sp. dan Trichoderma sp. Hasil yang
diperoleh berupa persamaan garis yaitu, y = 0,7095 + 0, 2049 dan nilai R
2
=
67
0,946. Sumbu x menunjukkan kadar protein (mg/ml) dan sumbu y menunjukkan
nilai absorbansi.
Lampiran 11. Kurva standar marker
Berat Molekul (KDa) RF Log BM
200 0,111 2,30103
97,4 0,278 1,98855
66,2 0,389 1,82085
45 0,5 1,65321
31 0,722 1,49136
21,5 0,917 1,33243
y =-1.1624x +2.3296
R
2
=0.9554
0
0.5
1
1.5
2
2.5
0 0.2 0.4 0.6 0.8 1
RF
L
o
g
K
D
a
Kurva standar marker dibuat untuk mengetahui berat molekul protein
kapang Penicillium sp. dan Trichoderma sp. pengsolubilisasi batubara.
Perhitungan berat molekul diperoleh dari persamaan garis, dimana hasil yang
diperoleh adalah y = -1,1624 + 2,3296 dan nilai R
2
= 0,9554.
68
Lampiran 12. Uji statistik analisis varians
12.1. Kapang Penicillium sp.
Sumber Keragaman
Jumlah
kuadrat
Derajat
bebas
Derajat
tengah F Signifikansi
pH medium 1,630 2 0,815 5,473 0,016
Galat 2,234 15 0,149
Jumlah 3,864 17
Biosolubilisasi 250 nm 0,097 1 0,097 0,160 0,698
Galat 6,093 10 0,609
Jumlah 6,191 11
Biosolubilisasi 450 nm 0,002 2 0,001 2,832 0,106
Galat 0,003 10 0,000
Jumlah 0,004 12
FDA 0,023 2 0,011 0,157 0,856
Galat 1,096 15 0,073
Jumlah 1,119 17
Kadar Protein 0,019 2 0,010 1,543 0,246
Galat 0,093 15 0,006
Jumlah 1,112 17
Uji Anova dengan hipotesis :
H
0
: Tidak adanya perbedaan yang signifikan pada seluruh perlakuan.
H
1
: Ada perbedaan yang signifikan pada seluruh perlakuan.
Pada tabel, tampak nilai signifikansi pH medium 0,016 0,05, maka H
0
ditolak atau pH medium pada perlakuan ada perbedaan yang signifikan,
sedangkan pada biosolubilisasi 250nm, biosolubilisasi 450 nm, FDA dan kadar
protein ekstraseluler (besar dari atau sama dengan) 0,05 maka H
0
diterima atau
tidak adanya perbedaan yang signifikan pada seluruh perlakuan.
69
12.2. Kapang Trichoderma sp.
Sumber Keragaman Jumlah
kuadrat
Derajat
bebas
Derajat
tengah F Signifikansi
pH medium 0,865 2 0,433 1,963 0,175
Galat 3,307 15 0,220
Jumlah 4,173 17
Biosolubilisasi 250 nm 0,000 1 0,000 0,000 0,986
Galat 9,814 10 0,981
Jumlah 9,814 11
Biosolubilisasi 450 nm 0,000 1 0,000 0,036 0,854
Galat 0,045 10 0,005
Jumlah 0,045 11
FDA 0,097 2 0,048 4,341 0,033
Galat 0,167 15 0,011
Jumlah 0,264 17
Kadar Protein 0,318 2 0,159 5,641 0,015
Galat 0,422 15 0,028
Jumlah 0,740 17
Uji Anova dengan hipotesis :
H
0
: Tidak adanya perbedaan yang signifikan pada seluruh perlakuan.
H
1
: Ada perbedaan yang signifikan pada seluruh perlakuan.
Pada tabel, tampak nilai signifikansi hidrolisis FDA dan kadar protein
ekstraseluler 0,033 dan 0,015 0,05, maka H
0
ditolak atau ada perbedaan yang
signifikan, sedangkan pada pH medium, biosolubilisasi 250 nm, dan
biosolubilisasi 450 nm, (besar dari atau sama dengan) 0,05 maka H
0
diterima
atau tidak adanya perbedaan yang signifikan pada seluruh perlakuan.
70
Lampiran 13. Kromatogram hasil GC-MS kontrol
Keterangan : batubara yang tidak diiradiasi (0 kGy)
1. 2,4-dimetilheptana (C
9
H
20
) 6. heksadekana (C
16
H
34
)
2. n-oktana (C
8
H
18
) 7. nonadekana (C
19
H
40
)
3. 4,7-dimetilundekana (C
13
H
28
) 8. eikosana (C
20
H
42
)
4. 3,7-dimetilundekana (C
13
H
28
) 9. 2,6,10,14-Tetrametilheptadekana (C
21
H
44
)
5. n-Tetradekana (C
14
H
30
)
Keterangan : batubara yang diiradiasi (5 kGy)
1. 2,3,3-trimetilpentana (C
8
H
18
) 7. n-nonane (C
9
H
20
)
2. 3,3-dimetilheksana (C
8
H
18
) 8. 2,3,4-trimetilheksana (C
9
H
20
)
3. n-oktana (C
8
H
18
) 9. 1-iododekana(C
10
H
21
I)
4. 2,4-dimetilheptana (C
9
H
20
) 10. 6-etil-2-metiloktana (C
11
H
24
)
5. 2,4-dimetil-1-heptena (C
9
H
18
) 11. 4,7-dimetilundekana (C
13
H
28
)
6. 4-metiloktana (C
9
H
20
) 12. n-pentadekana (C
15
H
32
)
71
Lampiran 14. Kromatogram hasil GC-MS biolubilisasi batubara oleh kapang
Penicillium sp.
kGy
Keterangan : batubara yang tidak diiradiasi (0 kGy)
1. 2,4-dimetilheptana (C
9
H
20
)
2. 3,7-dimetilundekana (C
13
H
26
)
3. n-tetradekana (C
14
H
30
)
4. 2,6,10,14-tetrametilheptadekana (C
21
H
44
)
Keterangan : batubara yang diiradiasi (5 kGy)
1. 3,7-dimetilundekana (C
13
H
28
)
2. n-tetradekana (C
14
H
30
)
72
Lampiran 15. Kromatogram hasil GC-MS biosolubilisasi batubara oleh kapang
Trichoderma sp.
Keterangan : batubara yang tidak diiradiasi (0 kGy)
1. 2,4-dimetilheptana (C
9
H
20
)
2. 3,7-dimetilundekana (C
13
H
28
)
Keterangan : batubara yang diiradiasi (5 kGy)
1. 2,4-dimetilheptana (C
9
H
20
)
2. 3,7-dimetilundekana (C
13
H
28
)
3. n-tetradekana (C
14
H
30
)
4. n-heksadekana (C
16
H
34
)
73
Lampiran 16. Foto-foto hasil biosolubilisasi batubara.
(A) (B)
Foto 1. Kontrol (tanpa batubara) pada hari ke-7 inkubasi oleh kapang Penicillium
sp.(A) dan kapang Trichoderma sp. (A)
(A) (B)
Foto 2. Hasil biosolubilisasi batubara oleh kapang Penicillium sp. pada hari ke-7
inkubasi. (A) batubara yang tidak diiradiasi (0 kGy) dan (B) batubara yang
diiradiasi (5 kGy).
74
(A) (B)
Foto 3. Hasil biosolubilisasi batubara oleh kapang Trichoderma sp. pada hari ke-
14 inkubasi. dan (A) batubara yang diiradiasi (5 kGy) dan (B) batubara
yang tidak diiradiasi (0 kGy)
Foto 4. Hasil analisis kadar protein ektraseluler kapang, tanda panah menunjukkan
terbentuknya warna yang lebih gelap menandakan terdapatnya enzim
ektraseluler kapang.
75
(B)
(A)
Foto 5. Hasil Analisis Hidrolisis FDA (Fluorescen Diacetat) Sebelum bereaksi
(A) dan Terjadi reaksi (B). Tanda panah menunjukkan reaksi yang
terjadi, ditandai dengan berubahnya warna menjadi warna kuning (B).
(A) (B)
Foto 6. Isolat kapang Penicillium sp. (A) dan Trichoderma sp. (B)
Anda mungkin juga menyukai
- Alur Pelayanan PRB Dan Prolanis KF DelangguDokumen5 halamanAlur Pelayanan PRB Dan Prolanis KF DelangguDiamanta Vion DevonaBelum ada peringkat
- Syarat & Form SIPA ApingDokumen5 halamanSyarat & Form SIPA Apingafridatul fikriyahBelum ada peringkat
- Step 1-5 Skenario 2Dokumen4 halamanStep 1-5 Skenario 2Diamanta Vion DevonaBelum ada peringkat
- CoverDokumen1 halamanCoverDiamanta Vion DevonaBelum ada peringkat
- CoverDokumen1 halamanCoverDiamanta Vion DevonaBelum ada peringkat
- SoalDokumen1 halamanSoalDiamanta Vion DevonaBelum ada peringkat
- Form Hasil Pengamatan Prak. FarkogDokumen2 halamanForm Hasil Pengamatan Prak. FarkogDiamanta Vion DevonaBelum ada peringkat