Praktikum Elektrokimia
Diunggah oleh
Ricky nelsonJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Praktikum Elektrokimia
Diunggah oleh
Ricky nelsonHak Cipta:
Format Tersedia
UJIAN PRAKTIKUM KIMIA XII IPA Nama :
SEL ELEKTROKIMIA Kelas :
SMA BINTANG MULIA
SEL ELEKTROKIMIA
I. Tujuan Percobaan
- Menentukan tingkat kereaktifan logam berdasarkan potensial reduksi (E°)
- Menentukan potensial sel (Esel) berdasarkan hasil percobaan
II. Teori Dasar
Sel elektrokimia terbagi 2 yaitu sel Volta dan sel elektrolisis.
1. Sel Volta adalah sel kimia yang merubah energi kimia menjadi energi listrik
Sel Volta disusun berdasarkan logam-logam dengan kereaktifan tertentu sehingga menghasilkan listrik (volt).
Kereaktifan logam diukur berdasarkan potensial reduksinya dan diurutkan dalam suatu deret yang disebut
sebagai deret volta. Berikut ini urutan berdasarkan logam dalam deret volta :
Li – K – Ba – Ca – Na – Mg – Al – Mn – Zn – Cr – Fe – Ni – Co – Sn – Pb – H – Cu – Hg – Ag – Pt – Au
Makin kecil potensial reduksinya makin makin reaktif sifat logamnya.
E°sel = E°katoda - E°anoda
0,0592
Esel = E°sel - log Kc
n
Keterangan : E° = potensial reduksi standar
n = jumlah elektron
Kc = tetapan kesetimbangan
2. Sel Elektrolisis adalah sel kimia yang dapat mengubah energi listrik jadi energi kimia
III. Alat dan Bahan
Alat : gelas kimia Bahan : larutan KCl 0,1 M
pipa U larutan ZnSO4 0,1 M
Voltmeter larutan CuSO4 0,1 M
Logam Cu, Zn, Mg, Al, Fe kapas
penjepit buaya
Power supply
IV. Cara Kerja
Sel Volta
1. Tuangkan larutan ZnSO4 dan CuSO4 0,1 M sebanyak 50 ml ke dalam gelas kimia yang berbeda
2. Masukkan jembatan garam (pipa U yang sudah terisi larutan KCl) untuk menghubungkan kedua larutan
di atas
3. Masukkan batang Zn ke dalam larutan ZnSO 4 dan batang Cu ke dalam larutan CuSO4 lalu jepit kedua
batang tersebut dan hubungkan dengan Voltmeter
4. Ukur potensial yang terjadi
5. Lakukan cara yang sama dengan mengganti logam Zn dengan logam Fe, Mg, Al secara bergantian
Sel Elektrolisis
1. Gunakan elektroda karbon pada kedua kutub (katoda dan anoda) lalu hubungkan dengan power supply
2. Masukkan kedua elektroda karbon ke dalan larutan ZnSO 4 dan amati perubahan yang terjadi pada kedua
elektroda
3. Lakukan hal yang sama untuk larutan CuSO 4
V. Data Pengamatan
Sel Volta
No Larutan sel Esel (Volt)
1 Zn|Zn2+||Cu2+|Cu
2 Fe|Cu
3 Mg|Cu
4 Al|Cu
Sel Elektrolisis
No Larutan Pengamatan
1 ZnSO4
2 CuSO4
VI. Perhitungan
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
VII. Kesimpulan
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………
Anda mungkin juga menyukai
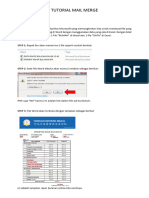
- Tutorial Mail MergeDokumen4 halamanTutorial Mail MergeRicky nelsonBelum ada peringkat
- RPP 3 - Ikatan Kimia, Bentuk Molekul, Dan Interaksi AntarmolekulDokumen12 halamanRPP 3 - Ikatan Kimia, Bentuk Molekul, Dan Interaksi AntarmolekulRicky nelsonBelum ada peringkat
- Silabus Kimia Xi 2021Dokumen16 halamanSilabus Kimia Xi 2021Ricky nelsonBelum ada peringkat
- RPP 4 - Larutan Elektrolit Dan Larutan NonelektrolitDokumen6 halamanRPP 4 - Larutan Elektrolit Dan Larutan NonelektrolitRicky nelsonBelum ada peringkat
- RPP 5 - Reaksi Reduksi Dan Oksidasi Serta Tata Nama SenyawaDokumen7 halamanRPP 5 - Reaksi Reduksi Dan Oksidasi Serta Tata Nama SenyawaRicky nelsonBelum ada peringkat
- Pemetaan Kompetensi Dan Teknik PenilaianDokumen5 halamanPemetaan Kompetensi Dan Teknik PenilaianRicky nelsonBelum ada peringkat
- Program SemesterDokumen2 halamanProgram SemesterRicky nelsonBelum ada peringkat
- RPP 6 - Hukum-Hukum Dasar Kimia Dan StoikiometriDokumen13 halamanRPP 6 - Hukum-Hukum Dasar Kimia Dan StoikiometriRicky nelsonBelum ada peringkat
- Silabus Kimia X 2021Dokumen14 halamanSilabus Kimia X 2021Ricky nelsonBelum ada peringkat
- Remed Ikatan KimiaDokumen3 halamanRemed Ikatan KimiaRicky nelsonBelum ada peringkat
- Ikatan KimiaDokumen8 halamanIkatan KimiaRicky nelsonBelum ada peringkat
- Latihan Konsep MolDokumen1 halamanLatihan Konsep MolRicky nelson100% (1)
- Mid Ganjil XIIDokumen3 halamanMid Ganjil XIIRicky nelsonBelum ada peringkat
- Mid X GanjilDokumen5 halamanMid X GanjilRicky nelsonBelum ada peringkat
- Soal Ulangan KoligatifDokumen1 halamanSoal Ulangan KoligatifRicky nelsonBelum ada peringkat
- LKPD 1Dokumen7 halamanLKPD 1Ricky nelsonBelum ada peringkat