Latar Belakang
Diunggah oleh
HardianJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Latar Belakang
Diunggah oleh
HardianHak Cipta:
Format Tersedia
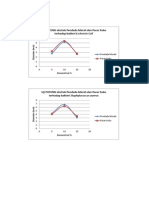
LATAR BELAKANG: Glimepiride adalah antihyperglycemic agen sulfonilurea oral yang diindikasikan untuk pengobatan diabetes mellitus tipe
2. Meskipun ada laporan dalam literatur mengenai (PK) karakteristik farmakokinetik glimepiride, data beberapa parameter PK tersedia dalam populasi Cina, tidak ada yang tersedia mengenai formulasi generik baru dikembangkan. TUJUAN: Untuk memenuhi persyaratan untuk memasarkan produk generik baru di Cina, penelitian ini dirancang untuk membandingkan sifat PK dan bioekivalensi dari 2-mg tablet glimepiride: perumusan generik yang baru dikembangkan (test) dan formulasi bermerek (referensi) dalam bahasa Cina yang sehat laki-laki relawan. METODE: Sebuah dosis tunggal, acak-urutan, open-label, 2-arah studi crossover dilakukan di berpuasa sukarelawan sehat laki-laki Cina. Pesertanya secara acak dalam rasio 1:1 untuk menerima 1 tablet (2 mg masing-masing) dari tes atau formulasi referensi, diikuti oleh periode washout 1 minggu dan administrasi perumusan alternatif. Obat studi diberikan setelah puasa 10 jam semalam. Sampel plasma dikumpulkan sebelum studi obat administrasi (baseline) dan pada 0,5, 1, 1,5, 2, 2,5, 3, 4, 5, 6, 8, 10, 12, 24, dan 48 jam setelah pemberian obat studi. Konsentrasi dalam plasma dari glimepiride induk dan metabolit M1 yang dianalisis dengan metode LC-MS/MS. Formulasi dianggap bioekuivalen jika CI 90% untuk nilai log-berubah berada dalam kisaran yang telah ditentukan kesetaraan (70% 143% untuk C (max) dan 80% -125% untuk AUC), sesuai dengan pedoman Negara Food and Drug Administration (SFDA) dari Cina. Tolerabilitas didasarkan pada pencatatan efek samping (AE), pemantauan tanda-tanda vital, EKG, dan tes laboratorium pada awal dan penyelesaian studi. HASIL: Sebanyak 24 relawan pria yang sehat Cina yang terdaftar dan menyelesaikan studi, namun, hanya data dari 23 mata pelajaran dimasukkan (rata-rata [SD] usia, 23,6 [2,2] tahun [kisaran, 18,6-26,9 tahun], berat badan, 64,0 [ 8,4] kg [kisaran, 52,0-82,0 kg], dan tinggi, 172,3 [5,6] cm [kisaran, 164,0185,0 cm) dalam PK dan penilaian tolerabilitas karena melanggar protokol. Untuk glimepiride orangtua, CI 90% untuk rasio Cmax, AUC (0-t), dan AUC (0-infinity) adalah 93,83% menjadi 115.19%, 90,82% menjadi 102,29%, dan 92.22% menjadi 103.78%, masing-masing. Untuk metabolit M1, yang CI 90% adalah 91.71% menjadi 110,79%, 91.33% menjadi 101.76%, dan 89,99% sampai 99,85%. Keduanya memenuhi kriteria yang telah ditentukan untuk bioekivalensi. Empat AE (17,4%) dilaporkan: hipertrigliseridemia (2 subyek [8,7%], masing-masing menerima 1 tes dan formulasi referensi), hipoglikemia dan; peningkatan sel darah merah dalam urin (1 subjek [4,3%] menerima formulasi referensi) (1 subjek [4,3%] menerima formulasi uji). Kejadian hipoglikemia adalah AE hanya dianggap mungkin terkait untuk mempelajari pemberian obat, semua orang lain yang dianggap mungkin tidak berhubungan. Semua AE sementara dan dianggap oleh para peneliti menjadi ringan. KESIMPULAN:
Dalam penelitian kecil di berpuasa sukarelawan sehat laki-laki Cina, dosis 2 mg-tunggal dari formulasi uji memenuhi kriteria peraturan untuk mengasumsikan bioekivalensi untuk perumusan referensi berdasarkan tingkat dan luasnya penyerapan. Kedua formulasi yang ditoleransi
Anda mungkin juga menyukai
- 2006-2-01067-TI-bab 1 PDFDokumen0 halaman2006-2-01067-TI-bab 1 PDFHardianBelum ada peringkat
- 9.2.1 Sediaan Parenteral Pada Gangguan Keseimbangan Cairan Dan ElektrolitDokumen3 halaman9.2.1 Sediaan Parenteral Pada Gangguan Keseimbangan Cairan Dan ElektrolitHardianBelum ada peringkat
- Pengurus Ormawa MIPA UMDokumen3 halamanPengurus Ormawa MIPA UMrifki_luthfidyanto1407Belum ada peringkat
- Grafik PotensiDokumen1 halamanGrafik PotensiHardianBelum ada peringkat
- Jurnal BioteknologiDokumen14 halamanJurnal BioteknologiHijrah Syam50% (2)
- Uu. No 23 Tahun 1992 Tentang KesehatanDokumen31 halamanUu. No 23 Tahun 1992 Tentang KesehatanBudi AstawanBelum ada peringkat
- Daftar Peserta Pimnas 2013Dokumen45 halamanDaftar Peserta Pimnas 2013HardianBelum ada peringkat
- Kortikosteroid, GlukokortikoidDokumen8 halamanKortikosteroid, GlukokortikoidrajaalfatihBelum ada peringkat
- Kumpulan Judul SkripsiDokumen1 halamanKumpulan Judul SkripsiHardianBelum ada peringkat
- SOAL UAS Kewirausahaan Pak OceanDokumen1 halamanSOAL UAS Kewirausahaan Pak OceanHardianBelum ada peringkat
- PP No. 72 TH 1998 TTG Pengamanan Sediaan Farmasi Dan Alat KesehatanDokumen47 halamanPP No. 72 TH 1998 TTG Pengamanan Sediaan Farmasi Dan Alat KesehatanMeris AdidithBelum ada peringkat
- 440 882 1 SMDokumen9 halaman440 882 1 SMMahanani SubagioBelum ada peringkat
- BAB II Tinjauan PustakaDokumen6 halamanBAB II Tinjauan PustakaHardianBelum ada peringkat
- Simplisiadan EkstrakDokumen6 halamanSimplisiadan EkstrakSuigetsu P'manz PutraBelum ada peringkat
- Jadwal Seminar KelasDokumen2 halamanJadwal Seminar KelasHardianBelum ada peringkat
- Jadwal Seminar KelasDokumen2 halamanJadwal Seminar KelasHardianBelum ada peringkat
- Daftar Simplisia Kelas BDokumen13 halamanDaftar Simplisia Kelas BHardianBelum ada peringkat
- Mikro MicDokumen1 halamanMikro MicHardianBelum ada peringkat
- Evaluasi Serbuk Granulasi KeringDokumen1 halamanEvaluasi Serbuk Granulasi KeringHardianBelum ada peringkat
- Perhitungan TabletDokumen2 halamanPerhitungan TabletHardianBelum ada peringkat
- 416 E3 D 01Dokumen11 halaman416 E3 D 01HardianBelum ada peringkat
- Perhitungan TabletDokumen2 halamanPerhitungan TabletHardianBelum ada peringkat