3.kimia Kelas 1 SBMPTN
Diunggah oleh
Erika SandraJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
3.kimia Kelas 1 SBMPTN
Diunggah oleh
Erika SandraHak Cipta:
Format Tersedia
Kimia
TATA NAMA SENYAWA
DAN PERSAMAAN REAKSI
1.1. Rumus Kimia Zat
Rumus kimia suatu zat menyatakan jenis dan jumlah relatif atomatom yang terdapat dalam zat itu.
1.1.1. Rumus Kimia Unsur
Rumus kimia unsur yang terdiri atas satu atom (monoatomik)
sama dengan lambang unsur tersebut. Unsur-unsur monoatomik
adalah unsur-unsur logam dan unsur-unsur gas mulia.
Contoh :
Gas Mulia
Perak
: Ag
Helium : He
Emas
: Au
Neon : Ne
Besi
: Fe
Argon : Ar
Tembaga : Cu
Kripton : Kr
Platina : Pt
Xenon : Xe
Radon : Rn
1.1.2. Rumus Kimia Senyawa
Senyawa adalah gabungan dari beberapa unsur.
Rumus senyawa ada 2 jenis :
1. Rumus Senyawa Kovalen-Biner
Tersusun dari unsur non logam dengan non logam
Contoh :
CO = karbon mono oksida
CO2 = karbon dioksida
N2O3 = di nitrogen trioksida
N2O5 = dinitrogen penta oksida
CCl4 = karbon tetra klorida
Kimia
121
S O N Y
S U G E M A
C O L L E G E
2. Rumus Senyawa Ionik Biner
Tersusun dari unsur logam dengan non logam. Nama unsur
logam disebut dahulu diikuti nama unsur non logam yang
diberi akhiran -ida.
contoh :
KCl
: Kalium klorida BaS:Barium Sulfida
Al2O3 : Alumunium oksida
MgF2 : Magnesium Florida
Ingat !
Untuk unsur-unsur logam yang mempunyai bilok (bilangan
oksidasi) lelbih dari satu macam.
Contoh : Fe2+
Fe3+
2+
CO
CO3+
Sn2+
Sn4+
+
Hg
Hg2+
maka harga biloks logam harus disebutkan.
Contoh : FeCl2 besi (II) klorida
COCl3 kobalt (III) oksida
SnF4 timah (IV) florida
1.1.3. Senyawa Ionik Poliatomik
Pada senyawa ionik logam dapat bertindak sebagai kation
(ion bermuatan positif) dan unsur non logam dapat bertindak
sebagai anion (ion bermuatan negatif). Ada beberapa polianion yang harus diingat :
NO2-
: nitrit SO32- : sulfit
PO33- : pospit
NO3-
: nitrat SO42- : sulfat
PO43- : pospat
2
CH3COO- : asetat CO3 - : karbonat
ClO2-
: klorit C2O42- : oksalat
ClO3-
: klorat
Contoh :
KNO3
: kalium nitrat
Cu3(PO4) : tembaga II pospat (Ingat ! logam aneh)
MgSO4 : magnesium sulfat
Na3PO4 : natrium pospat
Fe(ClO3)2 : besi (II) klorat
122
Kimia
S O N Y
S U G E M A
C O L L E G E
1.1.4. Tata Nama Asam
Senyawa asam terbentuk bila ion H+ bertemu dengan anion
Contoh :
HCl
: asam klorida
H2C2O4 : asam oksalat
H2S
: asam sulfida
H3PO4 : asam pospat
HClO3 : asam klorat
1.1.5. Tata nama basa
Senyawa basa terbentuk bila kation bertemu dengan ion OH(hidroksida)
Contoh :
NaOH : Natrium Hidroksida
Ca(OH)2 : Kalsium Hidroksida
Fe(OH)2 : Besi (II)Hidroksida
Ae(OH)3 : Alumunium Hidroksida
Co(OH)3 : Kobal (III) Hidroksida
1.2. Bilangan Oksidasi
Bilangan oksidasi suatu unsur dapat ditentukan yang harus di
ingat.
Pada umumnya bilok H = +1 O = -2 Logam = sesuai dengan
valensinya dan bilok senyawa = 0
Contoh :
CATATAN :
1. Beberapa Jenis Kation
Kimia
123
S O N Y
S U G E M A
C O L L E G E
2. Beberapa Jenis Anion
1.3. Persamaan Reaksi
Persamaan reaksi menggambarkan zat yang bereaksi (pereaksi),
hasil reaksi (produk), wujud pereaksi dan hasil reaksi, arah
reaksi berlangsung (dilambangkan dengan tanda panah), dan
perbandingan jumlah partikel pereaksi, serta hasil reaksi.
Contoh : Gas hidrogen bereaksi dengan gas oksigen membentuk
air, persamaan reaksinya dapat ditulis sebagai berikut :
2H2 (g) + O2 (g) 2H2O (l)
124
Kimia
H2 dan O2 sebagai pereaksi (reaktan), sedangkan H2O sebagai
hasil reaksi (produk). Bilangan yang mendahului rumus kimia
zat dalam persamaan reaksi disebut koefisien reaksi. Pada
contoh di atas koefisien H2 adalah 2, koefisien O2 adalah 1,
dan koefesien H2O adalah 2. Wujud zat dinyatakan dengan g =
gas; l = cairan (liquid); s = padat (solid); dan aq = larutan berair
(aqueous, baca: akues).
S O N Y
S U G E M A
C O L L E G E
Penulisan persamaan dapat dilakukan dalam 2 langkah :
1. Menuliskan rumus kimia zat pereaksi dan produk, lengkap
dengan keterangan tentang wujud keadaannya.
2. Penyetaraan, yaitu memberi koefisien yang sesuai sehingga
jumlah atom setiap unsur sama pada kedua ruas.
Penyetaraan persamaan reaksi dapat dilakukan dengan 2 cara
yaitu cara langsung dan cara matematika.
Contoh :
Logam alumunium bereaksi dengan larutan asam klorida mem
bentuk larutan alumunium klorida dan gas hidrogen.
Langkah 1 :
Menuliskan rumus kimia zat pereaksi dan hasil reaksi:
Al (s) + HCl (aq) Al Cl3 (aq) + H2 (g)
Langkah 2 :
Penyetaraan dapat dilakukan dengan 2 cara :
1. Cara langsung :
Al (s) + HCl (aq) AlCl3 (aq) + H2 (g)
Al (s) + 3HCl (aq) AlCl3 (aq) + 3/2 H2 (g)
2Al (s) + 6HCl (aq) 2AlCl3 (aq) + 3H2 (g) (setara)
2. Cara Matematika :
1. Misalkan : a Al (s) + b HCl (aq) c Al Cl3 (aq) +d H2 (g)
2. Jumlah atom unsur ruas kiri = ruas kanan
Unsur Al : a = c
(persamaan 1)
H : b = 2d (persamaan 2)
Cl : b = 3c (persamaan 3)
Jika a = 1, maka persamaan 1 : a = c
persamaan 3 : b = 3c persamaan 2 : b = 2d
b = 3 x 1 = 3
3 =2d d = 3/2
3. Persamaannya menjadi :
1 Al (s) + 3 HCl (aq) 1 Al Cl3 (aq) + 3/2 H2 (g)
2 Al (s) + 6 HCl (aq) 2 AlCl3 (aq) + 3 H2(g)
Kimia
125
S O N Y
S U G E M A
C O L L E G E
HUKUM-HUKUM
DASAR KIMIA
2.1. Hukum Kekekalan Massa (Hukum Lavoisier)
Berdasarkan serangkaian percobaan yang dilakukannya, Lavoisier
menyimpulkan bahwa Massa zat-zat sebelum reaksi dan sesudah
reaksi adalah sama. Pernyataan itu dikenal sebagai Hukum Ke
kekalan Massa.
2.2. Hukum Perbandingan Tetap (Hukum Proust)
Berdasarkan serangkaian percobaan yang dilakukannya, Joseph
Louis Proust menyimpulkan bahwa, Dalam suatu senyawa,
perbandingan massa unsur-unsur penyusunnya selalu tetap,
yang dikenal sebagai Hukum Perbandingan Tetap.
2.3. Hukum Perbandingan Berganda (Hukum Dalton)
Menurut hukum perbandingan berganda adalah jika dua unsur
membentuk dua macam senyawa atau lebih, untuk massa salah
satu unsur yang sama banyaknya, massa unsur yang kedua
dalam senyawa itu akan berbanding sebagai bilangan bulat dan
sederhana.
2.4. Hukum Perbandingan Volume (Hukum Gay Lussac)
Hukum perbandingan volume merupakan temuan Gay Lussac,
yang berbunyi : Pada temperatur dan tekanan yang sama,
perbandingan volume gas-gas yang bereaksi dan volume gasgas hasil reaksi merupakan perbandingan bilangan yang bulat
dan sederhana.
2.5. Hukum Avogadro
Hukum Avogadro menyatakan bahwa: Pada suhu dan tekanan
yang sama, semua gas yang bervolume sama akan mengandung
jumlah molekul yang sama pula.
Avogadro menyempurnakan hasil percobaan Gay Lussac.
Menghitung Volume Berdasarkan Hukum Gay Lussac
Menurut hukum perbandingan volume dari Gay Lussac dikatakan
bahwa : Pada suhu dan tekanan yang sama, perbandingan
volume gas sesuai dengan perbandingan koefisien reaksinya.
Untuk suatu reaksi kimia :
p A(g) + q B(g) r C (g) + s D (g)
126
Kimia
S O N Y
S U G E M A
C O L L E G E
Jika dimisalkan volume gas A sebanyak y liter, maka volume gas
B dapat dihitung dengan rumusan :
Contoh soal :
Pada T dan P yang sama, 6 liter gas etena (C2H4) dibakar mem
bentuk gas karbon dioksida dan uap air. Hitung volume gas
oksigen yang diperlukan.
Jawab :
C2H4 (g) + 3 O2(g) 2 CO2 (g) + 2H2O (g)
Volume gas O2 =
Volume gas O2 = 3/1 x 6 liter = 18 liter
Jadi volume gas oksigen yang diperlukan adalah 18 liter
Hubungan Antara Volume Gas Dan Jumlah Molekul (Hukum
Avogadro)
Menurut hukum Avogadro disimpulkan bahwa Pada suhu dan
tekanan yang sama, perbandingan volume gas sesuai dengan
perbandingan jumlah molekul dan sesuai dengan perbandingan
koefesien reaksinya.
Contoh soal :
Jumlah partikel yang terdapat dalam 11,2 liter gas nitrogen
adalah 3 x 1023 molekul. Berapakah jumlah partikel yang terdapat
dalam 33,6 liter gas amoniak jika diukur pada suhu dan tekanan
yang sama.
Jawab :
Jumlah molekul :
Kimia
127
S O N Y
S U G E M A
C O L L E G E
KONSEP MOL
Konsep mol merupakan jembatan yang menghubungkan massa
zat dengan jumlah partikel, artinya dengan konsep mol kita dapat
mengetahui jumlah partikel yang terkandung dalam massa tertentu
zat, misalnya jumlah molekul dalam 1 gram air atau jumlah atom
dalam 2 gram besi.
3.1. Definisi MOL
Mol adalah satuan jumlah zat
1 mol zat = L partikel
L = bilangan Avogadro = 6,02 x 1023
Contoh :
1 mol air = 6,02 x 1023 molekul air
1 mol tembaga = 6,02 x 1023 atom tembaga
1 mol NaCl = 6,02 x 1023 molekul NaCl (satuan = gabungan ion
Na+ dan ion Cl-)
Hubungan jumlah mol dengan jumlah partikel adalah...
X = n x L atau n =
X
L
dengan X = jumlah partikel (atom, molekul atau ion)
n = jumlah mol
L = bilangan Avogadro = 6,02 x 1023
3.2. Massa Molar (Mm)
Massa molar zat adalah massa 1 mol zat. Massa molar dinyatakan
dengan lambang Mm dan satuannya adalah gram/mol.
Contoh :
Massa 1 mol C (Ar = 12) = 12 gram
Massa 1 mol O2 (Ar O = 16) = 32 gram
Massa 1 mol H2O (Ar H = 1; O = 16) = 18 gram
Jadi massa molar zat sama dengan Ar atau Mr zat itu yang
dinyatakan dalam gram.
3.3. Volume Molar Gas
Volume molar (Vm) gas menyatakan volume satu mol gas.
Oleh karena volume gas dipengaruhi oleh suhu dan tekanan,
maka setiap menyatakan volume gas harus diikuti keterangan
tentang suhu (T=temperatur) dan tekanan (P = Pressure).
128
Kimia
S O N Y
S U G E M A
C O L L E G E
Menurut hukum Avogadro, Pada suhu dan tekanan yang
sama, perbandingan volume gas sama dengan perbandingan
jumlah molnya.
V1 n1
=
V2 n2
V1 dan n1 berturut-turut adalah volume gas dan jumlah mol gas 1
V2 dan n2 berturut-turut adalah volume gas dan jumlah mol gas 2
Dalam ilmu kimia, kondisi dengan suhu 00C dan tekanan 1
atom disebut keadaan standar (STP = Standard Temperature
and Pressure). Sesuai dengan hukum Avogadro, maka :
Volume 1 mol gas pada keadaan standar (STP) = 22,4 liter
Hubungan jumlah mol dan volume gas pada STP :
V = n x 22,4 liter atau n =
V
22,4 liter
dengan V = volume gas (liter) dan n = jumlah mol gas (mol)
Pada keadaan bukan standar, volume gas dapat dihitung dengan
persamaan gas ideal:
PV = n RT
dengan P = tekanan gas (atmosfer = atm)
V = volume gas (liter)
n = jumlah mol gas (mol)
R = tetapan gas = 0,08205 liter atm mol-1 K-1
T = suhu mutlak gas (K = kelvin)
Volume gas dalam suatu tempat dapat berubah sesuai dengan
suhu dan tekanan pada tempat tersebut. Untuk menentukan
volume gas tersebut dapat digunakan hukum Boyle-Gas Lussac :
P1 V1 P2 V2
=
T1
T2
dengan V1 = volume gas pada P1(liter), P1= tekanan gas pada
V1(atm)
dengan V2 = volume gas pada P2(liter), P2= tekanan gas pada
V2(atm)
Kimia
129
S O N Y
S U G E M A
C O L L E G E
Hubungan antara jumlah mol dengan massa zat :
m = n x Mm atau m = n x Ar atau Mr atau n =
m
Ar atau Mr
dengan m = massa zat (gram)
n = jumlah mol zat (mol)
Mm = massa molar = Ar atau Mr
MOLARITAS DAN PENGENCERAN
Molaritas menyatakan banyaknya mol zat terlarut dalam 1 liter
larutan.
Contoh :
Larutan NaCl 1 M artinya dalam 1 liter larutan terdapat 1 mol NaCl.
Hubungan molaritas dengan jumlah mol zat :
M=
n
atau n = M x V
V
dengan M = molaritas larutan (mol/liter)
n = jumlah mol zat terlarut (mol)
V = volume larutan (liter)
Pengenceran Larutan
Jika zat-zat yang terdapat di laboratorium konsentrasinya terlalu
tinggi dapat dilakukan pengenceran. Dalam pengenceran volume
dan kemolaran larutan berubah, tetapi jumlah mol zat terlarut
tidak berubah.
Karena pengenceran tidak mengubah jumlah mol zat terlarut,
maka :
n1= n2
V1. M1 = V2. M2
dengan V1 = volume sebelum pengenceran
M1 = konsentrasi molar sebelum pengenceran
V2 = volume sesudah pengenceran
M2 = konsentrasi molar sesudah pengenceran
130
Kimia
S O N Y
S U G E M A
C O L L E G E
Contoh soal :
Berapa ml air harus ditambahkan pada 100 ml larutan NaOH
0,5 M agar diperoleh larutan dengan konsentrasi 0,2 M.
Jawab :
Misal volume air yang harus ditambah = x ml,
maka V2 = (100 + x) ml
V1. M1 = V2. M2
100.0,5 = (100 + x).0,2
50 = 20 + 0,2 x
0,2 x = 50 20
0,2 x = 30
x = 150
Jadi, volume air yang harus ditambahkan adalah 150 ml
Diantara zat yang tersedia dalam bentuk larutan pekat adalah
berbagai jenis asam dan amonia. Misalnya asam sulfat biasanya
diperdagangkan berupa larutan dengan kadar 98% dan massa
jenis 1,8 kg.L-1
Kemolaran larutan pekat yang diketahui kadar dan massa jenis
nya dapat dihitung dengan rumus :
M=
. 10% massa
mol L-1
Mr
dengan M = kemolaran zat
= massa jenis zat
% massa = kadar zat
Mr = massa molekul relatif
RUMUS EMPIRIS, RUMUS
MOLEKUL DAN RUMUS GARAM
HIDRAT (AIR KRISTAL)
Rumus empiris adalah rumus kimia yang menyatakan perbandingan
mol paling sederhana unsur-unsur yang menyusun suatu senyawa.
Dalam menentukan rumus empiris diperlukan data, yaitu :
1. massa unsur, perbandingan massa unsur, atau persentase massa
unsur yang menyusun senyawa.
2. massa atom realtif (Ar) unsur tersebut.
Kimia
131
S O N Y
S U G E M A
C O L L E G E
Rumus molekul adalah rumus kimia yang menggambarkan jumlah
atom dan jenis unsur penyusun senyawa.
Dalam menentukan rumus molekul diperlukan data rumus empiris
dan massa molekul relatif (Mr) senyawa.
Ada beberapa senyawa yang rumus empirisnya juga merupakan
rumus molekulnya contoh : H2O, NH3, H2SO4.
Air kristal adalah molekul air yang terikat pada molekul senyawa
lain. Senyawa yang mengandung air kristal disebut senyawa hidrat,
misalnya : terusi, CuSO4.5H2O (Tembaga (II) sulfat pentahidrat); gips,
CaSO4.2H2O (Kalsium sulfat dihidrat); garaam inggris, MgSO4.7H2O
(Magnesium sulfat heptahidrat); sodahablur, Na2CO3.10H2O (Natrium
karbonat dekahidrat).
Jika suatu hidrat dipanaskan, sebagian atau seluruh air kristalnya
dapat lepas (menguap).
Contoh : 1. CuSO4.5H2O (s) CuSO4(s) + 5 H2O (g)
Tembaga (II) sulfat
Anhidrat
2. CaSO4.2H2O (s) CaSO4. H2O (s) + H2O (g)
Gips
Gips bakar
Jika suatu hidrat dilarutkan dalam air, maka air kristalnya akan lepas.
Contoh : CuSO4.5H2O (s) CuSO4 (aq) + 5 H2O (l)
Jumlah air kristal dari suatu hidrat dapat dilakukan dengan berbagai
cara, salah satu caranya yaitu dengan memanaskan garam terhidrat
menjadi garam anhidrat.
KADAR UNSUR DALAM SENYAWA
Perbandingan massa dan kadar unsur dalam suatu senyawa dapat
ditentukan dari rumus molekulnya. Misalkan untuk senyawa AmBn
berlaku :
massa A : massa B = m.Ar A : n.Ar B
massa A :
132
Kimia
m.Ar Ba
x massa AmBn
Mr AmBn
S O N Y
massa B :
S U G E M A
C O L L E G E
n.Ar B
x massa AmBn
Mr AmBn
Kadar unsur dalam suatu senyawa biasanya dinyatakan dalam
persentase. Misalnya untuk senyawa AmBn, persentase masingmasing unsurnya dapat ditentukan dengan rumus sebagai berikut
:
m.Ar A
100%
Mr AmBn
n.Ar B
% Unsur B =
100%
Mr AmBn
% Unsur A =
Contoh:
Hitung kadar unsur karbon dalam glukosa C6 H12 O6 (Ar C =12 O=16
H = 1)
% Unsur A =
6 Arc
100%
Mrc6H12o6
6.12
100% = 40%
180
REAKSI KIMIA DAN REAKSI
PEMBATAS
Dalam suatu reaksi kimia zat-zat yang berada di sebelah kiri tanda
panah disebut pereaksi dan di sebelah kanan tanda panah disebut
hasil reaksi (produk). Perbandingan mol zat-zat yang bereaksi
mengikuti perbandingan koefisiennya.
Dengan pengertian tersebut, maka banyaknya zat yang diperlukan
atau dihasilkan dalam reaksi kimia dapat dihitung dengan meng
gunakan persamaan reaksi setara.
Apabila jumlah mol zat salah satu zat diketahui, maka jumlah mol
zat yang lain dalam reaksi itu dapat ditentukan dari perbandingan
koefisien reaksinya.
Kimia
133
S O N Y
S U G E M A
C O L L E G E
Contoh soal :
Logam alumunium larut dalam larutan asam sulfat menghasilkan
larutan alumunium sulfat dan gas hidrogen.
a. Tuliskan persamaan reaksinya
b. Berapa mol gas hidrogen dapat dihasilkan jika digunakan 0,5
mol alumunium?
Jawab :
a. Persamaan Reaksinya :
2 Al (s) + 3 H2SO4 (aq) Al2(SO4)3 (aq) + 3H2(g)
b. Perbandingan koefesien Al : H2 = 2 : 3
Al yang bereaksi = 0,5 mol
koefesienH2
Jumlah mol H2 yang dihasilkan =
x mol Al
koefesien Al
3
= x 0,5 mol = 0,75 mol
2
Apabila zat-zat yang kita reaksikan tidak tepat habis bereaksi (tidak
ekivalen), maka salah satu pereaksi akan habis lebih dahulu, sedangkan
pereaksi yang lain bersisa. Jumlah zat hasil reaksi bergantung pada
jumlah pereaksi yang habis lebih dahulu. Oleh karena itu, pereaksi
yang habis lebih dahulu disebut pereaksi pembatas.
Pereaksi pembatas dapat ditentukan dengan membagi jumlah mol
masing-masing pereaksi dengan koefisien reaksi yang bersangkutan.
Pereaksi yang pembagiannya paling kecil adalah pereaksi pembatas.
Contoh soal :
Sebanyak 5 mol logam alumunium bereaksi dengan 3 mol oksigen
membentuk alumunium oksida padat.
a. Tuliskan persamaan reaksinya !
b. Tentukan pereaksi pembatasnya dan massa zat yang bersisa
c. Berapa gram massa Al2O3 yang terbentuk ?
(Ar O = 16; Al = 27)
Jawab :
a. Persamaan reaksinya : 4 Al (s) + 3 O2(g) 2 Al2O3(s)
3
5
b. Al : = 1,25 O2: = 1
3
4
Jadi pereaksi pembatasnya adalah oksigen.
4
Al yang bereaksi = x 3 mol = 4 mol
3
134
Kimia
S O N Y
c.
S U G E M A
C O L L E G E
Zat yang bersisa adalah alumunium sebanyak =
5 4 mol = 1 mol
Massa alumunium yang bersisa =
1 x Ar Al = 1 x 27 gram = 27 gram
Al2O3 yang terbentuk =
koefesien Al2O3
2
x jumlah mol O2 = x 3 mol = 2 mol
koefesienO2
3
Massa Al2O3 yang terbentuk = n x Mr Al2 O3 = 2 x 102 gram =
204 gram
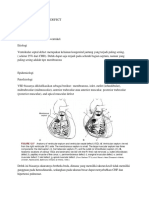
REAKSI REDUKSI DAN OKSIDASI
Reaksi reduksi oksidasi (reaksi redoks) banyak terjadi dalam kehidupan
sehari-hari, diantaranya terjadi pembakaran, metabolisme, dan per
karatan.
A. Perkembangan Konsep Reaksi Redoks
Reaksi redoks berkembang dari reaksi pengikatan (peng
gabungan) dan pelepasan oksigen, serah terima elektron, dan
perubahan bilangan oksidasi.
1. Reaksi Redoks berdasarkan Penggabungan dan Pelepasan
Oksigen
Amati reaksi-reaksi berikut !
Berdasarkan apa yang terjadi pada oksigen dalam reaksi-reaksi
tersebut, jelaskan pengertian reaksi oksidasi dan reaksi reduksi!
Kimia
135
S O N Y
S U G E M A
C O L L E G E
Reaksi oksidasi adalah reaksi penggabungan/mengikat oksigen
Reaksi reduksi adalah reaksi pelepasan oksigen.
2. Reaksi Redoks berdasarkan Serah Terima Elektron
Perhatikan reaksi pembentukan CuCl2 dan CuO melalui ikatan
ion berikut :
Cu Cu2+ + 2e- (oks)
2 Cu 2Cu2+ + 2 e- (oks)
Cl2 + 2 e- 2 Cl- (red) + O2 + 4 e- 2O2- (red) +
Cu + Cl2 CuCl2
2 Cu + O2 2 CuO
Pada kedua reaksi diatas :
Cu melepas
elektron
Cl2 menerima
elektron
O2 menerima
elektron
Reaksi oksidasi adalah Reaksi yang melepas elektron
Reaksi reduksi adalah Reaksi yang menerima elektron
Reaksi redoks adalah Reaksi yang terjadi menerima dan melepas
elektron
3. Perubahan Biloks pada Reaksi Redoks
Kegiatan :
Tentukan biloks dari komponen-komponen pada reaksi-reaksi
berikut :
1.
2.
Reaksi oksidasi : reaksi yang mengalami kenaikan bilok
Reaksi reduksi : reaksi yang mengalami penurunan bilok
Reaksi redoks : reaksi dimana terjadi kenaikan dan penurunan
bilok sekaligus
136
Kimia
S O N Y
S U G E M A
C O L L E G E
4. Reaksi Autoredoks Atau Reaksi Disproporsioasi
Tunjukkan reaksi oksidasi dan reaksi reduksi pada reaksi auto
redoks berikut :
Reaksi autoredoks: reaksi dimana zat mengalami reaksi reduksi
juga mengalami reaksi oksidasi.
5. Reaksi Redoks berdasarkan Perubahan Bilangan Oksidasi
Bilangan oksidasi
Aturan penentuan bilangan oksidasi unsur-unsur secara lengkap
sebagai berikut :
1. Bilangan oksidasi unsur bebas adalah nol
Contoh :
bilangan oksidasi H, N, dan Fe berturut-turut dalam H2, N2 dan
Fe adalah 0
2. Bilangan oksidasi suatu unsur dalam suatu ion monoatom
(tunggal) sama dengan muatannya.
Contoh :
Bilangan oksidasi Mg dalam Mg2+ adalah +2
Bilangan oksidasi S dalam S2- adalah -2
3. Fluorin adalah unsur yang paling elektronegatif dan mem
butuhkan tambahan 1 elektron, mempunyai bilangan oksidasi
-1 pada semua senyawanya.
Contoh :
Bilangan oksidasi F dalam HF, NaF, CaF2, KF adalah -1
4. Jumlah bilangan oksidasi unsur-unsur dalam suatu ion
poliatom = muatannya.
Contoh :
Dalam S2O32- : ( 2 x BO.H) + (BO.S) + (4 x BO.O) = +2
5. Jumlah bilangan oksidasi unsur-unsur dalam suatu senyawa
adalah nol.
Contoh :
Dalam H2SO4 : (2 x BO.H) + (BO.S) + (4 x BO.)) =+6
Kimia
137
S O N Y
S U G E M A
C O L L E G E
6. Bilangan oksidasi unsur dalam senyawanya : golongan 1A
(Li, Na, K, Rb, Cs, Fr) = +1, golongan II A (Be, Mg, Ca, Sr,
Ba, Ra) = +2, gologan IIIA (B, Al) - +3+, golongan IVA (C =
+2. 4; Si = +4; Sn = +2; +4; Pb = +2, +4), golongan VA (N
= +2, 3, +4, +5; P =3, +5; As =3, +5; S =, +5; Bi = 3,+5),
golongan VIA (S = 2, +4, golongan VIIA (F = -1; Cl = 1, +3,
+ 5, +7; Br = 1, +5, +7; l = 1, +5)
Contoh :
Bilangan oksidasi K pada KCl, KNO3, dan K2SO4 adalah +1
Bilangan oksidasi Mg pada MgCl2, MgO, dan MgSO4 adalah +2
7. Bilangan oksidasi hidrogen (H) pada senyawanya adalah
+1, kecuali dalam hidrida logam, hidrogen mempunyai
bilangan oksidasi -1.
Contoh :
Bilangan oksidasi H pada H2O, NH3, dan HCl adalah+1
Bilangan oksidasi H pada NaH, LiH, dan CaH2 adalah -1
8. Bilangan oksidasi oksigen (O) pada senyawanya adalah -2,
kecuali pada senyawa biner dan fluor, oksigen mempunyai
bilangan oksidasi +2, pada senyawa peroksida, bilangan
oksidasi oksigen adalah -1, dan pada senyawa superoksida
bilagan oksidasi oksigen adalah - .
Contoh:
Bilangan oksidasi O pada H2O, Na2O dan CaO adalah -2
Bilangan oksidasi O pada OF2 adalah +2
Bilangan oksidasi O pada H2O2 dan BaO2 adalah -1
Bilangan oksidasi O pada KO2 adalah
9. Bilangan oksidasi beberapa logam penting dalam senyawa
nya :
Al = +3; Zn = +2; Ag = +1; Sn = +2 dan +4; Pb = +2 dan +4;
Fe = +2 dan +3; Hg = +1 dan +2; Cu = +1 dan +2; Au = +1
dan +3; Pt = +2 dan +4; Ni = +2 dan +3; Cr = +2, +3, dan +6
; Mn = +2, +3, +4, +6, dan +7; Co = +2 dan +3
138
Kimia
S O N Y
S U G E M A
C O L L E G E
LARUTAN ELEKTROLIT DAN
NON ELEKTROLIT
9.1. Gejala Hantaran Arus Listrik Pada Larutan
Larutan adalah campuran yang homogen dengan batas-batas
komponen penyusunnya tidak dapat dibedakan. Larutan ter
susun dari zat terlarut yang jumlahnya sedikit dan zat pelarut
yang jumlahnya banyak. Zat pelarut dapat berwujud cair,
sedangkan zat terlarut dapat berwujud padat, cair, atau gas.
Berdasarkan kemampuannya dalam menghantarkan arus listrik,
larutan dalam air digolongkan sebagai larutan yang dapat meng
hantarkan arus listrik (larutan elektrolit) dan larutan yang tidak
dapat menghantarkan arus listrik (larutan non elektrolit).
9.2. Larutan Elektrolit Dan Larutan Non Elektrolit
Larutan yang dapat menghantarkan arus listrik dengan alat
uji elektrolit memberikan gejala menyalanya lampu dan atau
timbulnya gelembung gas pada elektrode.
Larutan yang menunjukan gejala-gejala tersebut tergolong
larutan elektolit, sedangkan larutan yang tidak menunjukan
gejala-gejala berati tidak dapat menghantarkan arus listrik
tergolong larutan non elekroli t.
Dalam kehidupan sehari-hari banyak ditemukan contoh larutan
elektrolitdan larutan non elektrolit
contoh larutan elektrolit : larutan garam dapur, larutan cuka
makan, larutan asam sulfat (accu zuur), air laut, air sungai,
larutan kapur sirih, dan larutan tawas.
contoh larutan non elektrolit : larutan gula, larutan urea, larutan
alkohol, dan larutan glukosa.
Daya hantar listrik larutan elektrolit tergantung pada jenis dan
konsentrasinya. Larutan yang mempunyai daya hantar relatif
baik walaupun konsentrasinya relatif kecil disebut elektrolit
kuat.
Sedangkan larutan yang daya hantarnya buruk walaupun
konsentrasinya relatif besar disebut elektrolit lemah.Pada
konsentrasi yang sama larutan elektrolit kuat menghantarkan
listrik lebih baik dari pada larutan elektrolit lemah. Pada
percobaan di atas, larutan elektrolit kuat dapat membuat
Kimia
139
S O N Y
S U G E M A
C O L L E G E
lampu menyala dan ada gelembung gas sedangkan larutan
elektrolit lemah hanya menimbulkan gelembung gas pada
elektrode. Daya hantar listrik berbagai larutan disimpulkan
sebagai berikut :
Larutan
Lampu
Pada elektrode
Elektrolit
menyala
banyak gelembung gas
Elektrolit lemah tidak menyala sedikit gelembung gas
Non elektrolit
tidak menyala tidak ada gelembung gas
Contoh larutan elektrolit kuat :
Larutan NaCl, larutan H2SO4, larutan NaOH, larutan KOH,
larutan HNO3
Contoh larutan elektrolit lemah :
Larutah CH3COOH, larutan NH3, larutan HF, larutan H2S
Senyawa yang dapat menghasilkan ion dalam larutan dapat
berupa senyawa ion dan senyawa kovalen polar.
a. Senyawa Ion
Senyawa ion terdiri atas ion-ion yang terbentuk melalui
ikatan ion. Jika senyawa ion dilarutkan dalam air, maka ionion dapat bergerak bebas dan larutan dapat menghantarkan
listrik. Kristal senyawa ion tidak dapat menghantarkan listrik
karena ion dalam kristal tidak dapat bergerak bebas. Akan
tetapi, jika kristal ion itu dipanaskan hingga melelh, maka
ion-ionnya dapat bergerak bebas. Jadi lelehan senyawa ion
juga dapat menghantarkan listrik.
b. Senyawa Kovalen Polar
Senyawa kovalen adalah senyawa yang terdiri atas atom-atom
yang berikatan secara kovalen. Padatan dan lelehan senyawa
kovalen tidak dapat menghantarkan arus listrik karena molekul
kovalen tidak mengandung ion. Namun dalam bentuk larutannya
senyawa kovalen yang dapat menghantarkan arus listrik adalah
larutan senyawa kovalen polar, karena dapat diuraikan oleh
air (mengalami hidrolisis) membentuk ion. Elektrolit jenis ini
meliputi asam dan basa.
Contoh :
HCl (aq) H+ (aq) + Cl- (aq)
HNO3 (aq) H+ (aq) + NO3- (aq)
NH3(aq) + H2O (aq) NH4+ (aq) + OH- (aq)
140
Kimia
S O N Y
10
S U G E M A
C O L L E G E
KEKHASAN ATOM KARBON
10.1. Senyawa Karbon
Makhluk hidup pada umumnya terdiri dari senyawa-senyawa karbon.
Senyawa karbon itu terdapat dalam tubuh manusia, hewan, tumbuhtumbuhan, pada gas bumi dan hasil-hasil pengolahan minyak bumi.
Senyawa karbon yang berasal dari makhluk hidup disebut senyawa
organik.
Para ahli kimia mengelompokkan senyawa karbon menjadi dua, yaitu
senyawa organik dan senyawa an organik. Senyawa organik muncul
karena paham vitalisme, yaitu suatu paham yang mempercayai
bahwa organisme atau makhluk hidup seperti manusia, hewan, dan
tumbuhan mempunyai daya hidup yang memungkinkan membentuk
senyawa organik. Senyawa-senyawa kimia yang tidak berasal dari
makhluk hidup seperti batuan, mineral, dan lain sebagainya yang
diperoleh dari kulit bumi di sebut senyawa anorganik.
Friedrich Wohler (1800-1882), seorang ahli kimia bangsa Jerman
pada tahun 1828 berhasil membuat suatu bahan organik yang
dihasilkan dari bahan anorganik yaitu senyawa amonium sianat yang
dipanaskan menghasilkan urea.
NH4OCN
CO (NH2)2
Amonium sianat
urea
(zat organik)
(zat anorganik)
Dengan adanya penemuan Wohler tersebut, paham vitalisme tidak
dapat diterima lagi. Senyawa-senyawa organik hasil sintesis antara
lain karet, plastik, obat-obatan, tekstil, perstisida, nylon, alkohol,
MSG, dan cat. Senyawa karbon seperti oksida karbon (CO dan CO2)
karbonat-karbonat tergolong senyawa anorganik.
Selain unsur karbon dalam senyawa karbon adalah unsur hidrogen,
oksigen, nitrogen, halogen, belerang, fosfor, dan beberapa unsur
logam. Senyawa yang hanya terdiri atas karbon dan hidrogen saja
disebut hidrokarbon.
Kimia
141
S O N Y
S U G E M A
C O L L E G E
10.2. Jenis Atom Karbon
Kegiatan
Kekhasan atom karbon dapat dilihat dari kemampuan atom karbon
ini dalam berikatan dengan atom karbon lainnya. Setiap atom
karbon dapat mengikat empat atom lain dengan menggunakan
ikatan kovalen. Perhatikan gambar di bawah !
Atom C No. 1 = atom C primer
Atom C No. 2 = atom C sekunder
Atom C No. 3 = atom C tersier
Atom C No. 4 = atom C kuartener
10.3. Pembentukan Ikatan Karbon
A. Ikatan antar Atom Karbon dala Kristal Karbon
Atom karbon dapat berikatan kovalen dengan sesamanya sehingga
membentuk struktur kristal. Terdapat beberapa bentuk kristal
karbon, yaitu bentuk grafit, bentuk intan dan bentuk amorf.
B. Ikatan antar Atom Karbon pada Senyawa Karbon
Antar atom karbon dapat saling berikatan membentuk ikatan
tunggal, ikatan rangkap dua, dan ikatan rangkap tiga.
142
Kimia
S O N Y
11
S U G E M A
C O L L E G E
ALKANA, ALKENA, DAN ALKUNA
Pada hidro karbon, kita mengenal 3 golongan yaitu:
1. Alkana
2. Alkena
3. Alkuna
11.1 Alkana
Rumus Umum : Cn H2n+2
Alkana adalah senyawa hidrokarbon yang bersifat jenuh, artinya
semua ikatannya tunggal.
Jumlah atom C
Rumus
Nama
n=1
CH4
Metana
n=2
C2H6
Etana
n=3
C3H8
Propana
n=4
C4H10
Butana
n=5
C5H12
Pentana
n=6
C6H14
Heksana
n=7
C7H16
Heptana
n=8
C8H18
Oktana
n=9
C9H20
Nonana
n = 10
C10H22
Dekana
H
H
H
H
Gambar : Struktur Metana: CH4
Kimia
143
S O N Y
S U G E M A
C O L L E G E
11.1.1 Isomer dari Alkana
Isomer adalah senyawa-senyawa dengan rumus molekul sama, tetapi
rumus struktur berbeda.
Isomer pada alkana dimulai dari n = 4 yaitu butana C4H10.
n butana dan 2 metil propana (iso butana) merupakan isomer, karena
rumus molekulnya sama C4H10, tetapi rumus strukturnya berbeda.
Kita akan coba mencari isomer dari pentana C5H12.
Jumlah isomer dari C5H12 adalah 3
11.1.2 Gugus Alkil
Gugus Alkil adalah alkana yang kehilangan 1 atom H.
Rumus Umum : Cn H2n+1
144
Kimia
Jumlah atom C
Rumus
Nama
n=1
n=2
n=3
n=4
CH3
C2H5
C3H7
C4H9
Metil
Etil
Propil
Butil
n=5
n=6
n=7
n=8
n=9
C5H11
C6H13
C7H15
C8H17
C9H19
Pentil
Heksil
Heptil
Oktil
Nonil
S O N Y
S U G E M A
C O L L E G E
Gugus metil dan etil hanya ada sejenis, sedangkan C3H7 ada 2
bentuk yaitu:
1. CH3 CH2 CH2
2. CH3 CH
Propil
Iso Propil
CH3
Untuk C4H9 ada 4 bentuk yaitu:
1. CH3 CH2 CH2 CH2
2. CH3 CH CH2
Butil
Iso Butil
CH3
3. CH3 CH2 CH
Sekunder Butil
(Sek Butil)
CH3
CH3
Tersier Butil
(Ters Butil)
4. CH3 C
CH3
Sedangkan untuk C5H11 dan seterusnya jarang dipakai.
11.1.3 Tata Nama Alkana
Untuk memberikan nama pada alkana harus mengikuti aturan
sebagai berikut:
1. Tentukan rantai karbon yang paling panjang (disebut rantai
utama).
2. Atom C yang tidak terletak pada rantai utama (disebut cabang)
merupakan gugus alkil.
3. Penomoran dimulai dari atom C yang paling dekat dengan
cabang.
Contoh:
1
CH3
CH
CH2
CH2
CH3
CH3
Rantai utama
cabang
Nomor dimulai dari kiri karena dekat dengan cabang
Kimia
145
S O N Y
S U G E M A
C O L L E G E
Ingat !
1. Bila cabang lebih dari satu, tetapi sejenis, memakai awalan: di
(2), tri (3), dan seterusnya.
Bila cabang lebih dari satu dan tidak sejenis, boleh diurutkan
berdasarkan abjad: etil, metil, dan seterusnya.
Contoh:
1
6
CH3
5
CH2
CH3
3
4
C
CH2
CH3
1
CH3
2
CH
Rantai utama
CH2
CH3
4 Etil 2,4 Dimetil Heksana
Nomor dimulai dari kanan karena dekat dengan cabang
2
1
CH3
2
CH2
CH3
4
3
C
CH2
5
CH
CH3
CH2
CH3
6
CH3 7
Rantai utama
3,3,5 Trimetil Heptana
Nomor dimulai dari kanan karena dekat dengan cabang
11.1.4 Sifat-sifat Alkana
1. Pada suhu kamar alkana yang mempunyai atom:
C1 sampai dengan C4 berbentuk gas
C5 sampai dengan C17 berbentuk cair, dan
C18 ke atas berbentuk padat.
2. Semakin panjang rantai karbon, maka titik lebur dan titik didih
semakin tinggi.
146
Kimia
Nama
Rumus
Titik Lebur
Titik Didih
Metana
Etana
Propana
Butana
Pentana
CH4
C2H6
C3H8
C4H10
C5H12
182,6
172,0
187,1
135,0
129,7
161,7
88,0
42,2
0,5
+36,1
S O N Y
S U G E M A
C O L L E G E
3. Semakin banyak cabang titik didih senyawa, semakin rendah
4. Alkana sebagai senyawa non polar tidak larut dan tidak ber
campur dengan air, tetapi mudah larut dalam pelarut organik
seperti: eter, aseton, dan kloroform.
5. Jika alkana direaksikan dengan unsur-unsur Halogen (F2, Cl2,
Br2, atau I2) atom-atom H pada alkana mudah mengalami
substitusi (penukaran) oleh atom-atom halogen.
Contoh: CH4 + Cl2 CH3 +HCl
6. Alkana dapat mengalami oksidasi dengan oksigen dan reaksi
pembakaran ini selalu menghasilkan energi. Itulah sebabnya
alkana banyak digunakan sebagai bahan bakar.
11.2 Alkena
Rumus Umum : Cn H2n
Alkena adalah senyawa hidro karbon yang mengandung sebuah
ikatan rangkap dua sehingga alkena bersifat tak jenuh.
Jumlah atom C
Rumus
Nama
n=2
n=3
n=4
n=5
n=6
n=7
n=8
n=9
n =10
C2H4
C3H6
C4H8
C5H10
C6H12
C7H14
C8H16
C9H18
C10H20
Etena
Propena
Butena
Pentena
Heksena
Heptena
Oktena
Nonena
Decena
Kimia
147
S O N Y
1120
C
S U G E M A
C O L L E G E
H
H
C 1180
H H
2
Gambar : Struktur molekul etana dan propena
11.2.1 Tata Nama Alkena
Aturan tata nama alkena adalah sebagai berikut:
1. Dalam penentuan rantai utama atom karbon yang berikatan
rangkap harus terbawa
2. Penomoran dimulai dari atom C yang dekat ikatan rangkap
3. Aturan lainnya sama dengan alkana
Contoh :
1. 6
CH3
CH
CH2
CH
CH2
CH3
1
CH3
Rantai utama
5 metil 2 heksana
Nomor dimulai dari kanan karena dekat dengan ikatan rangkap
dan bukan dari sebelah kiri walaupun dekat dengan cabang.
2.
CH3
CH
CH
CH
CH2
6
CH3
Rantai utama
CH3
2 metil 3 heksena
Nomor dimulai dari kiri karena dekat dengan cabang dan ikatan
rangkapnya terletak di tengah.
3.
CH3
CH2
4
CH3
Rantai utama
CH2
CH3
2 etil 3 butena
Rantai utama harus terbawa atom C yang berikatan rangkap dua.
148
Kimia
S O N Y
S U G E M A
C O L L E G E
11.2.2 Isomer-isomer Alkena
Dalam menentukan isomer pada alkena ada 2 hal yang harus diingat,
yaitu:
1. Memindahkan posisi ikatan rangkapnya.
2. Memindahkan letak dari atom C
Isomer pada alkena dimulai pada butena C4H8 ada sebanyak :
Isomer pada pentena C5H10 ada sebanyak :
Sekarang kamu coba mencari isomer dari heksena C6H12 harus ada 13.
11.2.3 Sifat-sifat Alkena
1. Sifat fisinya (wujud pada suhu kamar, titik didih, dan titik leleh)
sama dengan alkana.
2. Reaksi-reaksi pada alkena:
Alkena dapat mengalami adisi
Adisi adalah reaksi perubahan ikatan rangkap menjadi
ikatan tunggal (dari ikatan tidak jenuh menjadi jenuh)
dengan cara menangkap atom-atom lain.
Kimia
149
S O N Y
C O L L E G E
Bila yang ditangkap H2, gas F2, gas Cl2, Br2, dan I2, maka
reaksinya adalah :
Bila yang ditangkap asam-asam Halida (HF, HCl, HBr,
dan HI), maka harus mengikuti aturan Markonikov
(yang kaya atom H akan bertambah kaya).
Contoh :
S U G E M A
Alkena dapat mengalami polimerisasi
Polimerisasi ialah penggabungan molekul-molekul sejenis
sehingga berantai karbon sangat panjang.
Molekul sejenis yang bergabung disebut monomer sedang
kan molekul raksasa yang terbentuk disebut polimer.
Contoh:
Plastik adalah polimer dari alkena atau turunan-turunan
alkena.
Tabel beberapa jenis plastik
150
Kimia
S O N Y
S U G E M A
C O L L E G E
11.3 Alkuna
Rumus Umum : Cn H2n-2
Alkuna adalah senyawa hidro karbon yang mengandung sebuah
ikatan rangkap tiga sehingga alkuna bersifat tak jenuh.
Jumlah atom C
Rumus
Nama
n=2
n=3
n=4
n=5
n=6
n=7
n=8
n=9
n =10
C2H2
C3H4
C4H6
C5H8
C6H10
C7H12
C8H14
C9H16
C10H18
Etuna
Propuna
Butuna
Pentuna
Heksuna
Heptuna
Oktuna
Nonuna
Decuna
Ingat ! alkuna dimulai dari n = 2.
Tata nama alkuna sama dengan dengan aturan pada alkena.
Contoh:
1.
5
CH3
4
CH2
3
CH
2
C
1
CH
Rantai utama
CH3
3 metil 1 pentuna
2.
1
CH3
2
C
3
C
4
CH
5
CH2
CH3
6
CH
CH3
CH2
CH3
Rantai utama
4,6 dimetil 2 Oktuna
Isomer pada Alkuna
Isomer pada alkuna sama dengan alkena yaitu ada 2 cara:
1. Memindahkan posisi ikatan rangkap
2. Memindahkan letak dari atom C
Kimia
151
S O N Y
S U G E M A
C O L L E G E
Isomer pada Alkuna dimulai dari Butuna C4H6 ada sebanyak :
1. CH C CH2 CH3
1 butuna
2. CH3 C C CH3
2 butuna
Kita coba mencari isomer dari C5H8 ada sebanyak :
1. CH C CH2 CH2 CH3
1 pentuna
2. CH3 C C CH2 CH3
2 pentuna
3. CH C CH2 CH3
3 metil 1 butuna
CH3
11.3.2 Asetilena
Asetilena nama lain dari etuna. Asetilena adalah alkuna yang
terpenting karena Asetilena merupakan gas yang jika dibakar
menghasilkan suhu tinggi. Itulah sebabnya api yang timbul sering
dipakai pada proses pengelasan logam-logam.
Gas Asetilena diperoleh dari reaksi Kalsium karbida (Karbid) dengan
air.
CaC2 + 2H2O C2H2 + Ca(OH)2
Karbid
Air
Asetilena
Air kapur
11.4 Alkadiena
Rumus Umum : Cn H2n=2
Alkadiena adalah suatu senyawa hidro karbon yang mempunyai 2
buah ikatan rangkap dua.
Alkadiena mempunyai rumus umum yang sama dengan alkuna,
oleh karena itu alkuna dan alkadiena adalah isomer.
Contoh:
152
1. CH2 = C = CH CH3
1,2 butadiena
2. CH2 = CH = CH CH3
2 butadiena
Kimia
S O N Y
S U G E M A
C O L L E G E
Latihan Soal-soal
1. Alkana yang tidak mengandung lima atom karbon adalah....
a. n-pentana
b. 2-metil+butana
c. isopentana
d. 2-metilpentana
e. 2,2-dimetilpropana
2. Senyawa manakah di bawah ini yang mempunyai titik didih
paling tinggi?
3. Nama yang tepat untuk senyawa :
adalah....
a. 2,5-dietil-3-metilheksana
b. 2-etil-4,5-dimetilheptana
c. 6-etil-3,4- dimetilheptana
d. 3,4,6-trimetiloktana
e. 3,5,6-trimetiloktana
4. Pada senyawa 2,3-dimetilpentana terdapat....
a. 2 atom C primer, 1 atom C sekunder, dan 4 atom C tersier
b. 3 atom C primer, 1 atom C sekunder, dan 3 atom C tersier
c. 3 atom C primer, 2 atom C sekunder, dan 2 atom C tersier
d. 4 atom C primer, 1 atom C sekunder, dan 2 atom C tersier
e. 4 atom C primer, 2 atom C sekunder, dan 1 atom C tersier
Kimia
153
S O N Y
S U G E M A
C O L L E G E
5. Pada senyawa 2,2-dimetilpropana terdapat ikatan C H sebanyak
....
a. 8
c. 10
e. 12
b. 9
d. 11
6. 15 gram suatu alkana pada pembakaran sempurna meng
hasilkan 44 grsm CO2 dan 27 gram air (C = 12, H = 1, dan O =
16). Alkana tersebut adalah ....
a. etana
c. butana
e.
heksana
b. propana
d. pentana
7. Nama senyawa:
adalah....
a. 3,5-diisopropilheptana
b. 3,5-dietil-2,6-dimetilheptana
c. 3,5-dietil-2,6,6-trimetilheksana
d. 3-etil-2-metil-5-isopropilheptana
e. 5-etil-6-metil-3-isopropilheptana
8. Jumlah isomer dari senyawa C5H10 adalah....
a. 2
c. 4
e. 6
b. 3
d. 5
9. Nama yang benar untuk senyawa dengan rumus bangun berikut :
adalah....
a. 4-metil-2etil-5-propilheksana
b. 3-propil-4,6-dimetiloktana
c. 3,5-dimetil-5-propiloktana
d. 3-etil-2,4,6-trimetiloktana
e. 3-isopropil-4,6-dimetiloktana
10. Nama yang tidak sesuai dengan tata nama IUPAC adalah....
a. 3-etil-2-metilheksana
b. 2-etiloktana
c. 3,4-dimetilheptana
154
Kimia
S O N Y
S U G E M A
C O L L E G E
d. 2-metilpentana
e. 1-metilbutana
11. Yang bukan merupakan sifat alkana yaitu....
a. banyak terdapat di dalam minyak bumi
b. larut dalam air dengan baik
c. seluruh ikatannya jenuh
d. atom Hnya dapat disubstitusi oleh halogen
e. dapat dibuat dari senyawa grignard
12. Nama senyawa:
13.
14.
15.
16.
17.
adalah....
a. 2-etil-2-butena
b. 3-etil-2-butena
c. 3-metil-2-pentana
d. 3-metil-3-pentana
e. 2-venilbutan
Hasil adisi HCl terhadap 2-etil-1-butena adalah....
a. 3-kloro-3-metilpentana
b. 2-kloro-2-metilpentana
c. 3-kloro-3-etilbutana
d. 2-kloro-3-etilbutana
e. 1-kloro-2-etilbutana
Alkana yang tidak dihasilkan dari adisi alkena adalah....
a. metana
d. butana
b. etana
e. pentana
c. propana
Plastik PVC merupakan hasil polimerisasi dari....
a. CH2 = CH2
d. CH2 = CHCl
b. CHCl = CHCl
e. CHCl = CCl2
c. CH2 = CCl2
Pada STP, 28 dm3 suatu alkena yang berwujud gas mempunyai
massa 70 gram (C = 12 dan H = 1). Alkena tersebut adalah...
a. etana
d. pentena
b. propena
e. heksena
c. butena
Senyawa berikut yang merupakan hidrokarbon tidak jenuh
adalah....
a. C3H8
d. C3H6
b. C2H6
e. C5H12
c. C4H10
Kimia
155
S O N Y
S U G E M A
C O L L E G E
18. Gas asetilena termasuk deret....
a. alkena
d. alkdiena
b. alkuna
e. hidro karbon jenuh
c. alkana
19. Karet alam merupakan polimer dari....
a. etena
d. butadiena
b. venilklorida
e. isoprena
c. propena
20. Untuk memperoleh 56 liter gas asetilena pada STP, massa
kalsium karbida CaC2 yang harus direaksikan (Ca = 40 dan C = 12)
adalah... gram.
a. 80
d. 192
b. 128
e. 240
c. 160
12
MINYAK BUMI
Minyak bumi terbentuk dari proses pelapukan dari tumbuh-tumbuhan
mikroskopis dan makroorganisme selama berjuta-juta tahun.
Minyak bumi tersusun dari bermacam-macam hidro karbon, ada yang
berantai lurus, bercabang, bersifat jenuh, dan tidak jenuh.
Namun demikian, penyusun utama dari minyak bumi adalah senyawa
alkana.
Gambar : Minyak tanah (minyak bumi yang belum diolah dan gas alam
terjebak di antara lapisan batuan.
156
Kimia
S O N Y
S U G E M A
C O L L E G E
12.1 Pengolahan Minyak Bumi
Minyak bumi dipisahkan menjadi fraksi-fraksi melalui proses
destilasi karena masing-masing fraksi mempunyai titik didih yang
berbeda.
Tabel fraksi-fraksi hasil penyulingan minyak bumi
Gambar: Proses destilasi minyak tanah
Kimia
157
S O N Y
S U G E M A
C O L L E G E
Petroleum, eter, bensin, kerosin, dan solar termasuk kelompok
destilat (cairan hasil destilasi) sedangkan minyak pelumas, vaselin,
dan aspal, termasuk kelompok residu (padatan sisa destilasi).
11.2 Bensin
Bensin merupakan salah satu hasil penyulingan bertingkat dari minyak
bumi.
Bensin adalah campuran isomer-isomer heptana (C7H16) dan oktana
(C8H18).
Mutu bensin ditentukan oleh bilangan oktananya yaitu prosentase
isooktana dalam bensin itu. Bensin dengan bilangan oktan rendah
mempunyai mutu yang kurang baik, karena pada pembakarannya
terjadi ketukan (knocking) pada mesin. Untuk meningkatkan
bilangan oktan ke dalam bensin ditambahkan tetra etil timbal
atau disebut juga tetra ethyl lead (= TEL) suatu zat yang mampu
mempercepat pembakaran bensin agar efesiensinya maksimum.
Akan tetapi, pemakaian TEL ini memberikan dampak negatif yaitu
pencemaran udara oleh logam Pb yang bila terhisap terus menerus
oleh manusia dapat mengganggu sistem syaraf.
Dewasa ini sebagai pengganti TEL digunakan MTBE (metil tersier
butil eter).
Bensin berat adalah nafta, yaitu fraksi minyak bumi yang diperoleh
sebagai destilat. Pada suhu 1400C 1800C, banyak digunakan
sebagai bahan baku pada proses pembuatan etilena dan senyawasenyawa aromatik.
Penggunaan bensin sebagai bahan bakar motor harus dibatasi
karena dapat merusak lingkungan, yaitu pada pembakarannya
akan menghasilkan gas buangan seperti :
1. Gas CO2 : membuat suhu bumi semakin panas (efek rumah
kaca)
2. Gas CO : sangat mudah diikat oleh haemoglobin darah dari pada
gas oksigen sehingga dapat menyebabkan kematian karena ke
kurangan gas O2.
3. Gas Oksida belerang : dapat menyebabkan hujan asam.
4. Gas Oksida nitrogen : dapat menimbulkan asbut.
158
Kimia
S O N Y
S U G E M A
C O L L E G E
Soal-soal Latihan
1. Senyawa berikut merupakan penyusun minyak bumi kecuali....
a. normal heptana
b. iso oktana
c. metil siklo pentana
d. benzena
e. propena
2. Fraksi minyak bumi yang dihasilkan pada suhu antara 1400
1800 C adalah....
a. bensin premium
b. bensin super
c. bensin ringan
d. avtur
e. soalr
3. Fraksi minyak bumi yang digunakan sebagai bahan bakar
dengan bilangan oktan tinggi adalah....
a. kerosin
b. residu
c. bensin
d. solar
e. nafta
4. Hasil pengolahan minyak bumi yang digunakan dalam pengeras
an jalan adalah....
a. nafta
b. kerosin
c. bensin
d. aspal
e. lilin
5. Zat yang digunakan untuk menaikkan mutu bensin, maka bensin
harus ditambahkan....
a. n-heptana
b. isooktana
c. pentana
d. tetra ethyl lead
e. butana
6. Pemisahan fraksi-fraksi minyak bumi dilakukan berdasarkan
perbedaan....
a. titik didih
b. ikatan kimia
c. massa molekul
Kimia
159
S O N Y
7.
8.
9.
10.
11.
12.
160
Kimia
S U G E M A
C O L L E G E
d. reaksi adisi
e. berat jenis
Yang tidak termasuk minyak bumi adalah....
a. minyak tanah
b. solar
c. bensin
d. nafta
e. minyak atsiri
Hasil sulingan (destilat) minyak bumi yang memiliki titik didih
paling tinggi adalah....
a. bensin
b. solar
c. residu
d. kerosin
e. nafta
Bensin premium mempunyai nilai oktan....
a. 60 75
b. 70 80
c. 80 85
d. 85 98
e. 98 100
Manakah fraksi minyak bumi di bawah ini yang tersusun menurut
kenaikan titik didih?
a. solar, kerosin, bensin
b. bensin, solar, kerosin
c. kerosin, bensin, solar
d. bensin, kerosin, solar
e. solar, bensin, kerosin
Manakah di bawah ini yang bukan komponen bensin?
a. 2,3-dimetilheksana
b. 2-metilheksana
c. 2-metilheptana
d. 2,3-dimetilbutana
e. 2,2,4-trimetilpentana
Mesin kendaraan bermotor jangan dihidupkan dalam ruangan
tertutup, karena salah satu gas hasil pembakaran bensin bersifat
racun yaitu....
a. NO2
b. CO
c. NO
S O N Y
13.
14.
15.
16.
17.
S U G E M A
C O L L E G E
d. H2O
e. CO2
Logam pencemar udara yang dihasilkan dari pembakaran bensin
adalah....
a. Sn
b. Ni
c. Pb
d. Fe
e. Hg
Kadar CO di udara yang masih aman (belum membahayakan)
jika dihisap adalah....
a. di bawah 100 ppm
b. 100 200 ppm
c. 200 250 ppm
d. 250 500 ppm
e. 500 1000 ppm
PVC merupakan plastik hasil polimer dari....
a. etilklorida
b. propilklorida
c. vinilklorida
d. butilklorida
e. alilklorida
Penggabungan suatu molekul yang sejenis membentuk molekul
yang rantai karbonnya sangat panjang disebut dengan reaksi....
a. polimerisasi
b. substitusi
c. sublimasi
d. adisi
e. dehidrasi
Pembakaran sempurna 7,2 gram suatu senyawa hidrokarbon
menghasilkan 32,8 gram karbon dioksida dan air. Rumus molekul
senyawa tersebut yaitu....
a. C2H4
b. C3H8
c. C3H6
d. C3H4
e. C2H6
Kimia
161
S O N Y
S U G E M A
C O L L E G E
18. Pemisahan fraksi-fraksi penyusun minyak bumi dilakukan dengan
cara....
a. filtrasi
b. kristalisasi
c. destilasi
d. flotasi
e. kromatografi
19. Unsur-unsur berikut terdapat di dalam minyak bumi kecuali....
a. C
b. O
c. S
d. Mg
e. N
20. Fraksi minyak bumi yang diperoleh pada suhu antara 400 1500C
adalah....
a. gas alam
b. bensin
c. minyak tanah
d. parafin
e. aspal
162
Kimia
Anda mungkin juga menyukai
- Draft Jumantik)Dokumen1 halamanDraft Jumantik)Erika SandraBelum ada peringkat
- Sudden DeafnessDokumen23 halamanSudden DeafnessErika SandraBelum ada peringkat
- Hepatitis C Pada AnakDokumen5 halamanHepatitis C Pada AnakErika SandraBelum ada peringkat
- Selulitis Periorbital: PengantarDokumen4 halamanSelulitis Periorbital: PengantarErika SandraBelum ada peringkat
- CASE Depresi Dengan Gejala PsikotikDokumen38 halamanCASE Depresi Dengan Gejala PsikotikErika SandraBelum ada peringkat
- Panduan Skill Lab Radiologi - FaiDokumen21 halamanPanduan Skill Lab Radiologi - FaiErika SandraBelum ada peringkat
- Journal HiperkoagulasiDokumen12 halamanJournal HiperkoagulasiErika SandraBelum ada peringkat
- Jamur TempeDokumen3 halamanJamur TempeErika SandraBelum ada peringkat
- VSDDokumen5 halamanVSDErika SandraBelum ada peringkat