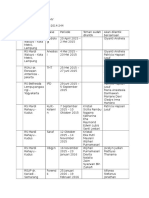
Ketuban Pecah Dini
Diunggah oleh
Christian HasiholanHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Ketuban Pecah Dini
Diunggah oleh
Christian HasiholanHak Cipta:
Format Tersedia
Tinjauan Pustaka Christian HasiholanTmanern
Ketuban Pecah Dini
Ketuban pecah dini (KPD) merujuk pada pasien dengan usia kehamilan diatas 37
minggu dan mengalami pecah ketuban sebelum dimulainya proses persalinan. Ketuban pecah
dini preterm (KPDP) adalah pecahnya ketuban sebelum usia kehamilan 37 minggu. Ketuban
pecah dini spontan adalah pecahnya ketuban setelah atau dengan dimulainya persalinan. KPD
memanjang adalah pecahnya ketuban yang terjadi lebih dari 24 jam dan sebelum dimulainya
proses persalinan.
Membran yang mengelilingi kavum amniotik terdiri dari amnion dan korion, yang
merupakan lapisan yang melekat yang mengandung berbagai tipe sel, termasuk sel epitel, sel
mesenkim, dan sel trofoblas, tertanam dalam matriks kolagen. Membran ini mempertahankan
cairan amnion, mensekresikan substansi baik ke dalam cairan amnion maupun ke uterus, dan
melindungi janin dari infeksi yang melibatkan saluran reproduksi. Pada usia kehamilan
aterm, 8-10% wanita hamil mengalami ketuban pecah dini, dan para wanita ini memiliki
risiko infeksi intrauteri yang meningkat bila interval antara pecah ketuban dan pelahiran
semakin lama.1 KPDP terjadi pada kira-kira 1% dari seluruh kehamilan dan berkaitan dengan
30-40% kelahiran prematur. Hal ini kemudian menjadi penyebab utama yang teridentifikasi
dari kelahiran prematur dan komplikasinya, termasuk sindroma distress pernapasan, infeksi
neonatus, dan perdarahan intraventrikular.
Setelah ketuban pecah dini aterm, 70% kasus memulai persalinan dalam 24 jam, dan
95% dalam 72 jam.9,10 Pada kasus ketuban pecah dini preterm, periode laten sejak pecahnya
ketuban hingga persalinan menurun, berbanding terbalik dengan bertambahnya usia
kehamilan. Misalnya, pada 20-26 minggu kehamilan, rerata periode laten adalah 12 hari;
sedangkan pada 32-34 minggu, hanya 4 hari.
Selaput ketuban manusia terdiri dari lima lapisan terpisah (Gbr. 1), tidak mengandung
pembuluh darah atau saraf, dan nutrisi yang dibutuhkan olehnya dipenuhi oleh cairan amnion.
Rata-rata ketebalan selaput ketuban setelah pelepasan dari dinding uterus adalah sekitar 200-
Tinjauan Pustaka Christian HasiholanTmanern
Gambar 1. Representasi skematik struktur selaput ketuban aterm. Diperlihatkan Komposisi matriks
ekstraselular dari masing-masing lapisan dan tempat produksi matriks metalloproteinase (MMP) dan
metalloproteinase inhibitor jaringan (Tissue Inhibitor of MetalloproteinaseTIMP).
300m, namun karena edema lokal mesoderm amnion, kadang terlihat selaput ketuban yang
lebih tebal. Setelah lahir, lapisan-lapisan berikut dapat dilihat secara histologis (Gbr.2):
- Amnion
o Epitel amnion (20-30m)
o Mesoderm amnion (15-30m)
Lamina basalis atau membran basal
Lapisan stroma kompakta
Lapisan fibroblas
Lapisan spongiosum intermediat (tebal bervariasi)
- Lapisan spongiosum intermediat (tebal bervariasi)
Tinjauan Pustaka Christian HasiholanTmanern
Gambar 2. Lapisan-lapisan selaput ketuban janin.
- Chorion laeve
o mesoderm korionik (15-20m)
pembuluh darah
lamina basalis atau membran basal
- Trofoblas (10-50m)
- Desidua kapsularis (hingga 50m)
Lapisan paling dalam, yang terdekat dengan janin, adalah epitel amnion. Sel epitel
amnion mensekresikan kolagen tipe III dan IV dan glikoprotein non kolagen (laminin,
nidogen, dan fibronektin) yang membentuk membran basal, lapisan berikutnya dari amnion.
Lapisan padat jaringan ikat yang dekat dengan membran basal membentuk kerangka
fibrosa utama amnion. Kolagen lapisan padat tersebut disekresikan oleh sel mesenkim pada
lapisan fibroblas. Kolagen interstisial (tipe I dan III) predominan dan membentuk ikatan
parallel yang mempertahankan integritas mekanik amnion. Kolagen tipe V dan VI
membentuk penghubung filamentosa antara kolagen interstisial dan membran basal epitel.
Tidak ada penempatan substansi dasar amorf antara fibril kolagen dalam jaringan ikat amnion
aterm, sehingga amnion mempertahankan daya regangnya sepanjang tahap akhir kehamilan
normal.
Tinjauan Pustaka Christian HasiholanTmanern
Lapisan fibroblast adalah lapisan yang paling tebal diantara lapisan amnion,
mengandung sel-sel mesenkim dan makrofag dalam suatu matriks ekstraselular. Kolagen
pada
lapisan
ini
membentuk
jaringan
longgar
dengan
pulau-pulau
glikoprotein
nonkolagen.10,16
Lapisan intermediat (lapisan spons, atau zona spongiosa) terletak di antara amnion
dan korion. Kandungan yang melimpah dari proteoglikan terhidrasi dan glikoprotein
memberikan sifat "kenyal" lapisan ini dalampreparat histologis, dan mengandung jaringan
nonfibrillar sebagian besar kolagen tipe III. Lapisan intermediat menyerap tekanan fisik
dengan membuat amnion bergeser di korion dasarnya, yang melekat kuat pada desidua
maternal.
Walaupun korion lebih tebal dari pada amnion, amnion memiliki daya regang yang
Gambar 3. Preparat histologi pewarnaan hematoxylin dan eosin (H&E) membran korioamnion
dari kehamilan 39 minggu yang dilahirkan dengan repeat seksio sesaria sebelum dimulainya proses
persalinan. Pembesaran 200x
lebih besar. Korion menyerupai membran epitel tipikal, dengan polaritasnya yang mengarah
ke desidua maternal. Dengan pertumbuhan kehamilan, vili trofoblas dalam lapisan korion
dari refleksi membran janin (bebas plasenta) berkurang. Di bawah lapisan sitotrofoblas (lebih
dekat ke janin) adalah membran basal dan jaringan ikat korionik, yang kaya akan fibril
kolagen.
Kolagen tipe IV, V, dan VII menciptakan sebuah substrat, yang tidak hanya penting
bagi integritas struktur dari membran, tapi juga untuk penyembuhan luka dan pertumbuhan
sel. Sudah jelas bukti bahwa banyak dari molekul-molekul ini berinteraksi satu sama lain di
suatu milieu yang sangat kompleks dari bio-regulasi yang memerlukan adanya membran,
Tinjauan Pustaka Christian HasiholanTmanern
pertumbuhan faktor individu, interaksi dan up-regulasi dan down-regulasi berbagai proses
penyembuhan. Metalloproteinase contohnya, harus seimbang dengan Tissue Inhibitor of
Metalloproteinases (TIMPS); faktor pertumbuhan, seperti fibroblas. Fibroblas berfungsi
untuk membentuk lapisan yang memperkuat jaringan. Sel-sel epitel secara biologis aktif
dalam proses penyembuhan yang memiliki reseptor pada permukaannya.
Regenerasi biomolekul memegang peranan penting dalam penyembuhan dan faktor
pertumbuhan yang terkonsentrasi di dalam selaput ketuban. Hal ini termasuk faktor
pertumbuhan epidermis, Transforming Growth Factor (TGF), faktor pertumbuhan fibroblas,
platelet-derived growth factors, metalloproteinase dan TIMP.
1.2 Mekanisme pecah ketuban sebelum dan selama persalinan
Pecahnya selaput ketuban intrapartum terjadi disebabkan perlemahan keseluruhan
karena kontraksi uterus dan peregangan yang berulang. Daya regang selaput berkurang pada
spesimen yang diambil setelah persalinan dibandingkan dengan spesimen yang diperoleh
setelah persalinan dengan operasi sesar tanpa proses persalinan. Perlemahan keseluruhan
selaput ketuban sulit ditentukan bila KPD dibandingkan dengan selaput yang dipecahkan
dalam proses persalinan. Namun selaput yang pecah prematur, tampaknya disebabkan
terdapatnya defek fokal daripada perlemahan keseluruhan. Area sekitar lokasi ruptur
digambarkan sebagai zona terlarang perubahan morfologi ekstrim yang ditandai oleh
pembengkakan nyata dan gangguan jaringan fibril kolagen didalam lapisan padat (kompakta),
fibroblas dan spongiosa. Karena zona ini tidak termasuk seluruh lokasi ruptur, zona ini dapat
timbul sebelum pecahnya ketuban dan menunjukkan titik pecah awal.
Meskipun karakteristik KPDP berbeda dengan pecah ketuban intrapartum, ada sedikit
bukti yang menunjukkan bahwa mekanisme yang mempredisposisi para wanita dengan KPD
tidak identik dengan mekanisme yang biasanya mendahului persalinan. Hal ini telah
memberikan pandangan bahwa KPD mempercepat atau mempresipitasi berlebihan proses
pecah spontan selaput ketuban selama persalinan
1.1.1 Tekanan barometer
Telah diketahui bahwa perubahan tekanan barometer dapat mempercepat pecahnya
selaput ketuban. Literatur yang mendukung hal ini masih terbagi. Milingos dkk. menemukan
korelasi signifikan antara tekanan barometrik dan KPD (r=0.44, p<0.05) pada hampir 1600
kasus yang diulas. Polansky dkk. selanjutnya menunjukkan hubungan signifikan antara
Tinjauan Pustaka Christian HasiholanTmanern
insidensi KPD dan penurunan tekanan barometer 3 jam sebelumnya (p=0.006) pada serial
109 pasien mereka. Di sisi lain, Marks dkk. tidak dapat menunjukkan hubungan statistik
antara tekanan barometer atau fase bulan dengan KPD pada serial 117 pasien mereka. Efek
tekanan barometer pada pecahnya ketuban tetap menjadi subyek kontroversial, dan apakah
efek ini berkontribusi pada KPDP masih diselidiki.
1.1.2. Metabolisme kolagen
Pada tahun 1995, Draper dkk., melaporkan penemuan mengenai peningkatan aktivitas
protease pada selaput ketuban wanita yang mengalami KPDP dibandingkan dengan merekan
yang melahirkan bayi prematur tanpa KPD. Pada studi penting ini, tercatat bahwa satusatunya inhibitor protease yang efektif adalah asam etilendiamintetrasetik, mengesankan ini
adalah metalloproteinase (MMP). MMP adalah enzim zinc-dependent yang mendegradasi
komponen matriks ekstraselular, seperti kolagen, glikoprotein, dan proteoglikan. Enzimenzim ini disekresikan sebagai proenzim inaktif dan aktivitasnya tetap dikendalikan oleh
inhibitor yang disebut tissue inhibitors of metalloproteinase (TIMP). MMP diklasifikasikan
menurut spesifisitas substrat. Yang termasuk kolagenase adalah MMP-1 dan MMP-8, yang
mendegradasikan kolagen tipe I, II, dan III. Yang termasuk gelatinase adalah MMP-2 dan
MMP-9,yang mendegradasi kolagen denaturasi, kolagen tipe IV dan V. Yang termasuk
stromalisin adalah MMP-3, MMP-7, dan MMP-10, yang mendegradasi proteoglikan,
fibronektin, dan komponen stromal lain.
Pada tahun 1996, Vadillo-Ortega dkk., membandingkan cairan amnion dari empat
kelompok pasien: (1) wanita dengan persalinan normal aterm, (2) wanita aterm belum
inpartu, (3) kehamilan preterm pada saat studi genetik, dan (4) pasien KPDP. Wanita aterm
inpartu dan wanita dengan KPDP memiliki kadar aktivitas gelatinolitik yang lebih tinggi
dalam cairan amnionnya. Kebanyakan aktivitas ini memiliki karakteristik disebabkan oleh
MMP-9. Para penulis kemudian mengukur konsentrasi inhibitor MMP-9, tissue inhibitor of
metalloproteinase-1 pada sampel yang sama dan menemukan bahwa sampel preterm dari
pasien yang menjalani amniosentesa genetik mengandung kadar yang tertinggi, sedangkan
sampel dari pasien KPDP mengandung kadar terendah. Para peneliti mencatat bahwa
penelitian mengenai MMP-1 sama menariknya seperti pemecah kolagen fibril tipe 1. Mereka
mencatat bahwa aktivitas ini tidak terdeteksi dalam cairan amnion karena MMP-1 terikat kuat
pada matriks ekstraselular amniokorion. Temuan mengenai peningkatan MMP-9 dan
bukannya MMP-1 dalam cairan amnion pada wanita KPDP selanjutnya dikonfirmasi dengan
penelitian oleh Athayde dkk. Juga terdapat regionalisasi perubahan tipe dan kandungan
Tinjauan Pustaka Christian HasiholanTmanern
kolagen. Konsentrasi MMP-9 yang lebih tinggi ditunjukkan pada selaput yang dekat dengan
serviks daripada selaput di daerah tengah pada pasien aterm baik sebelum dan sesudah
dimulainya persalinan. MMP-9mendegradasi kolagen tipe V, yang terlihat menurun pada
KPDP. Kejadian yang menyebabkan hal ini belum diketahui, namun terdapat beberapa bukti
yang mengaitkannya pada infeksi. Seperti diketahui sebelumnya, terdapat hubungan jelas
antara infeksi dengan KPDP. Protease yang diproduksi bakteri dapat merubah kekuatan
membran, atau secara alternatif mungkin merupakan derivate lekosit yang diaktivasi sebagai
respon invasi bakteri. Ditunjukkan pula bahwa MMP-7, yang dihasilkan makrofag,
meningkat dengan invasi mikroba preterm ke kavum amnion. MMP-7 juga ditunjukkan dapat
mengaktivasi bentuk proenzim MMP lain, dengan efek kaskade.
1.1.3. Perubahan kandungan kolagen, struktur, katabolisme, dan faktor klinis yang
berkaitan.
Pemeliharaan daya regang selaput ketuban sepertinya melibatkan keseimbangan
antara sintesa dan degradasi komponen matriks ekstraselular. Diduga bahwa perubahan dalam
membran, termasuk berkurangnya kandungan kolagen, perubahan struktur kolagen dan
aktivitas kolagenolitik yang meningkat, berhubungan dengan ketuban pecah dini.Terdapat
bukti tidak langsung bahwa infeksi traktus genitalia mempercepat pecah ketuban pada
manusia dan hewan. Identifikasi mikroorganisme patologis pada flora vagina manusia segera
setelah pecah ketuban mendukung konsep bahwa infeksi bakteri mungkin berperan pada
patogenesa KPD. Data epidemiologi menunjukkan hubungan antara kolonisasi traktus
genitalia oleh streptokokus grup B, Chlamydia trachomatis, Neisseria gonorrhoeae, dan
mikroorganisme yang menyebabkan bakterial vaginosis (anaerob vagina, Gardnerella
vaginalis, spesies mobiluncus, dan mycoplasma genital) dan suatu peningkatan risiko KPDP.
Terlebih lagi, pada beberapa studi penatalaksanaan wanita terinfeksi dengan antibiotik
menurunkan angka KPDP.
Progesterone dan estradiol menekan remodeling matriks ekstraselular pada jaringan
reproduksi. Relaksin, suatu hormon protein yang meregulasi remodeling jaringan ikat,
diproduksi lokal pada plasenta dan desidua dan membalikkan efek inhibisi estradiol dan
progesterone dengan meningkatkan aktivitas MMP-3 dan MMP-9 pada selaput ketuban.
Walaupun penting untuk mempertimbangkan peran estrogen, progesteron, dan relaksin pada
proses reproduksi, keterlibatannya pada proses pecah ketuban perlu dijelaskan.
Tinjauan Pustaka Christian HasiholanTmanern
Amnion dan korion manusia yang diperoleh setelah KPD aterm mengandung banyak
sel apoptosis pada daerah yang dekat dengan lokasi ruptur dan sedikit sel apoptosis di daerah
lainnya. Pada kasus-kasus korioamnionitis, sel epitel amnion apoptotik terlihat pada
persambungan dengan granulosit pelekat, menunjukkan bahwa respon imun induk
mempercepat kematian sel pada selaput ketuban.
Peregangan berlebihan pada uterus karena polihidramnion dan kehamilan multijanin
menginduksi tegangan membran dan meningkatkan risiko KPD. Peregangan mekanik selaput
ketuban meningkatkan regulasi produksi beberapa faktor amniotik, termasuk prostaglandin
E2 dan interleukin-8. Peregangan juga meningkatkan aktivitas MMP-1 dalam membran.
Interleukin-8, yang diproduksi oleh sel amnion dan korion, merupakan kemotaksis neutrofil
dan merangsang aktivitas kolagenase. Produksi interleukin-8, yang berkonsentrasi rendah
dalam cairan amnion selama trimester ke-dua tetapi berkonsentrasi tinggi pada kehamilan
lanjut, diinhibisi oleh progesteron. Maka, produksi interleukin-8 dan prostaglandin E2
amniotik menggambarkan perubahan biokimia pada selaput ketuban yang mungkin dimulai
oleh tekanan fisik (peregangan membran), menyatukan hipotesa pecah ketuban akibat
induksi-tekanan dan induksi biokimia.
Pada suatu penelitian oleh Park JC dkk. tahun 2003 yang membandingkan ketebalan
dan perubahan histopatologis pada selaput ketuban antara KPD dan selaput ketuban utuh
setelah pelahiran, mendapatkan hasil bahwa pada KPDP ditemukan rerata ketebalan selaput
ketuban yang lebih kecil daripada persalinan preterm tanpa KPD, namun hasilnya tidak
signifikan. Sedangkan pada perbandingannya, selaput ketuban pada kehamilan usia 37
minggu dijumpai lebih tipis daripada kehamilan usia <37 minggu.
Anda mungkin juga menyukai
- Pembahasan SoalDokumen37 halamanPembahasan SoalChristian HasiholanBelum ada peringkat
- Translate Jurnal Rehabilitasi StrokeDokumen20 halamanTranslate Jurnal Rehabilitasi StrokeChristian HasiholanBelum ada peringkat
- CBT4Dokumen46 halamanCBT4Christian HasiholanBelum ada peringkat
- Febriany GotamyDokumen3 halamanFebriany GotamyChristian HasiholanBelum ada peringkat
- Jurnal Agnes EDIT1Dokumen10 halamanJurnal Agnes EDIT1Christian HasiholanBelum ada peringkat
- CoverDokumen2 halamanCoverChristian HasiholanBelum ada peringkat
- Jurnal Agnes EDIT1Dokumen10 halamanJurnal Agnes EDIT1Christian HasiholanBelum ada peringkat
- Lampiran Evrog HolanDokumen11 halamanLampiran Evrog HolanChristian HasiholanBelum ada peringkat
- Pneumo Thorak Ss W WDokumen28 halamanPneumo Thorak Ss W WChristian HasiholanBelum ada peringkat
- Anti ManikDokumen17 halamanAnti ManikChristian HasiholanBelum ada peringkat
- Cummulative Traumatic DisorderDokumen2 halamanCummulative Traumatic DisorderChristian HasiholanBelum ada peringkat