Jurnal Internasional
Diunggah oleh
meidiantiyayaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Jurnal Internasional
Diunggah oleh
meidiantiyayaHak Cipta:
Format Tersedia
Baru 1 oxindoles menggantikan disintesis
dan disaring untuk kegiatan antipsikotik
dan antikonvulsan mereka. Hal ini
disimpulkan dari hasil
pendahuluan
Psikosis adalah gangguan utama SSP
yang menyebabkan serius
gangguan kapasitas untuk mengenali
realitas. Seluruh secara klinik efektif
antipsikotik (kecuali Clozapine Seperti)
memiliki kuat pasca - reseptor D2
dopaminergik memblokir tindakan.
Blokade dopamin
tindakan bertanggung jawab untuk gejala
ekstrapiramidal (EPS) yang sepuluh
terkait dengan obat antipsikotik.
Selain itu, epilepsi sangat sering
dikaitkan dengan gangguan kejiwaan
CNS; Oleh karena itu, obat antipsikotik
baik serta
Kegiatan antiepilepsi akan lebih
menguntungkan.
Titik lebur tidak dikoreksi dan ditentukan
pada salah satu ujung tabung kapiler
terbuka menggunakan Gallen Kamp alat
melting point MFB- 595-010M (Gallen
Kamp, London, Inggris). Mikroanalisis
dilakukan di Micro Satuan analitis,
Fakultas Sains, Universitas Kairo.
Spektrum IR ditentukan dengan
menggunakan cakram KBr (cm- 1) pada
Shimadzu Infrared Spektrometer IR-435
(Shimadzu, Kyoto, Jepang), Perkin- Elmer
FT IR 1650 (PerkinElmer, Waltham,
Massachusetts 02451, USA) dan Mattson
Kejadian II FTIR Spectrometer (Mattson,
Madison, WI, USA). 1 HNMR (DMSO-d6, D
2 O) ppm spektrum ditentukan dengan
menggunakan Joel NMR Varian Gemini
200 MHz spectromete (Joel, Tokyo,
Jepang), dan Varian Mercury VX-300 MHz
NMR Spektrometer (Varian, Oxford,
Inggris). TLC dilakukan dengan
menggunakan Art. DC-Plastikfolie,
Kieselgel 60 F254 lembar (Merck,
Darmstadt, Jerman), pelarut berkembang
yang etil eter asetat minyak bumi (1: 1)
dan tempat divisualisasikan pada 366,
254 nm dengan vilber UV lourmat 77.202
(vilber, marne la vallee , france).
Cukup menarik telah difokuskan pada
turunan Oxindole, yang telah
Oxoindoline1 carboximidamide (3)
dilaporkan memiliki antihypoxic,
antikonvulsan, anti-inflamasi dan
kegiatan anxiolytic. Selanjutnya,
penemuan ziprasidone (Gambar 1)
memimpin eksplorasi Oxindole.
Campuran diaduk adukan magnet dari
senyawa 1) (4,9 g, 20 mmol), 2 (2.09 g,
23,0 mmol) dan piridin (10 ml) diaduk
pada 110C selama 1 jam. Setelah satu
malam didiamkan pada suhu kamar,
dietil eter adalah
Ziprasidone adalah agen atipikal
antipsikotik yang efektif baru memiliki
perancah Oxindole dan baru-baru ini
disetujui oleh Food and Drug
Administration (FDA) untuk pengobatan
skizofrenia. Seperti antipsikotik atipikal
lainnya, mekanisme yang tepat tindakan
obat baru tidak diketahui. Ziprasidone
itu, bagaimanapun, dikenal ampuh
serotonin dan dopamin antagonis.
Berdasarkan temuan ini dan dalam
lingkup program penelitian yang
bertujuan untuk pengembangan derivatif
Oxindole baru untuk mengobati
gangguan neurologis, penulis
menggambarkan sintesis beberapa
turunan Oxindole 1 tersubstitusi baru
formula umum dan mengevaluasi dari
aktivitas antipsikotik dan anticonvu
mereka.
Gambar.
BAHAN DAN METODE kimia
ditambahkan dan endapan dikumpulkan
dengan filtrasi dan dicuci tiga kali dengan
Et2O untuk mendapatkan padatan putih
(5.0g). Yang diperoleh padat dilarutkan
dalam metanol (20 ml) dan larutan
natrium hidroksida 2N (12 ml) dan air (20
ml) yang berturut-turut ditambahkan .
terbentuk endapan yang dikumpulkan
dengan penyaringan dan direkristalisasi
dari etanol, menghasilkan 65%, mp 125127 C. IRmax (cm-1) 3367, 3269
(NH2), 3167 (NH), 3099 (CH aromatik),
2981-2939 (CH alifatik),
1689 (C = O), 1589 (NH). 1HNMR (CDCl
3-300 MHz): 3,5 (s, 2H,
CH2CO), 7,26-6,98 (m, 4H, aromatik H),
9,47 (3, 3H, NH2, NH, Exch.).
Anal. Calcd. untuk C9H9N30 (175); C,
61,70; H, 5.18; N, 23.99, ditemukan: C,
61,55, H, 5.21
Metode umum untuk pembuatan senyawa 4 a-e
Untuk campuran magnetis diaduk 3) (0,5 g,
2.85 mmol) dan asam klorida yang sesuai (3.14
mmol) dalam asetonitril (10 ml) ditambahkan
N, N-dimetil-4-amino piridin (0,02 g, 0,18
mmol) dan trietilamina (1 ml). Larutan yang
dihasilkan diaduk pada ruang
Suhu selama 30 menit. Setelah penambahan 2N
natrium hidroksida (20
ml) dan ekstraksi dengan etil asetat (100 ml),
etil asetat lapisan
dipekatkan dalam ruang hampa. Residu minyak
mentah yang dihasilkan adalah kembali
mengkristal dari metanol menghasilkan produk
kristal.
N- (4 - chlorophenyl Sulfonyl) -2 - Oxindole-1carboximidamide (4a)
Kristal putih kekuningan, m.p. 168-169oC,
menghasilkan 70%. IR max (cm -1):
3421, 3424 (NH2), 3093 (CH aromatik), 1697
(C = O), 1330 (SO 2), 1157 (SO2).
1
HNMR (DMSO-d6, 300 MHz): (. Luas, 2H,
NH 2 Exch D2O) (s, 2H, CH2 CO) 3,4, 8,0-7,7
(m, 8H, aromatik H), 10.4. Anal. Calcd.
untuk C 15 H 12ClN3O3 S (349,5), C, 51,51;
H, 3,46, N, 12.01, Ditemukan: C, 51,35, H,
3,25, N, 12,00.
2-Oxo- N-tosylindoline 1
-carboximidamide (4b)
Kristal kuning, m.p. > 300C. IRmax
(cm-1): 3182, 3143 (NH 2), 1693 (C = O),
1330 (SO2), 1103 (SO2).
1HNMR (DMSO-d6 300 MHz): 3.4 (s,
5H, CH3 dan CH 2 CO), 7,3-6,8 (m, 8H,
aromatik H), 10,8 (s, 2H, NH3, Exch. D2
O). Anal.Calcd. untuk C16H 15N 3 O 3S
(329,38), C, 58,35, H, 4,55, N,
12.76, Ditemukan: C, 58,12, H, 4,25, N,
12,55.
N - (Amino (2- oxoindolin 1yl) metilen)
benzamide (4c)
Kristal merah muda, m.p. 195-197 C,
menghasilkan 85%. IR max (-cm 1):
3429, 3421 (NH 2), 1685 (C = O), 1658
(C = O).
1HNMR (DMSO-d6 300 MHz), 3,4
(s, 2H, CH2CO), 7,3-6,9 (m, 9H, aromatik
H), (s 10,7, 2H, NH 2, Exch.
D 2O), Anal. Calcd. untuk C 16H 3N 3O 2
(279,29), C, 68,81, H, 4.96, N, 15,05,
Ditemukan: C, 68,62, H, 4,62, N, 14,95.
N- (Amino (2- oxindolin-1 -yl) metilen) 4
chlorobenzamide (4d)
Kristal putih merah muda, m.p. > 300C,
menghasilkan 50%. IRmax (cm-1): 3429,
3321 (NH2), 1685 (C = O), 1658 (C = O),
759 (C-Cl).
1HNMR (DMSO-d6
300 MHz), (s 3.4, 2H, CH2 CO), 7,9-7,3
(m, 8H, H aromatik), 10.3 (s,
2H, NH2 Exch. D 2 O). Anal.Calcd. untuk
C16H 12ClN3 O2 (313,74), C, 61.25, H,
3,86, N, 11,30, Ditemukan: C, 61,40, H,
3,50, N, 13,70.
N- (Amino (2 - oxindolin -1 - il) metilen) 4 - metoksi benzamide (4e)
Kristal kuning, m.p. 174-175 C
menghasilkan 80%. IRmax (cm-1): 3428,
3320 (NH2), 1685 (C = O), 1658 (C = O).
1HNMR (DMSO-d6 300 MHz),
3.3 (s, 2H, CH 2 CO), 3,8 (s, 3H, OCH 3),
8,01-6,9 (m, 8H, H aromatik),
10.4 (s, 2H, NH 2 Exch. D 2O), Anal.
Calcd. untuk C17H 15N3O 3 (309,32): C,
66,01, H, 4,89, N, 13,58, Ditemukan: C,
66,40, H, 4,30, N, 13.30.
Metode umum untuk persiapan senyawa
5 a-b
Untuk larutan magnetis diaduk dari ptersubstitusi sesuai fenil sulfonamide (40
mmol) dan trietilamina (1 mmol) dalam
asetonitril anhidrat (40 ml) secara
perlahan ditambahkan etil kloroformat
(60 mmol), dan larutan yang dihasilkan
diaduk pada suhu kamar selama 6 jam
dan menguap dalam ruang hampa.
Residu dilarutkan dalam etil asetat dan
larutan natrium bikarbonat,
ditambahkan. Lapisan air dipisahkan dan
diasamkan dengan campuran es dan HCl
pekat untuk memberikan endapan
berminyak yang perlahan mengkristal
saat didiamkan. Kristal dikumpulkan
dengan penyaringan, dicuci dengan air,
dikeringkan untuk memberikan senyawa
target yang
mengkristal dari etanol.
N- [4 - Methylphenyl] sulfonil asam
karbamat etil ester (5a)
Kristal putih, m.p. 115-117 C,
menghasilkan 55%. IRmax (-cm 1): 3226
(NH),
1762 (C = O), 1346 (SO 2), 1161 (SO2).
1HNMR (CDCl3-300 MHz): 1,12 (t, 3H,
CH2 CH3), 2.3 (s, 3H, CH 3), 4.0 (q, 2H,
CH 2 CH3), 7,8-7,3 (m, 4H, aromatik H ),
11,8 (luas, 1H, NH Exch. D 2O).
N- (4 -chlorophenyl) sulfonil karbamat etil
ester asam (5b)
Kristal putih, m.p. 90-92 C,
menghasilkan 60%. IRmax (-cm 1): 3224
(NH),
1755 (C = O), 1354 (SO2), 1105 (SO2).
1HNMR (CDCl 3-300 MHz):
1.12 (t, 3H, CH2 CH3), 4.0 (q, 2H, CH 2
CH3), 7,9-7,4 (m, 4H, aromatik H),
11.8 (luas, 1H, NH Exch. D2O).
Metode umum untuk pembuatan
senyawa 6a b
Untuk solusi dari tersubstitusi sulfonil
asam karbamat yang sesuai
etil ester 5AB derivatif (20 mmol) dalam
toluena (20 ml), senyawa
1 (20 mmol) ditambahkan dan campuran
yang dihasilkan direfluks selama 4
hr. Setelah pendinginan campuran reaksi
suhu kamar,
dimana kristal terbentuk, dikumpulkan
dan kembali mengkristal dari
etanol.
Oxo- N tosylindoline-1-karboksamida (6a)
Kristal putih kekuningan, m.p. 116-118,
90% yield.IR max (cm-1):
3178 (NH), 1701 (C = O), 1681 (C = O),
1330 (SO 2), 1157 (SO 2).
1HNMR (DMSO-d6-300 MHz): (s, 3H,
CH3) 2.4, (s, 2H, CH2 CO) 3,5, 7,7-6,7
(m, 8H, aromatik H), 10,4 (luas, 1H, NH
Exch. D2O). Anal. Calcd. untuk
C16H 14N2O 4S (330,64): C, 58,17; H,
4,27; N, 8.48, Ditemukan: C, 58,40; H,
4,51; N, 8.61.
N - (4- Chlorophenylsulfonyl) - 2 oxoindoline -1 - karboksamida (6b)
Kristal kuning, m.p. 138-140 C, 81%
hasil, IRmax (CM): 3205 (NH), 1693 (C =
O), 1.618,3 (CO), 1.354,8 (SO2), 1.091,7
(SO 2), 752,2 (Cl),
1HNMR (DMSO-d6-300MHz), 3.4 (s, 2H,
CH 2 CO) 7,8-7,4 (m, 8H,
H aromatik), 10,4 (luas, 1H, NH Exch D2
O).; Anal. Calcd. untuk
C15H11CLN2O4S (350,78): C, 51,36; H,
3.16; N, 7,99, Ditemukan: C, 51,5;
H, 3.41; N, 8.1.
Metode umum untuk persiapan senyawa
7a-b
Campuran dari 6AB karboksamida sesuai
derivatif (7,5 mmol) dan PCl5 (58,14
mmol) dalam klorobenzena (20 ml)
direfluks selama 1 jam. Setelah melalui
konsentrasi dalam ruang hampa resi
karena ditinggalkan dan digunakan
secara langsung pada langkah berikutnya
untuk persiapan sasaran sesuai molekul
8AB yang mengkristal dari
etanol-aseton.
2-Oxo- N- tosylindoline-1- carbimidoyl
klorida (7a)
Kristal coklat, m.p. 191-193 C, 70%
hasil, IR max (-cm 1): 1631 (CO), 1353
(SO 2), 1091 (SO 2), 744 (C-Cl).
N - (4 - Chlorophenylsulfonyl) 1carbimidoyl klorida (7b)
Kristal coklat, m.p. 250-253 C, 75%
hasil. IRmax (cm-1): 1612 (CO), 1311
(SO2), 1087 (SO 2), 752 (C-Cl).
Metode umum untuk persiapan 8AD
senyawa
Kloro yang terbentuk derivatif 7
dihentikan dalam diklorometana
(20 ml) dan direaksikan dengan metil
dingin (etil) amina (3 ml). Setelah
mengaduk campuran reaksi pada suhu
kamar selama 1 jam, campuran
terkonsentrasi dalam ruang hampa.
Residu dikristalisasi
dari etanol-kloroform.
N-Methyl-2 - okso - N
'-tosylindolinecarboximidamide (8a)
Kristal kuning, m.p. 262-265 C, 65%
hasil, IRmax (cm-1): 3421 (NH), 1627 (C
= O), 1319 (SO 2), 1122 (SO 2).
1HNMR (DMSO-d6
300MHz): 2.30 (d, J = 4Hz, 3H, CH 3),
2,95 (s, 5H, CH 2 CO dan CH 3),
7,5-7,1 (m, 8H, aromatik H), 8.70 (luas,
1H, NH Exch. D2O). Anal.
Calcd. untuk C 17h 17N3 O3 S (343,41):
C, 59,47; H, 4,99; N, 12,24; Ditemukan:
C, 59,41; H, 4.60; N, 12,51.
N-Ethyl-2- oxo - N '-tosylindoline -1carboximidamide (8b)
Kristal kuning, m.p. 270-272 C, 60%
hasil, IRmax (cm-1): 3394 (NH), 1631 (C
= O), 1323 (SO 2), 1072 (SO2).
1 HNMR (DMSO-d6 300
MHz): 1,23 (t, 3H, CH2 CH3), 2.91 (s,
2H, CH2 CO), 3,3 (m, 2H,
CH2CH3), 7,7-7,2 (m, 8H, aromatik H),
8,7 (luas, 1H, NH Exch. D 2O).
Anal.Calcd. untuk C18H 19N3O 3S
(357,43): C, 60,49; H, 5.36; N, 11,76;
Ditemukan: C, 60,62; H, 5.11; N, 12.12.
N '- (4-Chlorophenylsulfonyl) - metil N
2oxoindoline-1 -carboximidamide (8c)
Kristal merah muda, m.p. 212-124 C,
65% hasil, IR max (cm-1): 3390 (NH),
1620 (C = O), 1388 (SO 2), 1091 (SO2),
752 (C-Cl), 1HNMR (DMSO 300Hz -d6):.
2.94 (d, J = 4Hz, 3H, CH3), 3.4 (s, 2H,
CH2 CO), 7,2-8,2 (m, 8H, aromatik H), 9.0
(luas, NH, Exch D 2 O). Anal.Calcd. untuk
C16H 14ClN3O 3 S (363,82): C, 52,82; H,
3,88; N, 11,55, Ditemukan: C, 52,5; H,
3,5; N, 11,7.
(4 - Chlorophenylsulfonyl) - N-etil-2
-oxoindoline- 1-carboximidamide (8d)
Kristal kekuningan, m.p. 245-247 C, 65%
hasil, IRmax (cm-1): 3417 (NH), 1662 (C
= O), 1388 (SO2), 1091 (SO 2), 756 (CCl).
1HNMR (DMSO-d 6 300Hz): 1,24 (t, 3H,
CH2CH3), 3,3 (s, 2H, CH 2 CO), 3,5 (m,
2H, CH 2 CH3), 7,9-7,2 (m, 8H, aromatik
H), 9.0 (luas, NH Exch. D 2O).
Anal. Calcd. untuk C17H 16ClN3 O3 S
(377,85): C, 54,04; H, 4,27; N, 11.12,
Ditemukan: C, 54,35; H, 4,6; N, 11,5.
Metode umum untuk persiapan 4- diganti
benzoylisothiocynates 9 a-c
Senyawa 9a c disiapkan sesuai dengan
yang dilaporkan
procedure15 dari tepat 4-tersubstitusi
benzoil klorida dan amonium thiocynate
dan segera bereaksi dengan Oxindole 1.
Metode umum untuk persiapan senyawa
10 a - c
Senyawa 1 (10 mmol) ditambahkan ke
magnetis diaduk dan
didinginkan (0C) larutan 9 (10,5 mmol)
dalam asetonitril anhidrat (10
ml), dan campuran yang dihasilkan
diaduk pada suhu kamar selama 1
hr. Endapan yang terbentuk (amonium
klorida) telah dihapus oleh
filtrasi dan dicuci dengan asetonitril. The
filtrat e adalah
dikumpulkan dan dimurnikan dengan
kristalisasi dari metanol.
N- (2-Oxoindoline-1 -carbonthioyl)
benzamide (10a)
Kristal putih kekuningan, m.p. 97-99 C,
75% hasil. 1HNMR (DMSO-d 6
200 MHz): (s 3.3, 2H, CH2 CO), 7,2-6,7
(m, 9H, aromatik H), 10.3
(luas, 1H, NH Exch. D2O). Anal.Calcd.
untuk C 16H 12N2 O 2S (296,35): C,
64,85; H, 4.08; N, 9.45; Ditemukan C,
64,41; H, 4.23; N, 9.62.
4 -Chloro- N - (2 - oxoindoline-1carbonothioyl) benzamide (10b)
Kristal merah muda, m.p. 138-140C,
75% hasil,
1HNMR (DMSO-d6
200MHz): (s 3.3, 2H, CH2 CO), 7,7-7,1
(m, 8H, aromatik H), 10.4
(luas, 1H, NH Exch. D 2 O). Anal. Calcd.
untuk C 16H 11ClN2 O 2 S (330,79): C,
58.10; H, 3,35; N, 8.47. Ditemukan: C,
58,3; H, 3,6; N, 8,7.
4-metoksi - N- (2 - oxindoline- 1
-carbonothioyl) benzamide (10c)
Kristal kuning, m.p. 187-188C, 60%
hasil, IRmax (-cm 1): 3142 (NH), 2951
(CH aromatik), 1712 (C = O), 1701 (C =
O), 1267 (C = S),
1HNMR (DMSO-d 6 -200MHz): 3,3 (s,
2H, CH 2 CO), 3.8 (m, 3H, OCH 3),
7,8-6,7 (m, 8H, aromatik H), 10.3 (luas,
1H, NH Exch. D2O). Anal.
Calcd. untuk C 17h 14N2O 3S (326,37):
C, 62,56; H, 4,32; N, 8.58. Ditemukan: C,
62,4; H, 4,5; N, 8,9.
Metode umum untuk pembuatan
senyawa 11a - f
Untuk suspensi diaduk senyawa 10 (4.0
mmol) dalam asetonitril (20 ml)
ditambahkan metilamin dingin berlebih
atau ethylamine (3 mmol) untuk
memberikan larutan colures hijau yang
jelas. Larutan HgCl2 (4,4 mmol)
dalam asetonitril (20 ml) secara perlahan
ditambahkan dan suspensi gelap yang
dihasilkan diaduk selama 3 jam, endapan
telah dihapus oleh
filtrasi. Filtratnya berturut-turut
terkonsentrasi dalam ruang hampa,
dilarutkan dalam etil asetat, dicuci
dengan 2N natrium hidroksida,
dikeringkan
natrium sulfat, disaring dan
terkonsentrasi di vakum. Residu
direkristalisasi dari etanol / kloroform.
N - [(Methylamino) (2- oxindolin-1- yl)
metilen] benzamide (11a)
Kristal kuning, m.p. 88-90C, 60% hasil,
IR max (cm-1): 3214 (NH), 1705 (C = O),
1620 (C = O).
1HNMR (DMSO-d6 200MH z): 2,8 (d, J =
4Hz, 3H, CH 3NH), 3.4 (s, 2H, CH2 CO),
8,7-6,8 (m, 9H, Aromatic H),
10.4 (luas, 1H, NH Exch. D 2O). Anal.
Calcd. untuk C 17H15N3O 2 (293,32):
C, 69,61; H, 5.15; N, 14,33. Ditemukan:
C, 69,4; H, 5,5; N, 14,6.
N - [(Ethylamino) (2- oxindolin- 1-il)
metilen] benzamide (11b)
Kristal kuning, m.p. 140-142C, 55%
hasil, IRmax (-cm 1): 3294 (NH), 1725 (C
= O), 1693 (C = O),
1HNMR (DMSO-d6 -200MH z): 1,3
(t, 3H, CH 2 CH3), 3,3 (s, 2H, CH 2 CO),
4.3 (q, 2H, CH 2 CH3), 8,5-7,2 (m, 9H,
H aromatik), 10,4 (luas, 1H, NH, Exch. D2
O). Anal. Calcd. untuk
C18H 17N3O 2.307,35): C, 70,34; H,
5.58; N, 13,67. Ditemukan: C, 70,5; H,
5,8; N, 13,9.
4 - kloro- N- [(methylamino) (2- oxindolin1- yl) metilen]
benzamide (11c)
Kristal putih kekuningan, m.p. 142-144C,
55% hasil,
1HNMR (DMSO-d 6 -200MH z): 2,7 (d, J
= 4HZ, 3H, CH 3 NH), 3,3 (s, 2H, CH 2
CO),
8,0-7,5 (m, 8H, Aromatic H), 10,4 (luas,
1H, NH Exch.). Anal. Calcd. untuk C17H
14ClN3 O 2 (327,77): C, 62,30; H, 4.31;
N, 12,82. Ditemukan: C, 62,1;
H, 4.2; N, 12,5.
4-kloro- N- [(ethylamino) (2 - oxindolin-1yl) metilen]
benzamide (11d)
Kristal kuning, m.p. 146-148C, 60%
hasil,
1HNMR (DMSO-d6200MHz): 1,2 (t, 3H, CH2 CH3), 3,3 (s,
2H, CH 2 CO), 4.4 (m, 2H, CH2CH3), 10.3
(luas, 1H, NH, Exch).. Anal. Calcd. untuk
C18H 16ClN3O 2
(341,79): C, 63,25; H, 4.72; N, 12,29.
Ditemukan: C, 63,5; H, 5.1; N, 12,5.
4- Methyloxy- N - [(methylamino) (2
oxindolin-1- yl) metilen] benzamide (11e)
Kristal kuning, m.p. 82-84C, 55% hasil,
1HNMR (DMSO-d6200MHz): 2,8 (d, J = 4Hz, 3H, CH 3), 3,3
(s, 2H, CH 2 CO), 3,9 (s, 3H, OCH 3). Anal.
Calcd. untuk C18H 17N3O 3 (323,35): C,
66,86; H, 5.3; N, 13,0.
Ditemukan: C, 66,9; H, 5,4; N, 13,2.
4- Methyloxy- N - [(ethylamino) -2oxindolin- 1-il) metilen]
benzamide (11f)
Kristal kuning, m.p. 90-92C, 60% hasil,
IR max (cm-1): 3421 (NH), 1724 (C = O),
1620 (C = O),
1HNMR (DMSO-d6 -200MH z): 1,3 (t,
3H,
CH2 CH3), (s 3.4, 2H, CH2 CO), 4.1 (s,
3H, OCH3), 4.4 (m, 2H, CH 2 CH3).
Anal. Calcd. untuk C 19h 19N3O 3
(337,37): C, 67,64; H, 5.68; N, 12.45.
Ditemukan: C, 67,9; H, 5,9; N, 12,6.
skrining farmakologi
kegiatan antipsikotik
Semua senyawa telah dievaluasi untuk
mereka dievaluasi untuk kegiatan
antipsikotik mereka sesuai dengan
metode berikut: Foot Syok agresi
diinduksi
Hewan-hewan dibagi menjadi lima
kelompok 12 tikus (enam pasang tikus
jantan) per kelompok. yang digunakan
yang (DMSO; 0,5 ml / kg, ip), haloperidol
(1 mg / kg, ip) digunakan sebagai standar
dan senyawa diselidiki (40 mg / kg)
diberikan ip, 30 menit sebelum
percobaan. Kaki shock-diinduksi agresi
(FSIA) perilaku diinduksi di pasang tikus
dengan pemberian kereta impuls melalui
stimulator elektronik ke lantai grid untuk
tiga menit. Perilaku agresif diukur di
pasang tikus menggunakan
dua parameter jumlah perkelahian dan
latency untuk melawan
16
.
Amphetamine diinduksi perilaku stereotip
pada tikus
Hal ini mencetak setiap lima menit
selama 30 menit. Skor folowing diberi
stereotypy scoring- 0, tidak adanya
perilaku stereotip; 1, sniffing intermiten;
2, sniffing konstan; 3, konstan sniffi ng
dengan menjilati intermiten dan / atau
menggigit palsu; 4, menjilati konstan o r
menjilati palsu; 5, menjilati konstan; 6,
menggigit konstan dan bergerak aro und;
7, menggigit konstan dan terbatas pada
daerah kecil di kandang; 8,
pemeliharaan.
Hewan-hewan dibagi menjadi kelompokkelompok, masing-masing berisi tujuh
binatang. Mereka diobati dengan DMSO
(0,5 ml / kg, ip) atau senyawa dalam
penyelidikan (40 mg / kg ip) dan
ditempatkan secara individual dalam
kandang. D-amfetamin (2 mg / kg ip)
diberikan 30 menit setelah senyawa
diberikan. Perilaku stereotip tercatat 17.
Waktu tidur Phenobarbitoneinduced pada
tikus
Fenobarbital (50 mg / kg) disuntikkan i.p.
tikus (n = 6) pra-diobati dengan DMSO
(0,5 mg / kg, ip) atau senyawa dalam
penyelidikan (40 mg / kg ip) Haloperidol
(1 mg / kg, ip) digunakan sebagai kontrol
positif. Kendaraan, senyawa dalam
penyelidikan dan haloperidol diberikan 30
menit sebelum pemberian fenobarbital.
Segera setelah pemberian fenobarbital,
setiap hewan adalah tempat di kandang
individu dan diamati. Latency hilangnya
meluruskan
Refleks (waktu induksi di menit) dan
waktu yang dibutuhkan untuk
memulihkan
meluruskan refleks atau kebangkitan
(tidur waktu di menit) yang terdaftar
untuk setiap hewan
18, 19.
kegiatan antikonvulsan
The Elektroshock maksimal (MES) Model
kejang
The kejut listrik maksimal (MES) uji
kejang digunakan seperti yang dijelaskan
oleh Swinyard et al 20.Rats menjadi
sasaran 0,02 s, 60 Hz stimulus listrik
melalui elektroda kornea 60 menit
setelah ip administrasi senyawa
diselidiki. endpoint
diukur adalah penekanan tonik kaki
belakang ekstensi (HTE), yang
dinyatakan sebagai persentase dari
binatang di mana respon terhambat.
Senyawa uji toksisitas akut diselidiki
untuk studi toksisitas akut (LD50)
menurut metode Smith
21. Senyawa yang diberikan i.p.
dalam dosis 50, 100, 200, 500, 1000,
1500 dan 2000 mg / kg untuk berbagai
kelompok tikus, masing-masing kelompok
terdiri dari enam hewan (n = 6).
Angka mortalitas diamati dan dicatat
untuk jangka waktu 24 jam.
Kami telah berhasil mensintesa
serangkaian turunan Oxindole 1-diganti,
dan disaring mereka untuk antipsikotik
dan kegiatan antikonvulsan. Penelitian
farmakologi menunjukkan senyawa t topi
7b,
8c, 6b, 8a dan 8b menunjukkan
antipsikotik yang baik
aktivitas, tetapi tidak menunjukkan
respon antikonvulsan. Di sisi lain,
senyawa 4b, 4a, 4d, 4c dan 4e
menunjukkan kegiatan antipsikotik dan
antikonvulsan baik dibandingkan dengan
senyawa yang diuji lainnya dan obat
referensi. Hal ini juga menemukan
bahwa, kedua senyawa 4c dan 4e
dipamerkan antipsikotik yang paling
menjanjikan
dan aktivitas antikonvulsan dibandingkan
dengan senyawa terasa lain
HASIL DAN DISKUSI
kimia
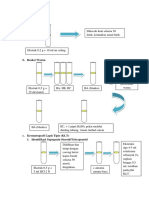
Reaksi Oxindole 1 dengan 2 memberikan
amidine 3, yang direaksikan dengan
berbagai halida arylsulfonyl atau halida
arylcarbonyl untuk melengkapi molekul
target 4 di hasil yang baik (Skema 1).
Selain itu, untuk sintesis target memiliki
satu tambahan
metil atau etil kelompok di bagian
carboxamidine mereka, pendekatan yang
lebih konvergen telah dibuat; di mana di
bagian NHR diperkenalkan di langkah
terakhir. Strategi sintetis didasarkan
pada kopling dari Oxindole 1 dengan
sulfonylated etil ester asam karbamat 5
yang diperoleh dari arylsulfonamide dan
etil sesuai chloroformate, untuk
melengkapi produk 6. Klorinasi dari 6
menggunakan fosfor pentaklorida di
chlorobenzene menghasilkan yang chloro
antara turunan 7 . Senyawa 8 diperoleh
dari reaksi 7 dengan metil atau
ethylamine (Skema 2).
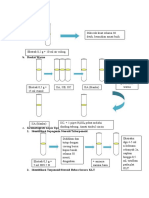
Modifikasi menarik dalam molekul target
kami adalah
penggantian kelompok sulfonil mereka
dengan kelompok karbonil (Skema 3). 4(Un) diganti benzoil isotiosianat 9
disiapkan di situe dari 4- (un) diganti
benzoil klorida dan amonium
isothiocyanate
15. Selain nukleofilik dari Oxindole 1
sampai 9 menghasilkan yang
aduk 10. Target molekul 11 dicapai oleh
reaksi 10 dengan metil atau ethylamine
di hadapan merkuri klorida.
Anda mungkin juga menyukai
- Etiologi DiareDokumen1 halamanEtiologi DiaremeidiantiyayaBelum ada peringkat
- Metode EkstraksiDokumen9 halamanMetode EkstraksiNurannisa ChandraBelum ada peringkat
- Pelatihan PKMDokumen1 halamanPelatihan PKMmeidiantiyayaBelum ada peringkat
- Studi Kelayakan YyDokumen48 halamanStudi Kelayakan YymeidiantiyayaBelum ada peringkat
- Persyaratan Registrasi Variasi Di ASEAN NEWDokumen1 halamanPersyaratan Registrasi Variasi Di ASEAN NEWmeidiantiyayaBelum ada peringkat
- Resume Kelompok 3 (Supplier)Dokumen4 halamanResume Kelompok 3 (Supplier)meidiantiyayaBelum ada peringkat
- KlasifikasiDokumen5 halamanKlasifikasimeidiantiyayaBelum ada peringkat
- Contoh Penent. LODDokumen3 halamanContoh Penent. LODmeidiantiyayaBelum ada peringkat
- ItaliaDokumen3 halamanItaliameidiantiyayaBelum ada peringkat
- SkemaDokumen2 halamanSkemameidiantiyayaBelum ada peringkat
- Faktor2 Yg Mempengaruhi Return On Investment ROIDokumen7 halamanFaktor2 Yg Mempengaruhi Return On Investment ROINur Dzatu Ummu KhollilaBelum ada peringkat
- Asam Amino Dan ProteinDokumen12 halamanAsam Amino Dan ProteinmeidiantiyayaBelum ada peringkat
- Pedoman Pelayanan Farmasi 2015Dokumen56 halamanPedoman Pelayanan Farmasi 2015Bayu SetiawanBelum ada peringkat
- GuaifenesinDokumen1 halamanGuaifenesinmeidiantiyayaBelum ada peringkat
- Contoh Proposal PKM-KDokumen7 halamanContoh Proposal PKM-KmeidiantiyayaBelum ada peringkat
- MAKALAH Perbandingan IFRS Dengan PSAKDokumen13 halamanMAKALAH Perbandingan IFRS Dengan PSAKSarma GirsangBelum ada peringkat
- ALAT DAN BAHAN FitokimDokumen2 halamanALAT DAN BAHAN FitokimmeidiantiyayaBelum ada peringkat
- Data Aik UtsDokumen9 halamanData Aik UtsmeidiantiyayaBelum ada peringkat
- Kasus TelogenDokumen3 halamanKasus TelogenmeidiantiyayaBelum ada peringkat
- Fitofar 4Dokumen6 halamanFitofar 4Tri Restu PamudjiBelum ada peringkat
- Laporan KL Taksonomi Tumbuhan Tingkat Tinggi1Dokumen20 halamanLaporan KL Taksonomi Tumbuhan Tingkat Tinggi1meidiantiyayaBelum ada peringkat
- FlavonoidDokumen1 halamanFlavonoidmeidiantiyayaBelum ada peringkat
- Lampiran Praktikum 2Dokumen4 halamanLampiran Praktikum 2meidiantiyayaBelum ada peringkat
- Keseragaman Bobot KapsulDokumen8 halamanKeseragaman Bobot KapsulWaris TrisatyaBelum ada peringkat
- ALAT DAN BAHAN FitokimDokumen2 halamanALAT DAN BAHAN FitokimmeidiantiyayaBelum ada peringkat
- Pengertian KLTP (Tugas Kel. Fitokim)Dokumen2 halamanPengertian KLTP (Tugas Kel. Fitokim)meidiantiyayaBelum ada peringkat
- FlavonoidDokumen1 halamanFlavonoidmeidiantiyayaBelum ada peringkat
- Skema KerjaDokumen2 halamanSkema KerjameidiantiyayaBelum ada peringkat
- Fitokim 7Dokumen2 halamanFitokim 7meidiantiyayaBelum ada peringkat