Introduction CER Gasal 2020-2021 ITATS
Diunggah oleh
akbarwahyud10 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
13 tayangan8 halamanJudul Asli
Introduction CER gasal 2020-2021 ITATS.pptx
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
13 tayangan8 halamanIntroduction CER Gasal 2020-2021 ITATS
Diunggah oleh
akbarwahyud1Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 8
Teknik Reaksi Kimia I
SEMESTER GASAL 2020/2021
Nyoman Puspaq ASri
PROGRAM STUDI TEKNIK KIMIA
PENDAHULUAN/INTRODUCTION
Tujuan : untuk menyelidiki faktor-faktor yang
berpengaruh pada laju reaksi (rate of reaction)
Mata kuliah ini penting antaralain karena:
Untuk physical Chemist untuk mempelajari kedalaman
sifat sistem reaksi kimia, untuk mengetahui bagaimana
ikatan-ikatan kimia dibentuk/pecah untuk estimasi
energy dan kestabilannya.
Untuk chemical Engineer: kinetika reaksi harus diketahui
untuk dapat merancang peralatan/reaktor dengan baik
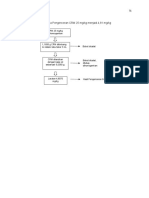
• Every industrial chemical process is designed to
produce economically a desired product from a
variety of starting materials through a
succession of treatmentsteps.
Reactor
Rawa Physical Chemical Physical
material tratment Treatment tratment
Step Step Product
Step
Recycle.
Industri Kimia disebut Industri Process: karena melibatkan banyak proses-kimia, yaitu
Physical Step, Chemical Step (synthesis) dan physical step (purification).
Chemical /Synthesis merupakan jantungnya suatu Industri Kimia.
Untuk dapat mendesain reaktor yang optimal dibutuhkan data-data
kinetika reaksi. Disamping itu juga dibutuhkan data Thermodynamika.
Data perpindahan massa dan panas.
PENGGOLONGAN REAKSI/ JENIS-JENIS REAKSI
1. Berdasarkan banyaknya fase yang terlibat dalam sistem reaksi Reaksi
homogen, reaksi heterogen
2. Berdasarkan keberadaan atau penggunaan katalis : Reaksi katalitik, reaksi
non-katalitik
3. Berdasarkan mekanisme atau kompleksitasnya Reaksi sederhana (reaksi
tunggal searah atau ireversibel) Reaksi kompleks (reaksi bolak-balik atau
reversibel, reaksi seri atau konsekutif atau berurutan, reaksi paralel, reaksi
seri-paralel, reaksi rantai, reaksi polimerisasi)
4. Berdasarkan kemolekulan reaksinya
Reaksi unimolekuler, reaksi bimolekuler, reaksi trimolekuler atau
termolekuler
5. Berdasarkan orde reaksinya
Reaksi berorde bilangan bulat, reaksi berorde bilangan pecahan
6. Berdasarkan arah reaksinya
Reaksi reversibel (bolak-balik) Reaksi reversibel merupakan
reaksi bolakbalik; dalam hal ini terjadi kesetimbangan. Reaksi
ireversibel (searah) Reaksi ireversibel merupakan reaksi satu
arah; tidak ada keadaan setimbang, meskipun sesungguhnya
tidak ada reaksi kimia yang betul-betul tidak dapat balik.
Banyak kasus kesetimbangan berada sangat jauh di kanan
sedemikian sehingga dianggap ireversibel.
7. Berdasarkan jenis pengoperasian reaktornya
Sistem reaktor batch, sistem reaktor alir atau kontinyu
8. Berdasarkan prosesnya (kondisi prosesnya)
Reaksi isotermal (pada volume tetap, pada tekanan tetap),
reaksi adiabatik, reaksi nonisotermal non-adiabatik
Variabel-variabel yang mempengaruhi
kecepatan Reaksi
• Dalam sistem homogen variabel yang
mempengaruhi kecepatan/rate /laju reaksi
adalah: suhu, tekanan dan komposisi.
• Rate/laju reaksi= f (T, C dan P)
• Laju reaksi dinyatakan dengan:
• dNi/dt= kecepatan perubahan mole
• Dimana N adalah banyaknya mole dan I adalah
komponen yang ikut bereaksi.
Yo u
T h a nk
Anda mungkin juga menyukai
- Jepretan Layar 2023-03-21 Pada 19.42.09Dokumen95 halamanJepretan Layar 2023-03-21 Pada 19.42.09akbarwahyud1Belum ada peringkat
- Hasil Test Ulang 2Dokumen1 halamanHasil Test Ulang 2akbarwahyud1Belum ada peringkat
- Ujian Komprehensif, Neraca MassaDokumen1 halamanUjian Komprehensif, Neraca Massaakbarwahyud1Belum ada peringkat
- Surat Rekomdasi Dari Perguruan Tinggi Ai NurjanahDokumen2 halamanSurat Rekomdasi Dari Perguruan Tinggi Ai NurjanahAi NurjanahBelum ada peringkat
- Lembar PengesahanDokumen2 halamanLembar Pengesahanakbarwahyud1Belum ada peringkat
- Lembar PengesahanDokumen2 halamanLembar Pengesahanakbarwahyud1Belum ada peringkat
- Tipe Reaksi Hidrogenasi NewDokumen18 halamanTipe Reaksi Hidrogenasi Newakbarwahyud1Belum ada peringkat
- Revisi 1Dokumen1 halamanRevisi 1akbarwahyud1Belum ada peringkat
- Rekrutmen Bersama BUMN 2023Dokumen1 halamanRekrutmen Bersama BUMN 2023akbarwahyud1Belum ada peringkat
- Laporan PDFDokumen31 halamanLaporan PDFakbarwahyud1Belum ada peringkat
- Section I: Hubungan Kesetimbangan Cair-CairDokumen36 halamanSection I: Hubungan Kesetimbangan Cair-Cairakbarwahyud1Belum ada peringkat
- Kalib PiknoDokumen15 halamanKalib Piknoakbarwahyud1Belum ada peringkat
- Kelompok 2 - Modul PPK 2 - VDokumen5 halamanKelompok 2 - Modul PPK 2 - Vakbarwahyud1Belum ada peringkat
- Digital - 20360797 PR Salmi Hayati PT KonimexDokumen136 halamanDigital - 20360797 PR Salmi Hayati PT Konimexakbarwahyud1Belum ada peringkat
- Buat Tinjauan PustakaDokumen1 halamanBuat Tinjauan Pustakaakbarwahyud1Belum ada peringkat
- AgitasiDokumen28 halamanAgitasiMochMiftahulMasaroAdean100% (1)
- Laporan Praktikum Titrasi Iodimetri. Yasa 62-LibreDokumen8 halamanLaporan Praktikum Titrasi Iodimetri. Yasa 62-LibreBani Hafidz NazaliBelum ada peringkat
- Hasil Dan Pembahasan Makalah KimpolDokumen4 halamanHasil Dan Pembahasan Makalah Kimpolakbarwahyud1Belum ada peringkat
- Resin MelaminDokumen7 halamanResin Melaminakbarwahyud1Belum ada peringkat
- Makalah Proses Industri Kimia Kelompok 2 Malam (After Uts)Dokumen14 halamanMakalah Proses Industri Kimia Kelompok 2 Malam (After Uts)akbarwahyud1Belum ada peringkat
- Kalib PiknoDokumen15 halamanKalib Piknoakbarwahyud1Belum ada peringkat
- Kalib PiknoDokumen15 halamanKalib Piknoakbarwahyud1Belum ada peringkat
- Tugas Operasi Teknik Kimia 2Dokumen4 halamanTugas Operasi Teknik Kimia 2akbarwahyud1Belum ada peringkat
- Laporan Praktikum Titrasi Iodimetri. Yasa 62-LibreDokumen8 halamanLaporan Praktikum Titrasi Iodimetri. Yasa 62-LibreBani Hafidz NazaliBelum ada peringkat
- 2020 TRKDokumen1 halaman2020 TRKakbarwahyud1Belum ada peringkat
- BAB 1 Teknik Reaksi KimiaDokumen17 halamanBAB 1 Teknik Reaksi KimiaoktaviaBelum ada peringkat
- Presentation PIK2 2007 Ke1Dokumen16 halamanPresentation PIK2 2007 Ke1Krisna CenolBelum ada peringkat
- Skema PengenceranDokumen1 halamanSkema Pengenceranakbarwahyud1Belum ada peringkat
- Hasil Dan PembahasanDokumen8 halamanHasil Dan Pembahasanakbarwahyud1Belum ada peringkat