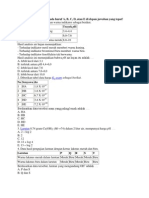
Soal Asam Basa
Diunggah oleh
hakim0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
97 tayangan2 halamanJudul Asli
soal asam basa
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
97 tayangan2 halamanSoal Asam Basa
Diunggah oleh
hakimHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
SOAL DAN PEMBAHASAN KIMIA SMA ASAM DAN BASA
1. Yang dimaksud dengan asam kuat adalah ....
A. asam yang eepat melarutkan logam
B. asam yang dalam ru,mus kimianya banyak mengandung atom H
C. asam yang jika dilarutkan dalam air dapat menghantarkan arus listrik
D. asam yang dapat memerahkan lakmus biru
. E. asam yang jika dilarutkan dalam air banyak menghasilkan ion H+
Peinbahasan:
Asam kuat adalah asam yang merniliki derajat ionisasi sarna dengan 1 atau mendekati
1. Jika dilarutkan dalam air asam kuat akan terionisasi sempuma menghasilkan H+dan
IOn Slsa asam.
Jawab: E
2. Larutan dalam air senyawa berikut yang tidak dapat menghasilkan ion OH- adalah ....
A. Nap D. NH3
B. NaOH E. CH3COOH
C. Mg(OH)2
Pembahasan:
Reaksi senyawa di atas dengan air dapat ditulis sebagai berikut.
Nap + H20 ~ 2 Na+ + 2 OH NaOH dan Mg(OH)2 adalah basa yang di dalam air akan terionisasi menghasilkan
OH-.
NH+HO~NH++OH- 324
CH3COOH adalah. ~sam lemah yang di dalamair terionisasi menghasilkan ion
CH3COO- dan H+.
Jawab: E
3. Diketahui reaksi-reaksi :
1. HlO/aq)~ H2PO:;(aq) + H+(aq)
2. HS-(aq) + H+(aq) ~ H2S(aq)
3. SO~-(aq)+ HNO/aq) ~ HSO:;(aq) + NO;(aq)
4. NH/aq) + HP(I) ~ NH;(aq) + OH-(aq)
D. HP dan HS- .
E. N03 dan SO;Asam-Basa 115
Pasangan yang kedua spesinyaberfungsi sebagai asam menurut konsep Bronsted-Lowry
adalah ....
A. H3P04 dan HSB.
HS- dan NH3
C. Hl04 dan HP
Pembahasan:
Teori Asam-Basa menurut Bronsted-Lowry menyatakan:
Asam : suatu zat yang memberikan proton (H+) kepada zat lain
Basa.: suatu zat yang menerima proton (H+) dari zat lain.
1. H3POiaq) ~ H2PO~(aq) + H+(aq)
Hl04(aq) = sebagai asam, karena memberikan H+
2. HS-(aq) + H+(aq) ~ H2S(aq) ..~ .
HS-(aq) : sebagai basa, karena menerima H+
3. SO;-(aq) + HN03(aq) ~ HSO~(aq) + NO;(aq)
SO;-(aq) : sebagai basa, karena menerima H+
4. NH/aq) + HP(l) ~ NH;(aq) + OH-(aq)
NH3(aq) : sebagai basa, karena menerima H+
H20: sebagai asam, karena memberikan H+
Jawab: C
4. Reaksi berikut:
NH;(aq) + Hp(aq) ~ NH3(g) + Hp+(aq)
Spesi-spesi yang merupakan pasangan asam-bas a konjugasi adalah ....
A. Hp+ dan NH/
B. Hp+danHp
C. NH/danHp
D. NH3 dan Hp+
E. HPdanNH3
Pembahasan:
Menurut Bronsted-Lowry,
Asam : suatu zat yang memberikan proton (H+) kepada zat lain .
Basa : suatu zat yang menerima proton (H+)dari zat lain
NH4+(aq) + Hp(aq) ~ NH3(g) + Hp+(aq)
Asam 1 Basa 1 Basa 2 Asam 2
Dari persamaan reaksi di atas, yang merupakan pasangan asam-basa konjugasi adalah
NH/(aq) dan NH3(g); Hp+(aq) dan Hp(aq) ..
Jawab: B
5. Suatu 1arutan basa lemah MOH mempunyai konsentrasi 0,1 M. Jika tetapan ionisasi
(Kb) basa lemah itu 10-5 maka pH larutan itu adalah ....
A. 3 D. 11
B. 7 -log 5 E. 11 + log 5
C. 7 + log 5
D. 30mL
E. 40mL
116 Soal Jawab Kimia SMA 2
Pembahasan:
Untuk basa lemah:
[OH-] = ~Kb M = ~~10--x-5-O,-l = 10-3
pOH == -log[OH-]= -log 10-3 = 3
pH = pKw-pOH
= 14- 3= 11
Jawab: D
Anda mungkin juga menyukai
- Soal Ulangan Asam BasaDokumen4 halamanSoal Ulangan Asam BasasudiroBelum ada peringkat
- PTS Kimia Xi MiaDokumen3 halamanPTS Kimia Xi MiaDA MaiBelum ada peringkat
- Soal Soal Asam BasaDokumen3 halamanSoal Soal Asam BasajihanfazlinaBelum ada peringkat
- Latihan SoalDokumen3 halamanLatihan SoalDevi Amiratul AsviaBelum ada peringkat
- 30 Latihan Soal Dan Pembahasan Materi Asam Basa Kelas XI - Docx BG1Dokumen13 halaman30 Latihan Soal Dan Pembahasan Materi Asam Basa Kelas XI - Docx BG1Widya SariBelum ada peringkat
- Soal KimiaDokumen5 halamanSoal KimiaYanah NurjannahBelum ada peringkat
- Soal Dan Pembahasan Hidrolisis GaramDokumen6 halamanSoal Dan Pembahasan Hidrolisis GaramUlva DianaBelum ada peringkat
- Soal UTS Kimia Kelas XI Semester 1Dokumen1 halamanSoal UTS Kimia Kelas XI Semester 1Maz Anyz100% (3)
- Soal KimiaDokumen9 halamanSoal Kimiamayonknet01Belum ada peringkat
- Soal Kesetimbangan 2 KimiaDokumen3 halamanSoal Kesetimbangan 2 KimiaTri yatiBelum ada peringkat
- Ulangan Gaya Antar Molekul Dan Bentuk MolekulDokumen3 halamanUlangan Gaya Antar Molekul Dan Bentuk MolekulRoy ThoriqhBelum ada peringkat
- Hidrolisis BufferDokumen7 halamanHidrolisis BufferRiska AriastutiBelum ada peringkat
- PTS KLS Xi SMT 2Dokumen3 halamanPTS KLS Xi SMT 2norma windaBelum ada peringkat
- Soal Hidrokarbon Minyak BumiDokumen4 halamanSoal Hidrokarbon Minyak BumielvaBelum ada peringkat
- Soal Kimia Kelas XDokumen5 halamanSoal Kimia Kelas Xsuarni panaiBelum ada peringkat
- Soal Kimia X 3Dokumen3 halamanSoal Kimia X 3Aly LeeBelum ada peringkat
- Kumpulan Soal Kimia Kelas XI IPA Semester 1Dokumen20 halamanKumpulan Soal Kimia Kelas XI IPA Semester 1Zainal Abidin100% (1)
- Soal Asam BasaDokumen5 halamanSoal Asam BasaNgurah AryaBelum ada peringkat
- Soal Olimpiade Kimia (FINAL Babak 1 & 2)Dokumen2 halamanSoal Olimpiade Kimia (FINAL Babak 1 & 2)ulpaaaaBelum ada peringkat
- Soal Kimia Kelas 11 Semester 1 Dan JawabanDokumen38 halamanSoal Kimia Kelas 11 Semester 1 Dan JawabanRizkhaAprilBelum ada peringkat
- SOal Ujian Kimia Kelas XI IPA Semester 1 T.P. 2010-2011Dokumen5 halamanSOal Ujian Kimia Kelas XI IPA Semester 1 T.P. 2010-2011william_thedyBelum ada peringkat
- (2017) Kimia AnorganikDokumen6 halaman(2017) Kimia AnorganikmaudyBelum ada peringkat
- TEORI KElARUTAN DAN KSP-DARING PDFDokumen5 halamanTEORI KElARUTAN DAN KSP-DARING PDFmiselia rosalinaBelum ada peringkat
- Soal Soal Hidrokarbon, Termokimia, Minyak BumiDokumen8 halamanSoal Soal Hidrokarbon, Termokimia, Minyak BumiSilvana SinagaBelum ada peringkat
- Kesetimbangan KimiaDokumen47 halamanKesetimbangan KimiaNur Hasanah100% (1)
- Soal Pas 1 Kim XII 2018Dokumen4 halamanSoal Pas 1 Kim XII 2018Paizah ExoticBelum ada peringkat
- Soal Kimia Kelas XiiDokumen1 halamanSoal Kimia Kelas XiiWanda SeptianingrumBelum ada peringkat
- Ebook OSNKIMIADokumen48 halamanEbook OSNKIMIANelli Nur Indah SariBelum ada peringkat
- Stoikiometri 1 Persamaan ReaksiDokumen2 halamanStoikiometri 1 Persamaan ReaksiRatna GalihBelum ada peringkat
- Bab 11 Sifat Koligatif LarutanDokumen10 halamanBab 11 Sifat Koligatif LarutanYoo HooBelum ada peringkat
- Soal Tes Akhir Camp 2 Olimpiade KimiaDokumen13 halamanSoal Tes Akhir Camp 2 Olimpiade KimiaYosef Adi SBelum ada peringkat
- Xi Soal Kimia (Peminatan)Dokumen6 halamanXi Soal Kimia (Peminatan)Lagi SewotBelum ada peringkat
- LKS PenyanggaDokumen7 halamanLKS PenyanggaFadli888Belum ada peringkat
- (PPT) Teori Asam BasaDokumen15 halaman(PPT) Teori Asam BasaLeni ApriyantiBelum ada peringkat
- Modul e 11.5Dokumen21 halamanModul e 11.5dnd offi0% (1)
- Soal KSN KimiaDokumen4 halamanSoal KSN KimiaPUTRI FEBRIANTIBelum ada peringkat
- Kumpulan Soal Kimia Kelas 3ADokumen6 halamanKumpulan Soal Kimia Kelas 3AAgus Darmadi SalaBelum ada peringkat
- LKS 3.9 Asam Basa Plus SoalDokumen18 halamanLKS 3.9 Asam Basa Plus SoalDessy FitrianaBelum ada peringkat
- Ukbm RedoksDokumen9 halamanUkbm RedoksIsmi Mu'affifah100% (1)
- UH Asam Basa Kelas XiDokumen1 halamanUH Asam Basa Kelas Xit121hyBelum ada peringkat
- Latihan Soal KImia Kelas X - StoikiometriDokumen3 halamanLatihan Soal KImia Kelas X - StoikiometriKhairani IslamiyahBelum ada peringkat
- SOAL USBN DAN PEMBAHASAN 2yDokumen14 halamanSOAL USBN DAN PEMBAHASAN 2yAnonymous pGHBTkMEBBelum ada peringkat
- Soal Kimia TKJDokumen2 halamanSoal Kimia TKJLiharman PandianganBelum ada peringkat
- Soal Asam Dan BasaDokumen2 halamanSoal Asam Dan Basapramesti indraningsih100% (1)
- Soal Try Out NCC 2022Dokumen25 halamanSoal Try Out NCC 2022Arya NaufalBelum ada peringkat
- Latihan Soal Asam Basa 2Dokumen1 halamanLatihan Soal Asam Basa 2Shita PrajnityaBelum ada peringkat
- Soal Review Senyawa KarbonDokumen4 halamanSoal Review Senyawa Karbon竈門Belum ada peringkat
- Latihan OSN 1Dokumen1 halamanLatihan OSN 1Yogaswara AdiputraBelum ada peringkat
- Soal UAS Kimia Kelas XI Semester 1Dokumen5 halamanSoal UAS Kimia Kelas XI Semester 1Zhariss BoawaeBelum ada peringkat
- Lks Praktikum Titrasi Asam BasaDokumen2 halamanLks Praktikum Titrasi Asam BasaSeptianing TyasBelum ada peringkat
- Soal Semester Genap Kimia Kelas XDokumen10 halamanSoal Semester Genap Kimia Kelas XYkza GhifBelum ada peringkat
- Soal Ulangan Harian I Xi (Asam Basa)Dokumen5 halamanSoal Ulangan Harian I Xi (Asam Basa)Tut DanaBelum ada peringkat
- Gaya Antar Molekul ArchiveDokumen10 halamanGaya Antar Molekul Archiveapi-338483553Belum ada peringkat
- Ulangan Harian IKATAN KIMIA SusulanDokumen9 halamanUlangan Harian IKATAN KIMIA SusulanIsmi Mu'affifah100% (1)
- Ulangan Harian Asam BasaDokumen6 halamanUlangan Harian Asam BasaShita PrajnityaBelum ada peringkat
- Materi TermokimiaDokumen32 halamanMateri Termokimianurhikmah_88Belum ada peringkat
- Asam KuatDokumen5 halamanAsam Kuatroslainileni100% (1)
- Kimia Dasar 11 Asam BasaDokumen55 halamanKimia Dasar 11 Asam BasaWahyu Dwi SetiawanBelum ada peringkat
- Asam Basa KonjugasiDokumen8 halamanAsam Basa KonjugasisrisrnBelum ada peringkat
- Materi 3 Asam Basa KimiaDokumen4 halamanMateri 3 Asam Basa KimiaArif DwirahmanBelum ada peringkat
- Soal SoalDokumen1 halamanSoal SoalhakimBelum ada peringkat
- Vanda SPDokumen2 halamanVanda SPhakimBelum ada peringkat
- ElangDokumen2 halamanElanghakimBelum ada peringkat
- AkroleinDokumen4 halamanAkroleinhakimBelum ada peringkat
- Soal Jawab KimiaDokumen6 halamanSoal Jawab Kimiahakim100% (1)
- Soal Sejarah LanjutDokumen3 halamanSoal Sejarah LanjuthakimBelum ada peringkat