8 Pelapisan - Logam
Diunggah oleh
Ahmad Nurjaman0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
24 tayangan3 halamanjurnal pelapisan logam
Judul Asli
8 PELAPISAN_LOGAM
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOC, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inijurnal pelapisan logam
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOC, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
24 tayangan3 halaman8 Pelapisan - Logam
Diunggah oleh
Ahmad Nurjamanjurnal pelapisan logam
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOC, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 3
Laboratorium Kimia Terapan UP MKU
Politeknik Negeri Bandung
MODUL 8
PELAPISAN LOGAM-LOGAM
I.
TUJUAN
Setelah melakukan praktikum ini diharapkan mahasiswa dapat:
1. Menghitung efisiensi berat dari Fe dengan pelapisan Cu.
2. Mengetahui pelapisan logam-logam menggunakan sel elektrolisis.
II.
LATAR BELAKANG
Reaksi elektrokimia melibatkan perpindahan elektron-elektron bebas dari satu logam ke
komponen di dalam larutan. Sel elektrokimia tersusun atas dua elektroda, yaitu anoda
dan katoda. Pada anoda terjadi reaksi oksidasi, sedangkan pada katoda terjadi reaksi
reduksi.
Sel elektrolisis yaitu sel yang menggunakan arus listrik. Pada sel elektrolisis, reaksi
kimia tidak terjadi secara spontan tetapi melalui perbedaan potensial yang diakibatkan
oleh faktor diluar sistem. Anoda berfungsi sebagai elektroda bermuatan positif dan
katoda bermuatan negatif, sehingga arus listrik mengalir dari anoda ke katoda. Sel
elektrolisis banyak digunakan untuk produksi aluminium atau pemurnian tembaga.
Proses elektrolisis yaitu proses penguraian suatu leburan senyawa atau larutannya oleh
listrik arus searah. Tempat dimana elektrolisis berlangsung disebut sel elektrolisis. Sel
itu terdiri atas leburan atau larutan elektrolit yaitu zat yang dapat menghantar listrik, dan
dua elektroda yang dihubungkan dengan sumber arus listrik, seperti battery atau power
supply. Jika arus listrik dialirkan akan terjadi reaksi kimia pada eketroda-elektrodanya.
Dalam hal ini ion-ion positif berpindah ke arah elektroda negatif yang dihubungkan
dengan kutub negatif sumber arus, dan ion-ion negatif bergerak ke arah elektroda positif
yang dihubungkan dengan kutub positif sumber arus.
Berdasarkan hukum Faraday:
W
Ar.i.t
96500
Dengan, W = massa (gram)
I = arus (A)
T = waktu (detik)
39
Laboratorium Kimia Terapan UP MKU
Politeknik Negeri Bandung
III.
ALAT DAN BAHAN
Alat :
1. Gelas kimia 1 L
2. Bak plastik
3. Pemanas listrik
4. Kabel dan jepit buaya
5. Sumber arus
1.
2.
3.
4.
5.
Bahan :
Zonax-copper (larutan elektrolit)
Plat Besi (Fe)
Plat Tembaga (Cu)
HCl
NaOH
IV. CARA KERJA
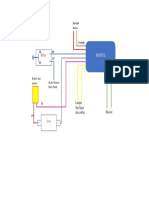
1. Masukkan larutan elektrolit zonax-copper yang sudah dipanaskan 50C ke dalam
bak plastik, kemudian susunlah seperti gambar di bawah ini dengan kutub postif
dihubungkan dengan Cu dan kutub negatif dihubungkan dengan plat besi Fe yang
sudah dibersihkan dengan HCl dan NaOH kemudian ditimbang.
2. Nyalakan power supply dan tentukan arus yang digunakan dengan menentukan luas
permukaan dari plat besi. Setelah 10 menit kemudian amati perubahan yang terjadi
dan timbang plat besi.
3. Ulangi proses yang sama sebanyak 3 kali dengan variasi waktu 5 menit.
40
Laboratorium Kimia Terapan UP MKU
Politeknik Negeri Bandung
V.
VI.
DATA PENGAMATAN
Plat Besi
(Fe)
Waktu
Pelapisan
(menit)
1
2
3
10
15
20
Massa (gram)
Sebelum
Dilapisi
Setelah Dilapisi
Hasil Pelapisan
(Setelah- Sebelum)
PERHITUNGAN
Massa teoritis: W
Ar.i.t
96500
% Efisiensi = (massa hasil percobaan) / (massa teoritis) x 100%
41
Anda mungkin juga menyukai
- K3 Bahaya Pengelasan Dan Pengendaliannya PDFDokumen76 halamanK3 Bahaya Pengelasan Dan Pengendaliannya PDFAhmad NurjamanBelum ada peringkat
- Rangkaian Alarm V12 Motor Vega ZRDokumen1 halamanRangkaian Alarm V12 Motor Vega ZRAhmad NurjamanBelum ada peringkat
- Makalah Kebakaran HutanDokumen63 halamanMakalah Kebakaran HutanAhmad NurjamanBelum ada peringkat
- Unsur KetahananDokumen16 halamanUnsur KetahananAhmad NurjamanBelum ada peringkat
- Laporan Praktikum Uji TarikDokumen20 halamanLaporan Praktikum Uji TarikAhmad NurjamanBelum ada peringkat
- 017 - Surat Penawaran Kerjasama (PT BAT)Dokumen3 halaman017 - Surat Penawaran Kerjasama (PT BAT)Ahmad NurjamanBelum ada peringkat
- 6 TermokimiaDokumen6 halaman6 TermokimiaAhmad NurjamanBelum ada peringkat
- 9.quality Control PDFDokumen55 halaman9.quality Control PDFAhmad NurjamanBelum ada peringkat