Jurnal Hidrolisa Minyak Jarak PDF
Diunggah oleh
dartoJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Jurnal Hidrolisa Minyak Jarak PDF
Diunggah oleh
dartoHak Cipta:
Format Tersedia
Hidrolisa Minyak Jarak
HIDROLISA MINYAK JARAK
Noor Uliyathul Chasanah, Adetya Hendri Murtanto, Olivia Anastria
Jurusan Teknik Kimia Fakultas Teknik Universitas Diponegoro Semarang
Jln.Prof.Sudharto, Tembalang, Semarang, 50239
Abstrak
Lemak dan minyak adalah trigliserida yang berarti triester dan glisrol. Hidrolisa merupakan
pengikatan gugus OH-, suatu senyawa OH- dapat diperoleh dari air. Pada hidrolisa minyak
jarak air memecah gugus alkil dalam trigiserida minyak mnjadi asam lemak dan gliserol.
Faktor-faktor yang mempengaruhi reaksi hidrolisa minyak jarak adalah suhu, pengadukan,
katalis, perbandingan reaktan. Percobaan ini dilakukan dengan menganalisa kadar asam
lemak bebas dan katalis HCl. Selanjutnya hidrolisa minyak jarak dengan variabel
konsentrasi HCl, O,1 N; 0,2N; 0,3N diambil samplenya selang 5 menit sampai 20 menit.
Sampel dianalisa untuk menentukan kadar asam lemak bebasnya. Didapat data bahwa
konsentrasi katalis HCL 0,1 N dan 0,2 N terjadi kenaikan konversi serta pada katalis 0,3N
terjadi penurunan konversi.
Kata kunci : Hidrolisa, Minyak jarak, Katalis
PENDAHULUAN
I.1 Latar Belakang lemak atau minyak seringkali diberi nama
Lemak dan minyak lemak adalah dengan cara yang biasa dipakai untuk
trigliserida yang berarti triester dari gliserol. penamaan ester.
Perbedaan antara suatu lemak dan minyak Pohon jarak merupakan salah satu
adalah pada temperatur kamar, lemak akan jenis tanaman penghasil non edible oil.
berbentuk padat dan minyak berbentuk cair. Hasil utamanya dari pohon jarak adalah
Sebagian besar gliserida pada hewan adalah bijinya, apabila dikeringkan biji jarak
berupa lemak yang biasa disebut lemak akan menghasilkan minyak jarak.
hewani, sedangkan gliserida dalam tumbuhan Penggunaan minyak jarak akan menjadi
cenderung berupa minyak dan disebut sebagai asam lemak dan gliserol yang dapat
minyak nabati. dilakukan dengan cara menuangkan
Asam karboksilat yang diperoleh dari minyak jarak dengan menambahkan asam
hidrolisis suatu lemak atau minyak, yang sulfat sebagai katalis.
disebut asam lemak umumnya mempunyai
rantai karbon panjang dan tidak bercabang,
Laboratorium Proses Kimia 2011
Hidrolisa Minyak Jarak
Penggunaan langsung minyak jarak terbatas minyaklah yang dominan sehingga
pada industry genteng, obat – obatan, minyak kinetika reaksi ditentukan oleh kecepatan
rem dan minyak kincir. difusi air ke dalam fase minyak dan reaksi
I.2 Tujuan Percobaan antara air dan minyak di fase minyak yang
1.Mempelajari pengaruh variabel konsentrasi dapat disajikan ke dalam persamaan
HCl 0,1N , 0,2N , 0,3N terhadap reaksi matematik
hidrolisa minyak jarak. - Kecepatan difusi air ke fase minyak:
2.Menghitung konstanta kecepatan reaksi dan - rA = k1a (CA* - CA1)
pengaruh variabel konsentrasi HCl 0,1N , mgrek/gminyak/menit
0,2N dan 0,3N terhadap konstanta kecepatan
reaksi Dengan :
CA = konsentrasi air di fase minyak yang
I.3 Manfaat Percobaan seimbang dengan konsentrasi air difase
1.Mahasiswa mampu mempelajari pengaruh air atau CA* = k CA2
variabel konsentrasi HCl 0,1N , 0,2N , 0,3N CA1= konsentrasi air di fase minyak ,
terhadap reaksi hidrolisa minyak jarak. mgrek / g minyak
2.Mahasiswa mampu menghitung konstanta CA2 = konsentrasi air di fase air
kecepatan reaksi dan variabel konsentrasi k1a = konstanta kecepatan difusi air ke
HCl 0,1N , 0,2N dan 0,3N terhadap konstanta fase minyak, menit-1
kecepatan reaksi - Kecepatan reaksi di fase minyak:
rA = rB = kr CA1 CB
dengan :
CA1=konsentrasi air di fase minyak
LANDASAN TEORI CB= konsentrasi minyak / trigliserida
Untuk mencari langkah yang
II.1 Hidrolisa Minyak secara Umum mengontrol pada kinetika reaksi, disusun
Hidrolisa merupakan pengikatan gugus neraca massa air dan neraca massa
hidroksil (-OH) oleh suatu senyawa. Gugus – minyak di fase minyak sebagai berikut :
OH dapat diperoleh dari air. Hidrolisis dapat Neraca massa air dalam fase minyak :
digolongkan menjadi hidrolisis murni, = k1a (CA* - CA1) – kr CA1 CB
hidrolisis katalis asam, hidrolisis katalis basa, Asumsi : dengan adanya
gabungan alkali dengan air dan hidrolisis pengadukan, kecepatan transfer massa
dengan katalis enzim. Berdasarkan fase reaksi pada persamaan di atas [k1a (CA* - CA1)]
hidrolisis dikelompokkan menjadi hidrolisis dianggap jauh lebih besar daripada
fase cair dan fase uap. kecepatan reaksi kimia [kr CA1 CB] maka
Hidrolisa minyak nabati dapat dianggap hanya kecepatan reaksi kimia
dilakukan pada tekanan rendah akan tetapi saja yang menentukan kecepatan reaksi
reaksinya berlangsung lambat sehingga keseluruhan.
diperlukan katalisator, misalnya H2SO4. Neraca massa minyak dalam fase minyak
Katalisator tidak diperlukan, jika hidrolisis = – kr CA1 CB
dilakukan pada tekanan sangat tinggi yaitu Bila jumlah air berlebihan dan
700 psia dan 485oF (Groggins,1985) dan transfer massa air ke fase minyak sangat
konversi yang dicapai >90%. Pada proses cepat, maka fase minyak dianggap selalu
hidrolisis, air memecah gugus alkil dalam jenuh dengan air, maka CA1 = CA* yang
trigliserida minyak menjadi asam lemak dan bernilai konstan pada suhu tertentu, k1
gliserol. CA1 = k’ sehingga :
Pada reaksi dengan air reaksi -rB = -k’ CB
dimungkinkan terjadi pada fase cair dan fase = -k’ CB
minyak, akan tetapi menurut Lascaray (1949) = - k’ …(5)
reaksi pada fase ln = - k’ t
Laboratorium Proses Kimia 2011
Hidrolisa Minyak Jarak
dimana : dan sedikit asam sulfat di dalam sebuah
CB0 = banyaknya trigliserida mula – mula labu leher tiga. Pemanasan dilangsungkan
mgrek/gr minyak sampai suhu yang diinginkan sebelum air
CB= banyaknya trigliserida suatu saat = CB0 panas dimasukkan. Contoh diambil setiap
banyaknya asam lemak bebas yang terjadi, waktu tertentu (10 menit) untuk dianalisa
mgrek/gr minyak asam bebasnya, kecepatan hidrolisis
Bila X = maka, terutama ditentukan oleh kecepatan reaksi
X= antara air dan trigliserida di fase minyak.
= = (1 – X) …(8) Penggunaan air yang berlebihan
ln (1-X) = - k t memungkinkan fase minyak selalu jenuh
dimana: dengan air sehingga reaksi hidrolisis
k= konstanta kecepatan reaksi tingkat satu, j-1 bertingkat satu semu terhadap konsentrasi
t = waktu reaksi, j gliserida.
Nilai konstanta kecepatan reaksi kimia sebagai
fungsi suhu dapat dinyatakan dengan II.4 Faktor-Faktor yang Mempengaruhi
persamaan Arrhenius : Hidrolisa Minyak Jarak
k = Ae-Ea/RT A. Suhu
dimana : Kenaikan suhu akan memperbesar
k = konstanta kecepatan reaksi, j-1 nilai konstanta kecepatan reaksi. Suhu
T = suhu oK yang semakin tinggi akan memperbesar
R = tetapan gas kelarutan air di dalam fase minyak,
Ea = energi aktivasi sehingga makin banyak pula trigliserida
yang bereaksi. Menurut Rahayu (1999)
II.2 Minyak Jarak hubungan antara konstanta kecepatan
Minyak jarak merupakan minyak reaksi dengan suhu dapat dinyatakan
nabati yang diperoleh dengan cara pemerasan dengan persamaan :
dari tanaman Ricinus Communis, kegunaan k = 1,2515 . 108 e-8022/T = 1,2515 e-
15939/RT
langsung minyak jarak terbatas pada industry
genteng, obat– obatan , minyak rem, minyak Dengan:
kincir. k = konstanta kecepatan reaksi
Sifat fisik dari minyak jarak adalah T = suhu absolut oK
cairan tidak berwarna atau berwarna kuning R = tetapan gas = 1,987 cal/gmol oK
pucat, bau lemak, rasa sedikit menggigit, B. Katalisator
viscositas tinggi dan bilangan asam akan Katalisator yang dipakai dapat berupa
tinggi sesuai dengan waktu yang ditandai enzim atau asam. Katalisator pada
dengan biji rusak dan cara pemerasan yang percobaan ini dipilih H2SO4. Semakin
tidak baik. banyak asam sulfat yang ditambahkan,
Sifat kimia dari minyak jarak adalah konversi akan semakin besar demikian
mengandung 46 – 53% minyak. Minyak jarak juga terhadap konstanta kecepatan
mengandung 80% gliserida, asam asinolat, reaksinya. Bila katalisator makin
stearat isoresinolat, dihidroksi stearat dan banyak, makin banyak pula molekul –
palmiat. Minyak jarak juga mengandung 20% molekul trigliserida yang teraktifkan.
protein, 0,2 alkaloid piridin beracun, risinin Menurut Rahayu (1999) hubungan antara
serta enzim lipase minyak jarak konstanta kecepatan reaksi (Kc) dengan
mengandungzat toksin risin. konsentrasi asam (c) mgmol H2SO4/
grminyak dapat dinyatakan dengan
II.3 Hidrolisa Minyak Jarak persamaan :
Hidrolisa minyak jarak menjadi asam – asam Kc = 0,14525 c13
lemak dan gliserol dilakukan dengan cara Dengan c = mgmol H2SO4/ grminyak
memanaskan campuran minyak jarak B. Pencampuran
Laboratorium Proses Kimia 2011
Hidrolisa Minyak Jarak
Agar zat dapat saling bertumbukan dengan baik, BM = 40 gr/mol
maka perlu adanya pencampuran. Untuk proses BJ = 2,130 gr/ft
batch, hal ini dapat dicapai dengan bantuan Kelarutan dalam air panas = 247 gr/100 gr
pengaduk. Apabila prosesnya kontinyu maka Kelarutan dalam air dingin= 42
pengadukan dilakukan dengan cara mengatur gr/100 gr Densitas =
aliran dalam reaktor agar terjadi olakan. 2,1 gr/
C. Perbandingan Zat Pereaksi Titik leleh = C (551K)
Bila salah satu zat pereaksi berlebihan Titik didih = C (1663K)
jumlahnya, maka kesetimbangan dapat Sifat Kimia = merupakan basa kuat dan
bergeser ke sebelah kanan dengan baik, begitu mudah larut dalam air.
pula sebaliknya, jika produk diambil, maka (www.wikipedia.org/natrium.hidroksida)
reaksi akan bergeser ke kanan. 3. H2SO4
- Sifat Fisis
II.5. Reaksi hidrolisa BM = 98 gr/mol
Densitas = 1,84 gr/
Titik leleh = C
Titik didih = C
Viskositas = 26,7 Cp (C)
- Sifat Kimia = mudah larut
dalam air
(us pantent, 4218386 Hydrolysis at Beracun dan korosif
Triglyceride) (www.wikipedia.org/sulfuric.acid)
4. PP
II.6. Sifat Fisik Dan Kimia Reagen - Sifat Fisik
merupakan indicator asam
1. Minyak jarak Trayek pH = 8,2-10
- Sifat fisik BM = 318,32 gr/mol
titik nyala =C Densitas = 1,272 gr/
Viskositas = U-V (6,3-8,8 juta) - Sifat Kimia
Bilangan asetil = 145-154 reaksi H-pH-pH (aq) (aq) - pHpH (aq).
- Sifat Kimia = bersifat asam Kekentalan dan Penambahan menggeser kekiri,
kelarutan dalam alcohol relative tinggi mengubah indikator jadi tak berwarna.
(www.cahyadi.stariu_all.com/filles/2008/at Penambahan menggeser kekanan,
/jarak) mengubah indikator menjadi merah muda
2. NaOH (www.wikipedia.org/phenolpitaein)
-Sifat fisik
II.7. Cara Ekstraksi Minyak Jarak (Balitbang provinsi Sumatra Utara, Dept.
Proses pengolahan biji jarak dari biji Teknik pertanian USU, Medan)
jarak meliputi pengeringan biji jarak untuk
menghasilkan biji dari buah jarak.
Pengeringan biji jarak hingga diperoleh kadar PELAKASANAAN PERCOBAAN
air biji 6%, pemisahan kulit biji dengan buah
jarak yang dapat dilakukan secara manual atau III.1 Alat dan Bahan
menggunakan mesin. Proses pemanasana. Bahan yang digunakan
daging biji pada suhu 170 oC selama 30 menit,- HCl 0,1N, 0,2N dan 0,3N
penghancuran daging biji, pengepressannya- NaOH 0,1N
dengan menggunakan mesin pengepress dan- Minyak Jarak
penyaringan minyak. (tubus 2005) - Aquadest secukupnya
Laboratorium Proses Kimia 2011
Hidrolisa Minyak Jarak
- Butanol Mengetahui pengaruh variabel HCl 0,1N,
- PP 0,2N dan 0,3N terhadap konversi hidrolisa
- Emulsifier 5ml minyak jarak.
b. Alat yang digunakan
- Labu leher tiga III.5 Prosedur
- Pendingin balik
- Waterbath A. Menghitung densitas
- Magnetic stirrer dan heater � Densitas Minyak Jarak
- Thermometer Timbang picnometer kosong (m1),
- Statif,buret,klem masukkan minyak jarak kedalam
- Pipet tetes picnometer yang telah diketahui
- Kompor listrik volumenya (V), timbang beratnya (m2).
- Erlenmeyer Hitung densitas minyak jarak.
III.2 Gambar Alat
� Densitas Katalis HCl
8
Timbang picnometer kosong (m1),
7
masukkan HCl teknis dilaboratorium
2
kedalam picnometer yang telah diketahui
3
volumenya (V), timbang beratnya (m2).
5 1 Hitung densitas katalis HCl.
11
6
10
B. Penentuan Kadar Asam Lemak
Bebas
Gambar 1. Rangkaian Alat Hidrolisa 1. Memasukkan 5 mL minyak jarak
Minyak Jarak yang telah dihidrolisa ke dalam
Erlenmeyer
2. Panaskan sampai suhu C
3. Menitrasi dengan NaOH :
penambahan 3 tetes PP, kemudian
dititrasi sampai warna pink
4. Mencatat kebutuhan titran
C. Analisa Katalis
1. Membuat 100 mL larutan HCl 0,1 N,
0,2N dan 0,3N
Gambar 2. Rangkaian Alat Titrasi 2. Mengambil 10 mL larutan HCl 0,1 N,
0,2N dan 0,3N
III.3 Variabel Operasi 3. Menambahkan 15 mL butanol 95%
a. Variabel Tetap: 4. Menambahkan PP dan menitrasi
Basis volume = 300 mL dengan NaOH sampai merah muda
T = 70oC 5. Mencatat kebutuhan titran
NaOH 0,1N
Perbandingan berat minyak : aquadest = 1:3 D. Hidrolisa Minyak Jarak
1. Memasukkan minyak jarak ke dalam
b. Variabel Berubah labu leher tiga sebanyak 73 ml untuk
Konsentrasi katalis (HCl) = 0,1N , 0,2N dan variabel 1, 73,2 ml untuk variabel 2
0,3N dan 72,9 ml untuk variabel 3
2. Memasukkan katalis HCl 0,1 N ,
III.4 Respon Uji Hasil
0,2N dan 0,3N ke dalam labu leher
tiga
Laboratorium Proses Kimia 2011
Hidrolisa Minyak Jarak
3. Memanaskan campuran tersebut sampai A. Menimbang sampel 5 ml kemudian
suhu 70oC kemudian menambahkan dimasukkan ke dalam erlenmeyer
aquadest yang telah dipanaskan ke dalam B. Menambahkan 15 mL
labu leher tiga, emulsifier (sabun) 5 ml b95% dan memanaskannya sambil
4. Mengalirkan air pendingin selama proses diaduk pada suhu 60oC
hidrolisa C. Menambahkan 3 tetes
5. Mengamati sampel dalam selang waktu indicator PP dan menitrasi dengan
5 menit untuk dianalisa asam lemak dan NaOH sampai warna berubah
asam total selama 20 menit menjadi merah muda
D. Mencatat kebutuhan
E. Analisa Kadar Asam Lemak dalam Bahan titran
Baku
HASIL PERCOBAAN DAN PEMBAHASAN
IV.1 Hasil Percobaan
Hasil percobaan pada konsentrasi HCl 0,1 N adalah sebagai berikut :
T CB CB
(menit) Hidrolisa terbentuk XA K
0 0.03 -0.01 -0.01
5 0.04 -0.002 -0.002
0.002/mol
10 0.07 0.028 0.03 menit
15 0.08 0.038 0.04
Hasil percobaan pada konsentrasi HCl 0,2 N adalah sebagai berikut :
T CB CB
(menit) Hidrolisa terbentuk XA K
0 0.09 0.048 0.05
5 0.12 0.078 0.08
10 0.17 0.128 0.14 0.013/mol menit
15 0.23 0.188 0.21
20 0.27 0.2 0.22
Laboratorium Proses Kimia 2011
Hidrolisa Minyak Jarak
Hasil percobaan pada konsentrasi HCl 0,3 N adalah sebagai berikut :
T CB CB
(menit) Hidrolisa terbentuk XA K
0 0.095 0.053 0.06
5 0.1 0.058 0.065
10 0.12 0.078 0.087 0.006/mol menit
15 0.13 0.088 0.09
20 0.134 0.092 0.01
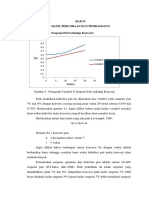
semakin berkurang disebabkan karena
IV.2 Pembahasan terjadi penyusutan volume katalis yang
1.Hubungan konsentrasi katalis terhadap menyebabkan mengecilnya ukuran dari
konversi hidrolisa pori katalis sehingga reaktan dalam hal ini
trigliserida yang tersusun atas asam lemak
yang memiliki ukuran molekul ukuran
yang berbeda-beda atau lebih besar dari
pori katalis tidak dapat masuk dan
berfungsi membentuk produk
(folger,1999). Kemungkinan lain
disebabkan site aktif katalis merupakan
suatu titik dalam katalis tempat reaksi
berlangsung dan bila tidak rusak maka
kemampuan katalis tersebut sebagai
media reaksi akan berkurang pula
Gambar IV.1 Waktu Vs Konversi sehingga reaktan tidak banyak terkonversi
menjadi produk yang pada akhirnya
Pada variabel 1 dan variabel 2 terlihat membuat konversi yang dihasilkan
bahwa konsentrasi katalis yang lebih tinggi berkurang.
mempunyai nilai konversi yang besar pula (http://eprints.undip.ac.id//22029/1/4-
larutan HCl yang digunakan berfungsi sebagai 11_pdf)
katalis, bertujuan untuk menurunkan energy
aktifasi. HCl menyumbangkan ion yang akan 2. Pengaruh konversi terhadap waktu
memotong ikatan trigliserida menjadi asam
lemak bebas dan gliserol. Sehingga semakin
tinggi konsentrasi katalis semakin banyak ion
yang disumbangkan oleh HCl untuk
mempercepat reaksi sehingga konversi yang
didapatkan semakn besar dengan katalis yang
berkonsentrasi tinggi, tetapi pada percobaan
kami, pada variabel 3 terjadi penurunan
konversi, hal ini disebabkan karena pada HCl
0,3N fase aktif katalisnya berkurang sehingga
kesempatan terjadinya reaksi pembentukan
asam lemak bebas pun
Gambar IV.2 Waktu Vs -ln (1-Xa)
Pada percobaan yang kami lakukan , menyebabkan semakin besar konversi yang
disimpulkan bahwa semakin lama waktu reaksi diperoleh. Hal ini dikarenakan semakin lama
Laboratorium Proses Kimia 2011
Hidrolisa Minyak Jarak
waktu reaksi .maka semakin banyak yang semakin tinggi hal inilah dapat di lihat dari
terhidrolisa berarti hasil yang didapat juga reaksi hidrolisa dibawah ini :
C-O--R1 C-O-- OH
HC-O--R2 + 3 + 3O → 3RCOOH + HC- O--OH
HC-O--R3 C-O-- OH
(Trigliserida) (air) (asam lemak) (Gliserol)
Dan dapat juga dijelaskan dengan rumus : katalis yang dapat menurunkan energy
-rA = kCA aktivasi. Dengan penurunan energy
= kCA aktivasi ini maka enegi minimum yang
=-k dibutuhkan untuk terjadinya tumbukan
Ln = -kt semakin berkurang, sehingga
= -kt mempercepat terjadinya reaksi. Hal ini
Ln(1-XA) = -kt sesuai dengan rumus :
Missal pada HC 0,1N t=10 K= dimana k = konstanta laju reaksi
Ln (1-XA) = -kt Ea= energy aktivasi
Ln (1-XA) = -2,78xx10 Tetapi pada percobaan kami pada
Ln (1-XA) = -2,78x variabel 3,hal ini berbanding terbalik,
0,0274 = XA bahwa semakin besar konsentrasi katalis,
nilai konstanta berkurang, disebabkan
Misal pada HCl 0,1N t=15 katalis HCl 0,3N menaikkan energy
Ln (1-XA) = -kt aktivasi sehingga akan
Ln (1-XA) = -2,78xx15 menurunkan/memperlembat terjadinya
Ln (1-XA) = -2,78x reaksi.
0,0408 = XA (www.chem_is_try.org)
Dari perhitungan diatas dapat terlihat (www.belajarkimia.com)
bahwa semakin lama waktu yang digunakan
maka konversi akan semakin meningkat, akan 4.Pengaruh hubungan konstanta
tetapi jika reaksi telah mencapai kecepatan reaksi terhadap konversi katalis
kondisisetimbang waktu tidak akan
meningkatkan nilai konversi dan nilai Dari grafik waktu vs ln (1-XA) terlihat
konversi yang didapatkan akan bernilai bahwa konversi berbanding lurus dengan
konstan. k hal ini dilakukan dengan metode least
(buku petunjuk praktium proses kimia) squre yang menunjukkan garis linier
dengan % error mendekati 1, yakni %
3.Pengaruh konsentrasi katalis terhadap error untuk HCl 0,1N = 0,9666; untuk
konstanta kecepatan reaksi HCl 0,2N=0,9555 dan HCl 0,3N= 0,922.
Dari percobaan terlihat nilai k pada Hal ini menunjukkan grafik diatas
variabel 1 dan 2 semakin besar seiring berdasarkan data percobaan kami
bertambahnya konsentrasi katalis. Dari data mendekati linier; artinya konversi
yakni ketika konsentrasi katalis HCl=0,1N berbanding lurus terhadap konstanta
didapat k=0,002/mol menit dan pada HCl kecepatan reaksi; berdasarkan analitik dari
0,2N k=0,013/mol menit. Peningkatan ini persamaan :
sesuai dengan fungsi -rA = kCA
Laboratorium Proses Kimia 2011
Hidrolisa Minyak Jarak
= kCA mengalami pertambahan konversi dan
=-k hal ini berbanding terbalik dengan
Ln = -kt variabel HCl 0,3 N.
= -kt
Ln(1-XA) = -kt V. II Saran
Misal pada HCl 0,1N t=5; XA= -0,002
Ln (1-XA)= -kt a. Pengaturan suhu hidrolisa harus dijaga
0,002 = -k.5 agar tetap konstan
k = -4x104 b. Teliti dalam penentuan titik akhir
misal pada HCl 0,1N t=20; XA=0,06 titrasi (TAT)
Ln (1-XA)= -kt
-0,06 b = -k.20
k = 3x10-3
DAFTAR PUSTAKA
dari grafik terlihat bahwa semakin besar
konversinya maka semakin besar nilai Agra, S.B. dan Warni Jati
konstanta kecepatan reaksinya; sehingga S,1972,”Hidrolisis Minyak Kelapa
hubungan konstanta kecepatan berbanding dengan Katalisator Asam” Forum
lurus. Tetapi pada perhitungan diatas pada Teknik,2(1), hal 31-40
HCl 0,1N bahwa konstanta yang didapat serta Griflin, R.C.,1972,”Technical Method of
konversinya berniali negatif dikarenakan nilai Analysis”,2nd ed. p.307-311. Mc Graw
CB awalnya lebih besar daripada CB hidrolisa Hill Book Company Inc., New York
yang disebabkan Karena pada saat terjadinya (http://eprints.undip.ac.id//22029/1/4-
reaksi hidrolisa fase aktif katalisnya berkurang 11_pdf)
atau site aktif katalisnya ada yang berkurang (http://iib.Uym.ac.id/jurnal/download:ph
atau rusak sehingga menyebabkan reaktan pdataid:3509)
tidak banyak terkonversi menjadi produk yang Rahayu S.,1999, ”Hidrolisis Minyak
mengakibatkan nilai konversinya berkurang Jarak dengan Katalisator Asam Sulfat”.
dan mengakibatkan CB hidrolisa juga menjadi Prosiding Seminar Nasional Rekayasa
kecil dan Proses
Sven, Ts dan Chien,
(http://eprints.undip.ac.id/22029/1/A_11_pdf) T.P.,1941,”Reaction Mechanism of The
Acid Hydrolisis of
PENUTUP Fatty Oils”, Ind. Eng,Chem, 33.1093
Widayat, Endang 2005,” pengaruh
V.I Kesimpulan katalisator terhadap laju
reaksi”,Fakultas MIPA
a. Semakin besar konversi maka konversi Universitas Negeri Yogyakarta.
yang didapat akan semakin besar, hal ini
(www.belajarkimia.com)
terjadi pada variabel HCl 0,1 N dan
(www.chem_is_try.org)
variabel HCl 0,2 N, tetapi pada variabel
HCl 0,3 N terjadi penurunan nilai
konversi dikarenakan fase aktif katalisnya
berkurang atau side katalisnya ada yang
rusak atau tidak aktif lagi sehingga
menyebabkan tidak banyak reaktan yang
terkonversi yang dihasilkan berkurang.
b. Konstanta kecepatan reaksi pada
variabel HCl 0,1 N dan HCl 0,2 N
Laboratorium Proses Kimia 2011
Anda mungkin juga menyukai
- Makalah PaiDokumen7 halamanMakalah PaidartoBelum ada peringkat
- Kinetika Reaksi EsterifikasiDokumen6 halamanKinetika Reaksi EsterifikasiFauzin NaimahBelum ada peringkat
- 7237 EsterifikasiDokumen12 halaman7237 EsterifikasiDian Remarthin GirsangBelum ada peringkat
- LuckyDokumen7 halamanLuckyFISIA AQRORINABelum ada peringkat
- Hidrolisa Pati PDFDokumen10 halamanHidrolisa Pati PDFLxsisBelum ada peringkat
- Proposal Elektroplating Paling YahudDokumen28 halamanProposal Elektroplating Paling YahuddartoBelum ada peringkat
- Bab Iv HDPDokumen2 halamanBab Iv HDPdartoBelum ada peringkat
- 09e01977 PDFDokumen103 halaman09e01977 PDFMuhammad FahruroziBelum ada peringkat
- Enzim 5 Selasa Fix InsyaallahDokumen18 halamanEnzim 5 Selasa Fix InsyaallahdartoBelum ada peringkat