Jawaban Soal Latihan Chem Equilibrium PDF
Diunggah oleh
Yayang NurwandaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Jawaban Soal Latihan Chem Equilibrium PDF
Diunggah oleh
Yayang NurwandaHak Cipta:
Format Tersedia
JAWABAN SOAL LATIHAN
KESETIMBANGAN KIMIA DAN SPONTANITAS
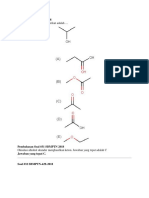
1. Untuk reaksi dekomposisi N2O4 :
N2O4(g) 2NO2(g)
Initial 1 -
Change 2
Eq 1- 2 mol total campuran = 1 - + 2 = 1 +
Maka
⁄
⁄
(a) Pada kesetimbangan G = 0
(b) Jika = 0,201, maka : 0,168
(c) rG = -RT ln K rG = -(8,314 J K mol ) 298 K ln 0,168 = 4,41 kJ mol-1
-1 -1
2. Untuk reaksi dekomposisi air :
2H2O(g) 2H2(g) + O2(g)
Initial 1 - -
change 2 2
Eq 1-2 2 mol total campuran = 1 - 2 + 2 + = 1 +
(a) Jika = 1,77% = 0,0177
(b) rG = -RT ln K rG = -(8,314 J K-1 mol -1) 2257 K ln 2,387 x 10-5 = 199,710 kJ mol-1
(c) rG = 0 (pada kesetimbangan)
3. Reaksi fasa gas: A + B C + 2D
Initial 2 1 0 3
change -0,79 -0,79 +0,79 +1,58
Eq 1,21 0,21 0,79 4,58 Total = 6,79
(a) Fraksi mol : A = 0,178 B = 0,031 C = 0,116 D = 0,675
(b)
(c) karena v = 3 – 2 = 1, dan p = 1 bar; maka
(d) rG = -RT ln K rG = -(8,314 J K-1 mol -1) x 298 K x ln 9,6 = -5,6 kJ mol-1
4. Reaksi fasa gas: 2A + B 3C + 2D
Initial 1 2 - 1
change -0,6 -0,3 +0,9 +0,6
Eq 0,4 1,7 0,9 1,6 Total = 4,6
(e) Fraksi mol : A = 0,087 B = 0,370 C = 0,195 D = 0,348
(f)
(g) karena v = 5 – 3 = 2, dan p = 1 bar; maka
(h) rG = -RT ln K rG = -(8,314 J K-1 mol -1) x 298 K x ln 0,321 = 2,815 kJ mol-1
5. Untuk reaksi CH4(g) + 3Cl2(g) CHCl3(l) + 3HCl(g); dengan bantuan tabel termodinamika
(a) rG = fG(CHCl3.l) + 3xfG(HCl.g) - fG(CH4.g) = (-73,66) + 3(-95,30) – (-50,72)
= -308,84 kJ mol-1
(b) rH = fH(CHCl3.l) + 3xfH(HCl.g) - fH(CH4.g) = -134,47 + 3(-92,31) – (-74,81)
= -336,59 kJ mol-1
( )
( )
rG (50) = -RT ln K(50) = -(8,314 J K-1 mol -1) x 323,15 K x 114,08 = -306,52 kJ mol-1
6. Untuk reaksi PbO(s) + CO(g) Pb(s) + CO2(g); dengan bantuan tabel termodinamika
(a) rG = fG(Pb.s) + fG(CO2.g) - fG(PbO.s) - fG(CO.g)
= 0 + (-394,36) - (-217,33) + (-137,17)
= -39,86 kJ mol-1
(b) rH = fH(Pb.s) + fH(CO2.g) - fH(PbO.s) - fH(CO.g) = -393,51 - (-277,4) + (-110,53)
= -5,58 kJ mol-1
( )
( )
rG (400) = -RT ln K(400) = -(8,314 J K-1 mol -1) x 400 K x 15,516 = -51,6 kJ mol-1
7. Pada temperatur 1280 K rG = +33 kJ mol-1
( ) Jika K2 = 1, maka ln K2 = 0
( )
8. Jika K mengikuti persamaan : ln K = A + B/T + C/T2
Berdasarkan hubungan :
Maka : ( )
Pada 400 K ( )
[ ( )]
9. Untuk reaksi : H2CO(g) CO(g) + H2(g)
Terdapat hubungan : dimana v adalah selisih koefisien produk dengan reaktan
Sehingga : Pada 1 bar :
Pada 2 bar :
10. Untuk reaksi : ½ N2(g) + 3/2 H2(g) NH3(g)
atau
11. Untuk reaksi : CaF2(s) Ca2+(aq) + 2F-(aq) K = 3,9 x 10-11
Diketahui kJ mol-1
-
= 59,381 – 1167 = -1107,619 kJ mol-1
Anda mungkin juga menyukai
- Soal KimiaDokumen11 halamanSoal KimianoviaprmthaBelum ada peringkat
- Bab 5 TermokimiaDokumen26 halamanBab 5 TermokimiaMalik LamendoBelum ada peringkat
- Cara Menentukan Entalpi Berdasarkan Hukum Hess Dan Energi IkatanDokumen6 halamanCara Menentukan Entalpi Berdasarkan Hukum Hess Dan Energi IkatanAini AiniBelum ada peringkat
- T Kimia Termo XiDokumen3 halamanT Kimia Termo XiLailatul Hikmah100% (1)
- Latihan Soal Termokimia PPT Dan KJDokumen9 halamanLatihan Soal Termokimia PPT Dan KJViskia MakristBelum ada peringkat
- ULANGAN HARIAN BAB 3 TERMOKIMIA - FixDokumen7 halamanULANGAN HARIAN BAB 3 TERMOKIMIA - FixNani Yuningsih PrayitnoBelum ada peringkat
- Soal KimiaDokumen11 halamanSoal KimiaRiska PradanitaBelum ada peringkat
- Term Okimi ADokumen5 halamanTerm Okimi AMala Audia SariBelum ada peringkat
- Soal Dan Pembahasan Termokimia Kelas XI IPA Soal Dan Pembahasan Termokimia Kelas XI IPADokumen19 halamanSoal Dan Pembahasan Termokimia Kelas XI IPA Soal Dan Pembahasan Termokimia Kelas XI IPAirawati sholikhahBelum ada peringkat
- Kesetimbngan KimiaDokumen4 halamanKesetimbngan KimiaNovi Chairani MasdumBelum ada peringkat
- Soal TermodinamikaDokumen9 halamanSoal TermodinamikaBali32Gede Wisnu Ambara PutraBelum ada peringkat
- Aspek Termodinamika Dan Kinetika Dalam Reaksi AnorganikDokumen7 halamanAspek Termodinamika Dan Kinetika Dalam Reaksi AnorganikẢfnì Ădrỉànâ SịnãgăBelum ada peringkat
- Jawaban TermokimiaDokumen3 halamanJawaban TermokimiaenhaadibBelum ada peringkat
- SBMPTN - Termokimia PDFDokumen38 halamanSBMPTN - Termokimia PDFHansel HendrawanBelum ada peringkat
- Lks Penentuan Entalpi ReaksiDokumen4 halamanLks Penentuan Entalpi ReaksiDevi Oktafiani100% (1)
- Ke Setim Bang AnDokumen14 halamanKe Setim Bang AnRandy PrasetyoBelum ada peringkat
- Soal KoDokumen10 halamanSoal KoEka PrasetyaningsihBelum ada peringkat
- Latihan TermokimiaDokumen4 halamanLatihan Termokimiaindah fajar watiBelum ada peringkat
- Tuliskan Persamaan Termokimia Untuk Data BerikutDokumen14 halamanTuliskan Persamaan Termokimia Untuk Data BerikutBagasAdiNugroho67% (3)
- Pembahasan UTBK Kimia 2017Dokumen8 halamanPembahasan UTBK Kimia 2017Novita SariBelum ada peringkat
- Soal Penyisihan Olkim 2014Dokumen26 halamanSoal Penyisihan Olkim 2014Nancy KawilarangBelum ada peringkat
- SoalDokumen18 halamanSoalrangga andika0% (1)
- Soal Kesetimbangan Kimia Dan Pergeseran Kimia PDFDokumen40 halamanSoal Kesetimbangan Kimia Dan Pergeseran Kimia PDFmerishintya100% (1)
- Kimia 11Dokumen3 halamanKimia 11BRAM100% (1)
- To Kimia UtbkDokumen8 halamanTo Kimia UtbkMuraBelum ada peringkat
- Tugas Chemistry - W9 - Group 8Dokumen4 halamanTugas Chemistry - W9 - Group 8Linda KurniawatiBelum ada peringkat
- Soal TERMOKIMIADokumen14 halamanSoal TERMOKIMIAky.satria0% (1)
- Soal-Soal Untuk Latihan UAS Kimia DasarDokumen10 halamanSoal-Soal Untuk Latihan UAS Kimia Dasarkhodiyasser80% (5)
- Soal Latihan KSN-K 2022 Thermodinamika Dan Kesetimbangan KimiaDokumen1 halamanSoal Latihan KSN-K 2022 Thermodinamika Dan Kesetimbangan KimiaNozar AlFarrasBelum ada peringkat
- Nurul Izzah Tugas 5Dokumen2 halamanNurul Izzah Tugas 5Hj Hajjerah TombongBelum ada peringkat
- KUNCI BAG PilganDokumen3 halamanKUNCI BAG PilganDiah Ayu NurcahyaniBelum ada peringkat
- Rangkuman Dan Soal TermokimiaDokumen12 halamanRangkuman Dan Soal TermokimiaDhea PrasiwiBelum ada peringkat
- Atennnnn SyantikkDokumen50 halamanAtennnnn SyantikkIrmha GhenesyhaBelum ada peringkat
- Presentasi KimiaDokumen23 halamanPresentasi KimiaMei Sarah SafitriBelum ada peringkat
- Soal Soal Untuk Latihan Uas Kimia DasarDokumen10 halamanSoal Soal Untuk Latihan Uas Kimia DasarRyynnBelum ada peringkat
- Soal Soal Untuk Latihan Uas Kimia Dasar PDFDokumen10 halamanSoal Soal Untuk Latihan Uas Kimia Dasar PDFRyynnBelum ada peringkat
- Kumpulan Soal Ulangan Termokimia PDFDokumen6 halamanKumpulan Soal Ulangan Termokimia PDFIvel33% (3)
- Soal Les Kimia 2014Dokumen1 halamanSoal Les Kimia 2014Saleh SmanelBelum ada peringkat
- Penentuan Perubahan Entalpi ReaksiDokumen4 halamanPenentuan Perubahan Entalpi ReaksiArdy AmrizalBelum ada peringkat
- Kelompok 2 Soal TermokimiaDokumen43 halamanKelompok 2 Soal TermokimiaBrama RizkyBelum ada peringkat
- TermokimiaaDokumen8 halamanTermokimiaaPu putBelum ada peringkat
- Term Okimi ADokumen12 halamanTerm Okimi Awisokresno100% (1)
- Pretest KSN Kimia 3Dokumen1 halamanPretest KSN Kimia 3Anita MaryanisBelum ada peringkat
- Soal Dan Pembahasan Termokimia Kelas XIDokumen19 halamanSoal Dan Pembahasan Termokimia Kelas XIBerlian Puji Rahma33% (6)
- TermokimiaDokumen3 halamanTermokimiatsania auliaBelum ada peringkat
- Tugas 2 Kelompok 13 Kimia FisikaDokumen19 halamanTugas 2 Kelompok 13 Kimia FisikaNaurah Arika AzmiBelum ada peringkat
- KimiaDokumen10 halamanKimiaJeetroSeptriantoBelum ada peringkat
- Tugas EntalpiDokumen4 halamanTugas EntalpiErlan Adiya JamillBelum ada peringkat
- SOALDokumen18 halamanSOALAzhar UmamBelum ada peringkat
- Minitest TermodinamikaDokumen3 halamanMinitest TermodinamikaMuriani Nur HayatiBelum ada peringkat
- LKS Persamaan TermokimiaDokumen11 halamanLKS Persamaan TermokimiaYudaaBelum ada peringkat
- Laju Reaksi 1Dokumen20 halamanLaju Reaksi 1Banu HermawanBelum ada peringkat
- MATERIDokumen44 halamanMATERIAndykaBelum ada peringkat