Jurnal Praktikum Injeksi
Diunggah oleh
bella khofilaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Jurnal Praktikum Injeksi
Diunggah oleh
bella khofilaHak Cipta:
Format Tersedia
JURNAL PRAKTIKUM
TEKNOLOGI SEDIAAN LIKUID DAN SEMISOLID STERIL
INJEKSI DEKSAMETASON
Disusun Oleh:
Kelompok 1/A
Zahra Zerlina (10060317043)
Ghina Zulia R (10060317044)
Bella Khofila (10060317045)
Nama Asisten: Ulfah …. , S.Farm.
Tanggal Praktikum: 2 Desember 2019
LABORATORIUM FARMASI UNIT E
PROGRAM STUDI FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS ISLAM BANDUNG
2019
INJEKSI DEXAMETASON
I. Nama Sediaan
Dexamethasone sodium phosphat
II. Kekuatan Sediaan
4 mg/ mL
III. Data Preformulasi Zat Aktif
Deksametason Natrium Fosfat
Pemerian : Serbuk hablur, putih atau agak kuning; tidak berbau atau agak
berbau etanol; sangat higroskopis (Dirjen POM, 1995: 289).
Kelarutan : Mudah larut dalam air; sukar larut dalam etanol; sukar larut
dalam dioksan; tidak larut dalam kloroform dan eter (Dirjen
POM, 1994: 289).
pH : Antara 7,0 dan 8,5 (Dirjen POM, 1979: 200)
Stabilitas : Sangat higroskopis, disterilkan dengan cara filtrasi
Inkompabilitas : Barbiturate, karbamazepin, primidon, rifampisin, aspirin.
Kegunaan : Adrenoglukokortikoidum
Penyimpanan : Dalam wadah tertutup rapat
BM Deksametason: 392,47
BM Deksametason Natrii Fosfat: 516,41
IV. Pengembangan Formula
Pada pembuatan injeksi deksametason digunakan deksametason natrium
fosfat. Karena zat aktif deksametason memiliki data kelarutan praktis tidak larut
dalam air sehingga dipilih dalam bentuk garamnya yaitu deksametason natrium
fosfat. Dimana zat aktif tersebut memiliki data kelarutan mudah larut dalam air
dibandingkan dengan zat aktif deksametason. Deksametason merupakan anti-
inflamasi glukokortikoid dan efek imunosupresif (Gahart dan Nazareno, 2014).
Dalam pembuatan injeksi dexametason natrium fosfat menggunakan zat tambahan
yaitu NaCl 0,9% dan benzalkonium klorida. Dimana dalam pembuatan sediaan
injeksi, NaCl 0,9% berperan sebagai pengatur tonisitas. Hal ini dikarenakan sediaan
injeksi harus memenuhi persyaratan isotonis artinya memiliki tonisitas yang sama
dengan cairan dalam tubuh sehingga tidak menyebabkan hemolisis jika bersifat
hipotonis dan tidak menyebabkan krenasi sel darah merah jika bersifat hipertonis.
Kemudian ditambahkan benzalkonium klorida yang berfungsi sebagai zat
pengawet. Hal ini dikarenakan metode sterilisasi yang digunakan adalah metode
sterilisasi awal secara aseptis dan dengan metode filtrasi. Meskipun sediaan injeksi
yang dibuat ini tidak digunakan secara multi dose, akan tetapi dilihat dari metode
sterilisasi yang dipilih. Sehingga penambahan zat pengawet dalam pembuatan
injeksi tersebut dibutuhkan untuk meminimalisir pencemaran mikroba dalam
injeksi pada saat pembuatan maupun saat proses pengemasan. Rentang konsentrasi
Benzalkonium klorida 0,01% bekerja sebagai pengawet pada sediaan parenteral
(Rowe et al, 2009). Kemudian pada pembuatan injeksi deksametason natrium
fosfat ini tidak ditambahkan pendapar. Hal ini dikarenakan deksametason natrium
fosfat memiliki pH stabilitas yang mendekati dari pH darah yaitu 7,4 sehingga
penggunaan zat pendapar tidak dianjurkan. Hal ini dikarenakan pH sediaan masih
dapat diterima oleh tubuh karena masuk ke dalam rentan pH darah. Selain itu, cairan
pada tubuh tidak memiliki kapasitas dapar yang besar. Kemudian dalam pembuatan
sediaan injeksi tersebut tidak ditambahkan zat antioksidan. Hal ini dikarenakan
bahan yang digunakan baik zat aktif maupun eksipien lain dan pembawa tidak
mudah mengalami oksidasi. Adapun wadah yang digunakan dalam ampul sehingga
dapat digunakan secara single dose.
V. Perhitungan Tonisitas
5.1.Perhitungan Konsentrasi zat
Deksametason Na Fosfat setara dengan E= 0,18 ∆𝑇𝑓 = 0.05
1,316g deksametason
% Benzalkonium klorida 0,01% E = 0,18 ∆𝑇𝑓 =0,048
0,01052 𝑔𝑟𝑎𝑚
% Deksametason Natrium Fosfat = 𝑥 100% = 0,526 %
2 𝑚𝑙
Ekivalensi zat
Konsentrasi
Nama Zat Aktif E ∆𝑻𝒇 (% X E)
(%)
Deksametason 0,05o
0,526 % 0,18 0,0947 %
Natrium Fosfat
Benzalkonium
0,01% 0,08 0,0008 %
klorida 0,048o
Jumlah: 0,0955 %
Berdasarkan hasil perhitungan diatas dapat diketahui bahwa sediaan injeksi
deksametason natrium fosfat masih dalam keadaan Hipotonis, sehingga diperlukan
penambahan zat pengisotonis yaitu NaCl. Adapun NaCl yang ditambahkan yaitu:
Metode ekivalensi
NaCl yang ditambahkan = 0,9% - 0,0955% = 0,8045 %
0,8045 𝑔𝑟𝑎𝑚
Bobot NaCl dalam resep = 𝑥 2 𝑚𝐿 = 0,01609 gram/ 2 mL
100 𝑚𝐿
= 16,09 mg/ 2 mL
VI. Formula Akhir
Deksametason Natrium Fosfat 10,52 mg/mL
Benzalkoinum HCl 0,0002 g
NaCl 16,09 mg
Aqua pro injeksi ad 2 mL
VII. Data Preformulasi Zat Tambahan
1. Aqua Pro Injeksi
Pemerian :Keasaman-kebasaan; ammonium; besi; tembaga; timbal;
kalsium; klorida; nitrat; sulfat; zat teroksidasi memenuhi syarat
yang tertera pada aqua destilata.
Titik didih : 100 0C
Titik Leleh : 0 0C
Kegunaan : Untuk pembuatan injeksi
Stabilitas : Air stabil secara kimiawi di semua keadaan fisik (es, cairan, dan
uap). Air yang meninggalkan sistem pemurnian farmasi dan
memasuki tangki penyimpanan harus memenuhi persyaratan
tertentu. Tujuannya saat merancang dan mengoperasikan sistem
penyimpanan dan distribusi adalah dengan menjaga agar tidak
terjadi kesalahan dalam penyimpanan.
Inkompabilitas : Dalam formulasi farmasi, air dapat bereaksi dengan obat-obatan
dan zat-zat lain yang terhidrolisis (dekomposisi pada adanya air
atau uap air) pada suhu sekitar dan tinggi. Air dapat bereaksi
keras dengan logam alkali dan cepat dengan logam alkali dan
oksida mereka, seperti kalsium oksida dan magnesium oksida.
Air juga bereaksi dengan garam anhidrat untuk membentuk hidrat
dari berbagai komposisi, dan dengan bahan organik dan kalsium
karbida tertentu.
(Ditjen POM, 1979: 97; Rowe et al, 2009: 766)
2. Benzalkoinum Klorida
Pemerian :Gel kental atau potongan seperti gelatin, putih. atau putih
kekuningan. Biasanya berbau aromatik lemah. Larutan dalam air
berasa pahit, jika dikocok sangat berbusa dan biasanya sedikit
alkali.
Kelarutan :Sangat mudah larut dalam air dan etanol, bentuk anhidrat sangat
mudah larut dalam benzen, agak sukar larut dalam eter.
Stabilitas :Benzalkonium klorida bersifat higroskopik dan mungkin
terpengaruh oleh cahaya, udara, dan logam. Stabil pada kisaran
pH dan suhu yang luas dan dapat disterilkan dengan autoklaf
tanpa kehilangan keefektifannya. Dapat disimpan dalam waktu
lama pada suhu kamar.
Inkompabilitas :Inkompatibel dengan aluminium, surfaktan anionik, sitrat, kapas,
fluoresin, hidrogen peroksida, hipromilar, iodida, kaolin, lanolin,
nitrat, surfaktan nonionik dalam konsentrasi tinggi, permanganat,
protein, salisilat, garam perak, sabun, sulfonamida, tartrat, seng
oksida, seng sulfat, beberapa campuran karet, dan beberapa
campuran plastik. Benzalkonium klorida telah ditunjukkan untuk
diadsorpsi ke berbagai membran penyaringan, terutama yang
bersifat hidrofobik atau anionik.
(Dirje POM, 1995: halaman 130; Rowe et al, 2009:halaman 59)
3. Natrium Klorida
Pemerian :Hablur berbentuk bentuk kubus, tidak berwarana atau serbuk
hablur putih, rasa asin
Kelarutan :Mudah larut dalam air, sedikit lebih mudah larut dalam air
mendidih; larut dalam gliserin; sukar larut dalam etanol.
Rentan :<0,9 % digunakan untuk larutan isotonis atau preparasi mata
Stabilitas :Larutan natrium klorida stabil namun dapat menyebabkan
pemisahan partikel kaca dari beberapa jenis wadah kaca. Larutan
dapat disterilkan dengan autoklaf atau filtrasi. Bahan padat stabil
dan harus disimpan dalam wadah tertutup rapat, di tempat yang
sejuk dan kering. Karakteristik pemadatan dan sifat mekanik
tablet dipengaruhi oleh kelembaban relatif dari kondisi
penyimpanan dimana natrium klorida disimpan
Inkompabilitas :Larutan natrium klorida berair korosif terhadap zat besi, juga
bereaksi terhadap bentuk yang sesuai dengan cairan, timbal, dan
asam kalsit. Mengoksidasi secara umum dari asam klorida dari
formula klorida. Kelarutan metilparaben pengawet antimikroba
menurun dalam larutan natrium klorida dan viskositas gel
karbomer dan larutan hidroksietil selulosa atau hidroksipropil
selulosa dikurangi dengan penambahan natrium klorida
(Ditjen POM, 1979: 97; Rowe et al, 2009: 637)
VIII. Perhitungan dan Penimbangan
8.1. Perhitungan
Deksametason diganti menjadi deksametason natrium fosfat dengan perhitungan:
𝐵𝑀 𝐷𝑒𝑘𝑠𝑎𝑚𝑒𝑡𝑎𝑠𝑜𝑛 𝑁𝑎𝑡𝑟𝑖𝑢𝑚 𝑓𝑜𝑠𝑓𝑎𝑡
Konversi dosis = X Bobot deksametason
𝐵𝑀 𝐷𝑒𝑘𝑠𝑎𝑚𝑒𝑡𝑎𝑠𝑜𝑛
516,41
Dexametason Na Fosfat = 392,47 𝒙 4 𝑚𝑔/𝑚𝑙 = 5,26 mg/ml
5,26 𝑚𝑔
= 𝑥2𝑚𝑙 = 10,52 𝑚𝑔/2𝑚𝑙
𝑚𝑙
0,01
Benzalkonium Klorida = 𝑥 2 𝑚𝑙 = 0,0002 𝑔 = 0,2 mg
100
0,80345
NaCl = 𝑥 2 𝑚𝑙 = 0,01609 𝑔
100
= 16,09 mg
8.2. Penimbangan
Perhitungan
untuk 2 mL 1 ampul (2 Untuk 10 Ampul
No Bahan
(dilebihkan mL) (20 mL)
0,5)
Deksametason Na 11 mg 10,5 mg 105 mg
1
Fosfat
Benzalkionum 0,25 mg 0,2 mg 2,0 mg
2
HCl
3 Natrium Klorida 16,09 mg 160,9 mg
4 Aqua Pro Injeksi Ad 2 mL Ad 20 mL
IX. Penentuan Metode Sterilisasi
9.1. Zat dan Alat
Nama alat Metode sterilisasi
Batang pengaduk Panas lembab (Autoklaf) atau panas kering (oven)
Corong Panas lembab (Autoklaf) atau panas kering (oven)
Gelas ukur Autoklaf
Pipet volume 10 ml Autoklaf
Buret Autoklaf
Spatel Panas lembab (Autoktaf) atau panas kering (oven)
Kaca arloji Panas lembab (Autoktaf) atau panas kering (oven)
Nama bahan Metode sterilisasi
Deksametason Natrii phosfat Filtrasi
Benzalkonium klorida Panas lembab (Autoklaf) atau filtrasi
NaCl Panas lembab (Autoklaf)
Aqua p.i Panas lembab (Autoklaf)
9.2.Sediaan
Pada metode sterilisasi injeksi deksametason, berdasarkan waktunya digunakan
metode sterilisasi awal cara aseptis karena zat aktif yang digunakan bersifat
termolabil (tidak stabil terhadap pemanasan) sehingga dengan adanya pemanasan
dapat menyebabkan penguraian zat aktif deksametason natrium fosfat. Adapun cara
sterilisasi yang digunakan yaitu dengan cara filtrasi. Hal ini dikarenakan sediaan
injeksi berupa larutan bersifat termolabil sehingga cara sterilisasi yang tepat yaitu
dengan cara sterilisasi filtrasi yang memiliki mekanisme kerja yaitu menyaring
bakteri pada membran. Pengerjaan sediaan injeksi dengan cara sterilisasi harus
dilakukan di bawah Laminar Air Flow (LAF) untuk meminimalisir adanya cemaran
dari udara sekitar ketika proses pembuatan injeksi.
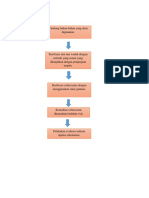
X. Prosedur Pembuatan
Dilakukan sterilisasi semua alat (batang pengaduk, corong, gelas ukur,
piper volume 10mL, dan buret) menggunakan autoklaf pada suhu
121oC selama 15menit
Prosedur selanjutnya dilakukan di LAF, ditimbang semua bahan
deksametason dan NaCl.
Dilakukan sterilisasi NaCl dan Aqua pro injeksi dengan menggunakan
autoklaf pada suhu 121oC.
Dilakukan sterilisasi deksametason Na Fosfat, deksametason dilarutkan
dengan aqua p.i yang sudah disterilisasi dalam beaker glass. Kemudian
dilakukan sterilisasi filtrasi.
Kemudian ditambahkan NaCl kedalam larutan deksametason yang
sudah disterilisasi
Setelah itu dituangkan ke dalam gelas ukur hingga volume 2 mL
Dilakukan pengecekan pH
Dituangkan larutan dalam buret steril dan tutup ujung buret dengan
menggunakan alumunium foil. Diseka jarum buret dengan kapas yang
telah dibasahi oleh alkohol 70%
Larutan dimasukan ke dalam ampul. Kemudian dilakukan gassing
(penggantian oksigen dengan nitrogen)
Ampul ditutup.
XI. Wadah dan kemasan.
Wadah yang digunakan adalah primer dan sekunder. Wadah primer yang
digunakan adalah ampul karena sifat sediaan itu single dose dan wadah sekunder
yang digunakan adalah dus.
XII. Daftar Pustaka
Direktorat Jendral Pengawasan Obat dan Makanan. (1979). Farmakope Indonesia
edisi III. Jakarta: Departemen Kesehatan Republik Indonesia.
Direktorat Jendral Pengawasan Obat dan Makanan. (1995). Farmakope Indonesia
edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia.
Direktorat Jendral Pengawasan Obat dan Makanan. (2014). Farmakope Indonesia
edisi V. Jakarta: Departemen Kesehatan Republik Indonesia.
Rowe, et al. (2009). Handbook Of Pharmaceutical Exipient ed VI. London: The
Pharmaceutical Press.
Anda mungkin juga menyukai
- MAKALAH KIMIA KLINIK - Kel 2 - PANKREASDokumen26 halamanMAKALAH KIMIA KLINIK - Kel 2 - PANKREASbella khofilaBelum ada peringkat
- Pembahasan EKSTRAKSIDokumen8 halamanPembahasan EKSTRAKSIbella khofilaBelum ada peringkat
- Penentuan Kadar Kolesterol Total - B1Dokumen21 halamanPenentuan Kadar Kolesterol Total - B1bella khofilaBelum ada peringkat
- Makalah ImmunoassayDokumen23 halamanMakalah Immunoassaybella khofila100% (1)
- Pembahasan Antidiare Bagian BellaDokumen2 halamanPembahasan Antidiare Bagian Bellabella khofilaBelum ada peringkat
- Pembahasan Antidiare Bagian BellaDokumen2 halamanPembahasan Antidiare Bagian Bellabella khofilaBelum ada peringkat
- Kadar Glukosa Darah - B1Dokumen19 halamanKadar Glukosa Darah - B1bella khofilaBelum ada peringkat
- Desain Kemasan Obat Tetes MataDokumen1 halamanDesain Kemasan Obat Tetes Matabella khofilaBelum ada peringkat
- Aliran Khawarij Dan MurjiahDokumen17 halamanAliran Khawarij Dan Murjiahbella khofila100% (3)
- Asam Karboksilat, Ester, Amida, NitrilDokumen22 halamanAsam Karboksilat, Ester, Amida, Nitrilbella khofilaBelum ada peringkat
- Asam Karboksilat, Ester, Amida, NitrilDokumen22 halamanAsam Karboksilat, Ester, Amida, Nitrilbella khofilaBelum ada peringkat
- Laporan Praktikum TSLS Salep Dan GelDokumen25 halamanLaporan Praktikum TSLS Salep Dan Gelbella khofilaBelum ada peringkat
- Brosur Salep Mata OksinDokumen1 halamanBrosur Salep Mata Oksinbella khofilaBelum ada peringkat
- Prosedur CefuroximeDokumen2 halamanProsedur Cefuroximebella khofilaBelum ada peringkat
- Mometason Krim PPT Kel 1bDokumen8 halamanMometason Krim PPT Kel 1bbella khofilaBelum ada peringkat
- Karakterisasi & Identifikasi IsolatDokumen32 halamanKarakterisasi & Identifikasi Isolatbella khofilaBelum ada peringkat
- Jurnal Infus ManitolDokumen13 halamanJurnal Infus Manitolbella khofilaBelum ada peringkat
- Brosur Infus ManitolDokumen1 halamanBrosur Infus Manitolbella khofilaBelum ada peringkat
- Jurnal Praktikum InjeksiDokumen10 halamanJurnal Praktikum Injeksibella khofilaBelum ada peringkat
- 2.larutan & ELIKSIR 2019Dokumen54 halaman2.larutan & ELIKSIR 2019bella khofilaBelum ada peringkat
- Pembahasan EKSTRAKSIDokumen8 halamanPembahasan EKSTRAKSIbella khofilaBelum ada peringkat
- 3-4. KromatografiDokumen51 halaman3-4. Kromatografirifa gidiaBelum ada peringkat
- Pembahasan EKSTRAKSIDokumen8 halamanPembahasan EKSTRAKSIbella khofilaBelum ada peringkat
- BAB IV Hasil Dan Pembahasan - G11pwuDokumen6 halamanBAB IV Hasil Dan Pembahasan - G11pwubella khofilaBelum ada peringkat
- Pembahasan EliksirDokumen2 halamanPembahasan Eliksirbella khofilaBelum ada peringkat