KIMIA
Diunggah oleh
MariamAmin 9901Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
KIMIA
Diunggah oleh
MariamAmin 9901Hak Cipta:
Format Tersedia
Pembahasan Kimia Tryout 6 Akademis.
id Reaksi sempurna 20 mL Cs3PO4 1 M
menghasilkan 3,10 g M3(PO4)2 (Ar P = 31
dan O = 16). Massa atom relatif M adalah ...
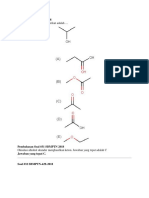
1. Reduksi dietilketon menghasilkan ….
A. 24
A.
B. 40
B.
C. 91,6
D. 120
E. 310
C.
Jawaban: C
3MCl2(s) + 2Cs3PO4(aq) → M3(PO4)2(aq) +
D. 6CsCl(g)
mol Cs3PO4 =20mL x 1M = 20mmol
mol M3(PO4)2 = 1/3 x mol Cs3PO4 =20/3
mmol
E.
Mr M3(PO4)2 = 3,1g / 20/3 mmol = 0,465
g/mmol = 465 g/mol
Jawaban: C Maka, Ar M = (465-(2x31)-(8x16))/3 = 91,6
Reduksi keton menghasilkan alkohol
sekunder. Dari semua pilihan, terdapat 3
pilihan yang merupakan alkohol sekunder, 3. Diketahui energi ikatan:
yaitu A,C dan D. Pilihan C adalah
jawabannya karena senyawa awalnya adalah C — F = 439 kj/mol F — F = 159 kj/mol
dietilketon, yang artinya ada 1 etil di sebelah
C — Cl = 330 kj/mol Cl — Cl = 243 kj/mol
kiri gugus keton dan 1 etil lagi di sebelah
kanan gugus keton. Artinya, posisi gugus Perubahan entalpi reaksi CCI2F2(g) + F2(g)
keton ada di tengah. Hasil reduksinya pun → CF4(g) + Cl2(g) adalah ....
menghasilkan gugus alkohol yang berada di
tengah. A. +622 kJ
B. +302 kJ
2. Perhatikan persamaan reaksi (belum C. +136 kJ
setara) berikut!
D. –302 kJ
MCl2(s) + Cs3PO4(aq) → M3(PO4)2(aq) +
CsCl(g) E. –622 kJ
Jawaban: D
Pada CCI2F2 , atom C memiliki 4 ikatan B. 0,32 × 10-23
dengan 2 ikatan C-Cl dan 2 ikatan C-F. Pada
hasil reaksi, terdapai 4 ikatan C-F pada CF4, C. 1,66 × 10-23
Sehingga, dapat disederhanakan menjadi 0
D. 3,16 × 10-23
ikatan C-F sebelum reaksi dan 2 ikatan C-F
setelah reaksi. E. 6,02 × 10-23
∆Henergi ikatan = kiri-kanan Jawaban: D
∆H=((2x330)+159)-((2x439)+243)= -302 kJ
1 atom/partikel = 1/(6,02 x 1023) mol
massa F = 1/(6,02 x 1023) mol x 19
4. Diketahui reaksi antiredoks dalam = 3,16 × 10-23
suasana basa sebagai berikut:
Cl2 + OH- → ClO3- + Cl-
6. Struktur Lewis senyawa amonium klorida
Dalam reaksi setara, perbandingan koefisien adalah sebagai berikut:
reaksi yang benar adalah ....
A. Cl2 : OH- = 1 : 2
B. Cl2 : Cl- = 1 : 3
C. OH- : ClO3- = 3 : 1
Yang menyatakan ikatan kovalen koordinasi
D. OH- : Cl- = 3 : 1 adalah nomor...
E. ClO3- : Cl- = 1 : 2 A. 1
B. 2
Jawaban: A
C. 3
Lakukan penyetaraan dengan cara PBO atau
setengah reaksi. D. 4
Cl2 + OH- → ClO3- + Cl- E. 5
Jawaban: B
0 +5 oks 5e
Nomor 2 adalah ikatan kovalen koordinasi
0 -1 red 1e x 5 karena elektron N digunakan H untuk
3Cl2 + 6OH- → ClO3- + 5Cl- + 3 H2O berikatan.
Jadi, Cl2 : OH- = 1 : 2
7. Gas H2 dan gas I2 bereaksi membentuk
gas HI menurut persamaan reaksi H2 +
I2 ⇌ 2HI. Jika reaksi dilakukan dalam wadah
5. Massa satu atom fluor (Ar = 19) dalam
2 L, dan pada kesetimbangan reaksi terdapat
gram adalah ....
0,1 mol H2, 0,1 mol I2, dan 0,5 mol HI,
A. 0,05 × 10-23 maka nilai Kp reaksi tersebut adalah ....
(1) Kp = Kc
(2) Kp > Kc D. 96.500/4
(3) Kp = 25 E. 96.500/5
(4) Kp = 50 Jawaban: A
Jawaban: B katode: Ag+ + e → Ag
[𝐻𝐼]^2
Kc= [𝐻2][𝐼2] anode: 2H2O → 4H+ + O2 + 4e
[0,5/𝑉]^2
mol O2 = 5,6 / 22,4 = ¼ mol
0,5^2
Kc= [0,1/𝑉][0,1/𝑉] = 0,1 𝑥 0,1 = 25
Jadi, mol elektron yang dihasilkan= 4x ¼=1
Kp= Kc (RT)∆n Q = mol e x 96500 = 96500
∆n = koefisien kanan – kiri
Kp= Kc (RT)0 = 25 10. Setelah satu tahap pemancaran sinar beta
dan 4 tahap sinar alfa maka isotop 90232Th
berubah menjadi ....
8. Kesetimbangan kimia berikut yang 212
menghasilkan produk reaksi lebih banyak A. 83 Bi
bila volumenya diperkecil adalah .... B. 83
210
Bi
A. 2NO(g) + O2(g) ⇌ 2NO2(g) C. 81
210
Ti
B. CaCO3(s) ⇌ CaO(s) + CO2(s) D. 83
216
Bi
C. 2Hl(g) ⇌ H2(g) + I2(g) E. 82
206
Pb
D. N2O4(g) ⇌ 2NO2(g) Jawaban: D
E. C(s) + O2(g) ⇌ CO2(g) 90 Th → -10ẞ + 4 24α + xyUnsur
232
Jawaban: E Untuk mengetahui komponen x dan y pada
unsur, kita dapat membuat persamaan aljabar
Volume sebanding dengan koefisien reaksi. untuk nomor massa dan nomor atom.
Maka, jika volume diperkecil reaksi yang
bergeser ke kanan (produk bertambah) 232 = 0 + (4x4) + y
adalah reaksi E. Sebab, koefisien produk
y = 216
lebih kecil daripada koefisien reaktan.
90 = -1 + (4x2) + x
x = 83
9. Pada elektrolisis larutan AgNO3 dengan
elektroda inert dihasilkan gas oksigen 5,6
liter pada STP. Jumlah listrik dalam
Coulomb yang dialirkan pada proses 11. Kalor adalah energi yang ditransfer
tersebut .... antara sistem dan lingkungan sebagai akibat
dari perbedaan suhu. Q = m x c x ∆t
A. 96.500
Dengan ketentuan m adalah massa benda (g)
B. 96.500/2 yang menerima atau melepaskan kalor
dalam suatu proses, c adalah kalor jenis dari
C. 96.500/3
benda (J g-1 °C-1) dan ∆t adalah beda suhu
antara keadaan akhir logam diberikan pada 12. Alumunium, besi, dan perak secara
tabel 1. bersamaan dipanaskan hingga 200°C.
setelah itu, ketiga logam tersebut dibiarkan
Logam Ar C (J g-1 °C-1) suhunya menurun sambil dicatat waktunya.
Berdasarkan informasi pada tabel 1 dan
gambar 1, urutan logam yang benar
Timbal 207 0,128 bedasarkan kecepatan penurunan suhu (dari
Emas 197 0,129 yang paling lambat ke yang lebih cepat)
adalah ....
Perak 108 0,233
A. Al, Fe, Ag
Tembaga 64 0,387
B. Ag, Fe, Al
Besi 56 0,449
C. Fe, Ag, Al
Alumunium 27 0,903
D. Fe, Al, Ag
Magnesium 24 1,024
E. Al, Ag, Fe
Hubungan antara kapasitas panas logam Jawaban: A
dengan massa atom relatifnya (Ar) diberikan
pada gambar dibawah ini. Q = m c ∆T
Nilai c berbanding terbalik dengan ∆T. ∆T
yang besar menandakan perubahan suhu
yang cepat. Jadi urutan perubahan suhu dari
yang lambat ke cepat diurutkan dari c yang
besar ke kecil. Al, Fe, Ag
13. Manakah diantara logam di bawah ini
- yang menyerap kalor paling banyak saat
seng memiliki kalor jenis sebesar 0,387 J g
1
°C-1, berdasarkan gambar 1 massa atom dipanaskan hingga suhu naik sebesar 10 °C
realtif Zn kira-kira adalah ....
A. 5 g besi
A. 46
B. 10 g timbal
B. 56
C. 2 g magnesium
C. 66
D. 3 g alumunium
D. 86
E. 6 g tembaga
E. 96
Jawaban: D
Jawab: C
Q = m c ∆T
-1 -1
Kalor jenis seng senilai 0,387 J g °C jika
∆T konstan 10 °C. Untuk mencari Q yang
diletakkan pada tabel 1 berada dekat dengan
besar, kita perlu hasil kali m dan c yang
tembaga. Sehingga Ar Zn tidak akan jauh
besar pula. m diketahui di soal dan c
dari tembaga. Jadi yang paling tepat adalah
diketahui di tabel.
66.
14. Berdasarkan data pada Tabel 1 dapat memiliki konsentrasi yang sama, pH larutan
diperkirakan bahwa es yang membeku lebih yang terbentuk adalah ....
cepat mencair bila diletakan di atas plat yang
A. 5 – 2 log2
terbuat dari logam ....
B. 5 + 2 log2
A. perak
C. 5 – 2 log3
B. aluminium
D. 5 + 3 log2
C. tembaga
E. 5 – 4 log2
D. besi
Jawaban: E
E. timbal
mol asam asetat = M x 450 mL=450M mmol
Jawaban: B
mol KOH = M x 50 mL = 50M mmol
Q = m c ∆T
Lewat reaksi yang setara, diperoleh sisa
Penghasil kalor/panas (Q) terbanyak untuk
reaktan setelah bereaksi hanya ada larutan
mencairkan es adalah unsur yang memiliki
asam asetat sejumlah 400M mmol, sebab
nilai c yang terbesar, yaitu aluminium.
50M mmol telah bereaksi dengan 50M
mmol KOH. Keadaan akhir ini
menimbulkan adanya larutan penyangga.
15. Reaksi pembuatan 2-butena (C4H8) dari
2–butanol dengan (H2SO4) pekat merupakan Hitung pH garam CH3COOK
reaksi .... 𝑚𝑜𝑙 𝐶𝐻3𝐶𝑂𝑂𝐻 400𝑀 𝑚𝑚𝑜𝑙
[H+] = Ka 𝑚𝑜𝑙 𝐶𝐻3𝐶𝑂𝑂𝐾 = 2 x 10-5 50𝑀 𝑚𝑚𝑜𝑙
A. eliminasi
+ -5
[H ] = 16 x 10
B. adisi
pH = - log 16 x 10-5 = 5 - log16= 5 - 4log2
C. subsitusi
D. hidrolisis
17. Larutan A dibuat dengan mencampurkan
E. kondensasi
0,1 mol NaBr dan 0,05 mol CaBr2 dalam
Jawaban: A 500gram air. Kedua garam ini terdisosiasi
sempurna dalam air. Larutan B dibuat
2-butena merupakan senyawa alkena yang dengan melarutkan 84gram urea (Mr=60)
memiliki 1 buah ikatan rangkap 2. dalam 1 kg air. Perbandingan penurunan
Sedangkan 2-butanol merupakan senyawa titik beku larutan A terhadap penurunan titik
alkohol yang semua ikatannya adalah beku larutan B adalah ....
rangkap 1. Jadi, reaksi tersebut
menghilangkan mengurangi ikatan rangkap, A. 4 : 1
yaitu reaksi eliminasi.
B. 3 : 1
C. 2 : 1
16. Sebanyak 50 mL larutan KOH
D. 1 : 1
dicampurkan dengan 450 mL larutan asam
asetat (Ka = 2 x 10-5). Kedua larutan itu E. 1 : 2
Jawaban: E Arus listrik sebesar 10 mA dialirkan pada sel
elektrolisis. Pada sel elektrolisis ini katoda
∆Tf A = Kf.(m1.i1 + m2.i2)
dicelupkan ke dalam larutan yang
∆Tf A = Kf.(n1.i1 + n2.i2)/kg pelarut mengandung ion Cu2+, H+, Pb2+, dan
Fe2+ dengan konsentrasi masing-masing 0,1
∆Tf A = Kf (0,1 x 2 + 0,05 x 3) x 2 M. Spesi yang pertama kali terbentuk pada
∆Tf A = 0,7 x Kf katoda adalah ....
∆Tf B = Kf x m = 1,4 Kf A. H2
Jadi, ∆Tf A : ∆Tf B = 1 :2 B. OH–
C. Cu
18. Perhatikan reaksi berikut: D. Pb
NO3(g) → NO2(g) + O2(g) (belum setara) E. Fe
Bila pada saat tertentu laju pengurangan gas Jawaban: C
NO3 adalah 5 mol L-1 s-1, maka laju Di katoda, selalu terjadi reduksi. Menurut
pembentukan gas O2 adalah .... deret volta, semakin besar potensial reduksi,
A. 10,0 mol L-1 s-1 maka semakin besar pula kemampuan ion
tersebut untuk tereduksi menjadi logam
B. 5,0 mol L-1 s-1 sungguhan. Oleh karena itu, spesi yang
C. 2,5 mol L-1 s-1 pertama kali terbentuk di katoda adalah Cu.
D. 1,5 mol L-1 s-1
20. Asam sianida (HCN) bersifat lebih asam
E. 0,5 mol L-1 s-1 daripada asam sianat (HOCN).
Jawaban: C SEBAB
2NO3(g) → 2NO2(g) + O2(g) Asam sianat memiliki gugus OH sehingga
laju 2x 2x x lebih bersifat basa
maka, laju pembentukan O2 = ½ x 5 = 2,5 Jawaban: E
H + (atom H) merupakan pembawa sifat
asam.
19. Nilai potensi reduksi beberapa ion
diberikan di bawah ini: Berdasarkan struktur lewis, kita peroleh
secara ringkas ikatan HCN dan juga HOCN.
Cu2+(aq) + 2e- → Cu(s) Eo = +0,340 V
H-C-N dan H-O-C-N
2H+(aq) + 2e− → H2(g) Eo = 0,000 V
Reaksi ionisasi:
Pb2+(aq) + 2e− → Pb(s) Eo = -0,126 V
HCN → H+ + CN-
Fe (aq) + 2e− → Fe(s) E = -0,440 V
2+ o
HOCN → H+ + OCN-
−
2H2O(l) + 2e− → H2(g) + 2OH (aq)
Dari struktur lewis diatas, dapat terlihat
Eo = -0,830 V bahwa pada HCN, unsur yang mengikat H
adalah C. Sebagai anion CN, unsur N lebih
elektronegatif dari C. Seharusnya unsur N
yang berikatan dengan H.
Pada HOCN, unsur yang mengikat H adalah
O. Sebagai anion OCN, unsur O lebih
elektronegatif dari C dan N. Maka, unsur O
memang yang seharusnya mengikat H.
Karena unsur O (yang paling elektronegatif)
memang unsur yang mengikat H, maka
anion OCN bersifat lebih stabil dari pada
anion CN. Oleh karena itu, HOCN lebih
mudah terionisasi. Ketika HOCN lebih
mudah terionisasi, maka anion OCN juga
lebih mudah terlepas dari kation H. Pada
saat itulah banyaknya kation H yang terlepas
berimbas pada tinggi nya pH yang
dipengaruhi oleh [H+]. Jadi, HOCN lebih
asam dari pada HCN.
Karena H pada HOCN bertindak sebagai
kation, maka tidak ada gugus OH dalam
HOCN.
Anda mungkin juga menyukai
- Soal PAS Kelas 11 Semester 1Dokumen6 halamanSoal PAS Kelas 11 Semester 1taniaBelum ada peringkat
- Pembahasan SIMAK UI 2017 KimiaDokumen6 halamanPembahasan SIMAK UI 2017 KimiaPuspaRasmi100% (3)
- Kesetimbngan KimiaDokumen4 halamanKesetimbngan KimiaNovi Chairani MasdumBelum ada peringkat
- Soal TERMOKIMIADokumen14 halamanSoal TERMOKIMIAky.satria0% (1)
- Soal Latihan 3Dokumen6 halamanSoal Latihan 3Malati Amalia MalikBelum ada peringkat
- Compass 2019Dokumen8 halamanCompass 2019Theodorus Khotler SusantoBelum ada peringkat
- Pre Test THN Ajaran 10-11Dokumen4 halamanPre Test THN Ajaran 10-11Iskandar SetiadiBelum ada peringkat
- Soal Tes Ca KimiaDokumen4 halamanSoal Tes Ca Kimiabiper purwokertoBelum ada peringkat
- Soal Usem GanjilDokumen11 halamanSoal Usem GanjilNuraini KhodaryahBelum ada peringkat
- Kumpulan Soal Kimia Dan Jawaban (14) - DikonversiDokumen7 halamanKumpulan Soal Kimia Dan Jawaban (14) - DikonversiRahma FitrianiBelum ada peringkat
- Latihan Soal KimiaDokumen6 halamanLatihan Soal Kimiatae taeBelum ada peringkat
- SBMPTN Kim 2018Dokumen6 halamanSBMPTN Kim 2018Arul Ashar ChairanBelum ada peringkat
- KJ Pembahasan TO Kimia SMA 2020Dokumen11 halamanKJ Pembahasan TO Kimia SMA 2020Sakti 20030% (1)
- KimiaUM UGM 2017 Kode 714Dokumen2 halamanKimiaUM UGM 2017 Kode 714resa fazarwatiBelum ada peringkat
- CP - Kimia 18 PDFDokumen8 halamanCP - Kimia 18 PDFNabia MakinBelum ada peringkat
- Soal Dan Pembahasan Kimia SBMPTN 2014Dokumen8 halamanSoal Dan Pembahasan Kimia SBMPTN 2014Leony Purba100% (1)
- Soal Soal LatihanDokumen2 halamanSoal Soal LatihanATHALLAH NISRINA AMANDABelum ada peringkat
- Soal KoDokumen10 halamanSoal KoEka PrasetyaningsihBelum ada peringkat
- KIMIADokumen10 halamanKIMIAtimtamsBelum ada peringkat
- Soal Dan Penjelasan TermokimiaDokumen27 halamanSoal Dan Penjelasan TermokimiaRiko Sang Guru Muda100% (3)
- ZB0053 (Kimia)Dokumen2 halamanZB0053 (Kimia)enriwawanmanurungBelum ada peringkat
- CS GenapDokumen2 halamanCS GenapCarles ParsaoranBelum ada peringkat
- Pembahasan Soal OSK Kimia Tahun 2014Dokumen7 halamanPembahasan Soal OSK Kimia Tahun 2014Ummul KhairatBelum ada peringkat
- Soal Uas DindaDokumen5 halamanSoal Uas Dindasri astutiBelum ada peringkat
- Contoh Soal KimiaDokumen15 halamanContoh Soal Kimiafirman0% (1)
- Kumpulan Soal Kimia XiDokumen13 halamanKumpulan Soal Kimia XiShintia NurulitaaBelum ada peringkat
- Kimia SIMAK UI 2010 - Bimbingan Alumni UIDokumen2 halamanKimia SIMAK UI 2010 - Bimbingan Alumni UIAaqilatul Mumtaazah HafiluddinBelum ada peringkat
- SNMPTN 2016 Kode 224Dokumen2 halamanSNMPTN 2016 Kode 224Anonymous cT5SFXu91Belum ada peringkat
- SOAL PENGAYAAN KIMIA TermokimiaDokumen16 halamanSOAL PENGAYAAN KIMIA TermokimiaNicholas HarianjaBelum ada peringkat
- SOAL PENGAYAAN KIMIA TermokimiaDokumen16 halamanSOAL PENGAYAAN KIMIA TermokimiaNicholas HarianjaBelum ada peringkat
- Soal Kimia 11 IpaDokumen15 halamanSoal Kimia 11 Ipauli_ratnaBelum ada peringkat
- Latihan Soal Kimia 1Dokumen72 halamanLatihan Soal Kimia 1Raldy RatunumanBelum ada peringkat
- Pilihan GandaDokumen6 halamanPilihan Gandabimasobari warmanBelum ada peringkat
- Soal SBMPTNDokumen9 halamanSoal SBMPTNIZZATI KHOLBelum ada peringkat
- Remidi Pas Kimia SMT 1 Tahun 2021 NewDokumen4 halamanRemidi Pas Kimia SMT 1 Tahun 2021 NewGede BadrIkaBelum ada peringkat
- Kunci KSN-K Kimia Sma 2020Dokumen18 halamanKunci KSN-K Kimia Sma 2020Fauzi Derita SaputriBelum ada peringkat
- 3.kunci KimiaDokumen18 halaman3.kunci KimiaPonda Torahunchi100% (4)
- Kunci KSN-K Kimia Sma 2020Dokumen18 halamanKunci KSN-K Kimia Sma 2020Ldk Ukdm UpiBelum ada peringkat
- Template Soal Fress - Kimia Xi-Halaman-DihapusDokumen7 halamanTemplate Soal Fress - Kimia Xi-Halaman-DihapusIsmanulloh IsmaBelum ada peringkat
- Soal Kimia Kelas XiDokumen7 halamanSoal Kimia Kelas XiNatalia Manurung NataliaBelum ada peringkat
- Pembahasan UTBK Kimia 2017Dokumen8 halamanPembahasan UTBK Kimia 2017Novita SariBelum ada peringkat
- Uh Kesetimbangan Kimia 2 2021Dokumen1 halamanUh Kesetimbangan Kimia 2 2021AndreanBelum ada peringkat
- Pembahasan Kimia 2004 PDFDokumen5 halamanPembahasan Kimia 2004 PDFEdhoSatriaBelum ada peringkat
- UMPTN + Pembahasan Tahun 1990 Kimia PDFDokumen6 halamanUMPTN + Pembahasan Tahun 1990 Kimia PDFGusda KhafizBelum ada peringkat
- Ospo 2018 - Soal - Sma KimiaDokumen10 halamanOspo 2018 - Soal - Sma KimiaErna AgustinaBelum ada peringkat
- Soal TO 1Dokumen8 halamanSoal TO 1Najla NalaBelum ada peringkat
- Soal Kimia SBMPTN 2010Dokumen2 halamanSoal Kimia SBMPTN 2010Helda WWBelum ada peringkat
- Tugas MK Kimia Olimpiade (Rahma Wati A1)Dokumen38 halamanTugas MK Kimia Olimpiade (Rahma Wati A1)Rahma WatiBelum ada peringkat
- KSNK - 2020 - Kimia - Soal - Rukim - IdDokumen14 halamanKSNK - 2020 - Kimia - Soal - Rukim - IdsifatBelum ada peringkat
- Soal KSN-K Kimia Sma 2020Dokumen14 halamanSoal KSN-K Kimia Sma 2020Fauzi Derita SaputriBelum ada peringkat
- Soal KSN-K Kimia Sma 2020Dokumen14 halamanSoal KSN-K Kimia Sma 2020Ldk Ukdm UpiBelum ada peringkat
- Tugas KimiaDokumen7 halamanTugas Kimia6.Elsahli PurbaBelum ada peringkat
- Pembahasan KimiaDokumen14 halamanPembahasan Kimiamarkus gabrielBelum ada peringkat
- Latihan Soal Senyawa Hidrokarbon & TermokimiaDokumen9 halamanLatihan Soal Senyawa Hidrokarbon & TermokimiaHeni DesuBelum ada peringkat
- Remedial KimiaDokumen13 halamanRemedial KimiaArif SualdiBelum ada peringkat
- Soal Kimia SNMPTN 2009Dokumen5 halamanSoal Kimia SNMPTN 2009Nur Hayati100% (1)
- Wa0004Dokumen20 halamanWa0004nandaBelum ada peringkat
- Uji Kompetensi TermokimiaDokumen4 halamanUji Kompetensi Termokimiamonkey pekongBelum ada peringkat