Pengenalan Alat
Diunggah oleh
Davita Margareta ZJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Pengenalan Alat
Diunggah oleh
Davita Margareta ZHak Cipta:
Format Tersedia
1
PENGENALAN ALAT- ALAT
LABORATORIUM
LAPORAN RESMI PRAKTIKUM KIMIA DASAR
I
Disusun oleh:
Davita Margareta Zacharias
15.I1.0017
Kelompok E4
PROGRAM STUDI TEKNOLOGI PANGAN
FAKULTAS TEKNOLOGI PERTANIAN UNIVERSITAS
KATOLIK SOEGIJAPRANATA SEMARANG
2015
1. TUJUAN PRAKTIKUM
Tujuan dilakukannya praktikum ini adalah untuk mengenal alat-alat yang digunakan di
laboratorium kimia, mengetahui fungsi dan cara penggunaan alat dengan benar,
mengetahui perbedaan ketelitian alat-akat ukur, mengetahui cara pembuatan larutan
NaCl, mengamati tingkat ketelitian titrasi buret pada metode lambat maupun metode
cepat, mengetahui cara mengencerkan suatu larutan, mengetahui cara melakukan titrasi,
serta mengetahui cara mengenal gas dengan menggunakan kertas lakmus.
2. TINJAUAN PUSTAKA
Laboratorium merupakan tempat yang terbaik untuk mengetahui teknik-teknik yang
diperlukan untuk analisis yang konsisten dan reproduksibel (Cairns, 2003).
Laboratorium adalah tempat yang dilengkapi dengan peralatan untuk melangsungkan
atau melakukan pengujian dan analisis. Alat laboratorium kimia merupakan benda yang
digunakan dalam kegiatan di laboratorium kimia yang dapat dilakukan berulang-ulang.
Contoh alat laboratorium kimia: tabung reaksi, gelas ukur, thermometer, pembakar
spirtus dan lain sebagainya (Poedjiadi, 1984).
Uraian beberapa peralatan yang digunakan dalam laboratorium kimia beserta fungsinya
adalah sebagai berikut :
1. Kaki tiga
Sumber : http://glasswareindonesia.indonetwork.co.id/1466586/kaki-tiga-tripod.htm
Digunakan sebagai penyangga kawat kasa untuk meletakkan bahan bahan yang
akan dipanaskan. Spiritus diletakkan di antara ketiga kakinya (Day
and Underwood, 1998).
gambar 1. Kaki tiga
2. Kasa Besi
Sumber : Sumber: http://pt-alkin-global.indonetwork.co.id/
berbentuk lingkaran, terbuat dari Kasa asbes dan digunakan
sebagai alat perata panas.
3. Penjepit
Sumber
gambar 2. Kasa Besi
tabung reaksi
http://onelaboratorytechniq.blogspot.co.id/2012/09/alat-
alat-lab.html
Digunakan untuk menjepit tabung reaksi yang sukar disentuh oleh tangan. Contoh :
panas.
4.
Sumber
gambar 3. Penjepit tabung reaksi
Pemanas air (Water Bath)
http://glassblowerjogja.com/water-
bath/
Digunakan untuk memanaskan air dengan menggunakan uap
air yang dihasilkan dari Water Bath.
5.
Sumber
gambar 4. pemanas air
Cawan Porselen
http://onelaboratorytechniq.blogspot.co.id/2012/09/alat-alat-lab.html
Digunakan untuk mereaksikan zat dalam suhu tinggi, menggabungkan kertas
saring, dan menguraikan endapan dalam gravimetric
sehingga menjadi bentuk yang stabil.
6.
Peralatan gelas harus
gambar 5. Cawan porselen
Alat-alat gelas
dicuci dan dibersihkan dahulu
sebelum digunakan. Untuk alat gelas yang terkontaminasi dipisahkan dari alat gelas
yang lain, bila perlu dilakukan sanitasi. Alat gelas juga perlu dilakukan pengecekan
bila ada kerusakan (pecah), bila ada kerusakan maka perlu diadakan perbaikan atau
dibuang. Alat gelas yang biasa digunakan di laboratorium kimia dikelompokkan
menjadi : Peralatan dasar, Peralatan ukur, dan Peralatan mereaksi zat.
Peralatan dasar
i.
Pengaduk
Pengaduk digunakan untuk mengaduk cairan atau larutan kimia.
ii.
Gelas arloji
Gelas arloji digunakan untuk wadah pada saat menimbang, untuk menutup
bejana lain saat pemanasan atau lainnya, dan untuk menguapkan suatu
iii.
cairan.
Corong
Corong digunakan untuk memasukkan atau memindah larutan air dari
bibir gelas yang besar ke bibir gelas yang kecil, dan digunakan pula untuk
proses penyaringan setelah diberi kertas saring pada bagian atas.
Peralatan ukur
Dalam percobaan kimia diperlukan alat-alat tertentu untuk melakukan percobaan
seperti mengukur volume dalam ketelitian masing-masing pada setiap alat. Dengan
menggunakan angka penting, dapat diketahui alat manakah yang mempunyai
ketelitian paling baik (Ebbing, 1997).
Terdapat tanda untuk menunjukkan batas tinggi cairan saat volume tertentu pada
alat-alat pengukur volume, berupa garis melingkar dengan melihat bagian bawah
permukaan lengkung cairan (meniskus). Meniskus tersebut dapat dilihat jika garis
tersebut terlihat seperti garis lurus segari (paralax) jika dilihat dari atas atau bawah
menisku akan terjadi kesalahan membaca Sudarmadji et al,1984).
i.
Gelas ukur
Gelas ukur dipakai untuk mengukur takaran air suling dan bahan kimia
yang akan digunakan. Terdapat berbagai macam ukuran gelas ukur mulai
dari volume 25 mL hingga mencapai volume 250 mL. Terdapat jenis gelas
ukur yang tahan panas (dari pirex) dan ada yang tidak tahan panas (dari
gelas biasa) (Hendaryono, 1994). Dalam mengukur volume, gelas ukur
mempunyai tingkat ketelitian yang kurang tepat sehingga tidak disarankan
untuk mengukur larutan dan tidak digunakan sebagai pelarut panas
ii.
(Rahardjo, 1987).
Pipet
- Pipet gondok
Dinamakan pipet gondok karena terdapat bagian yang membesar di
bagian teman dengan ujung yang meruncing, digunakan untuk
mengambil larutan dengan volume teratur dan tepat, untuk mengukur
-
volume larutan.
Pipet tetes
Digunakan untuk mengambil larutan dalam jumlah yang kecil.
Pipet ukur
Bentuk pipet ini pada semua bagiannya sama, tidak ada yang
menggembung, mempunya ukuran yang berbeda beda untuk
mengambil volume tertentu
iii.
iv.
Buret
Digunakan pada percobaan titrasi, dengan mengeluarkan cairan pada
volume tertentu.
Labu takar
Memiliki leher yang panjang dan bagian bulat di bawahnya, menyerupai
bentuk buah labu yang bertangkai panjang. Labu ukur umumnya memiliki
kapasitas antara 5 mL sampai 5 L. Fungsi utama labu ukur adalah untuk
mengencerkan suatu bahan dengan ketelitian yang sangat tinggi (Day &
v.
Underwood, 1998).
Neraca
Digunakan untuk mengukur massa. Neraca terbagi menjadi dua, yaitu
neraca kasar dan neraca halus. Neraca besar untuk menimbang dalam
jumlah besar, sedangkan neraca kecil memiliki satuan miligram untuk
menimbang jumlah sedikit. Contoh dari neraca halus adalah neraca
analitik.
Peralatan pereaksi zat
i.
Gelas piala atau gelas beku (Beaker Glass)
Digunakan untuk mereaksikan cairan dalam jumlah banyak, baik untuk
memanaskan cairan maupun membuat endapan yang banyak dan perlu
untuk disaring. Saat melakukan pemanasan, gelas piala ditutup dengan
ii.
gelas arloji dan diaduk menggunakan pengaduk (Rahardjo, 1987)
Erlenmeyer
Digunakan untuk mereaksi cairan yang tidak membuat endapan, sehingga
tidak perlu disaring. Biasa digunakan dalam percobaan titrasi. Untuk
mencampur cairan, digunakan pengocok listrik atau pengocok magnet
iii.
dengan cara diputar (Day and Underwood, 1998).
Tabung reaksi
Digunakan untuk mereaksikan cairan dalam jumlah sedikit, perlu dikocok
sesekali ke arah samping.
7. Alu dan Mortal
Digunakan untuk menghancurkan suatu bahan yang akan digunakan dengan cara
digerus.
8. Statif
Digunakan
untuk
menegakkan buret,
gelaslainnya pada saatdigunakan.
corong,
corong pisah
dan
peralatan
3. MATERI METODE
3.1. Materi
3.1.1. Alat
Alat yang digunakan dalam praktikum ini adalah tabung reaksi, Erlenmeyer, gelas ukur,
labu takar, pompa pilleus, pipet volume, pipet tetes, buret, pengaduk, gelas arloji,
penjepit, timbangan analitik, statif, klem, termometer, stopwatch, kertas lakmus, bunsen,
dan rak tabung reaksi.
3.1.2. Bahan
Bahan yang digunakan dalam praktikum ini adalah aquadestilata, NaCl, larutan H 2SO4
0,3 N, larutan NaOH, indikator PP (phenolphthalein), spiritus, kertas lakmus merah, dan
NH4Cl.
3.2. Metode
3.2.1. Ketelitian Alat-alat Ukur
Aquadestilata dituang ke dalam labu takar hingga mencapai 100 ml. Kemudian larutan
tersebut dipindahkan ke dalam gelas ukur dan dicatat ketelitiannya, kemudian larutan
tersebut dipindahkan kembali ke dalam Erlenmeyer dan ketelitiannya dicatat kembali.
3.2.2. Pembuatan Larutan NaCl
NaCl ditimbang sebanyak 3 gram, 5 gram, dan 10 gram dengan menggunakan gelas
arloji. Kemudian NaCl tersebut dilarutkan dengan aquadestilata hingga mencapai batas
100 ml di dalam labu takar. Setelah beberapa saat, perubahan yang terjadi diamati dan
dicatat perolehan datanya.
3.2.3. Tingkat Ketelitian Titrasi Buret
Buret diisi dengan air destilata pada sembarang angka. Kemudian 10 ml air destila
dikeluarkan dengan lambat dan meniskus yang terjadi (cembung, cekung, atau datar)
dicatat. Setelah beberapa menit, meniskus dilihat kembali. Kemudian dilakukan cara
yang sama tetapi air destilata dikeluarkan dengan cepat setelah itu meniskus dicatat dan
ditunggu beberapa menit.
3.2.4. Pengenceran
Dengan menggunakan pipet volume diambil 10 ml H2SO4 0,1 N. Permukaan cekung
dari zat cair tersebut harus tepat menyinggung garis tanda tera pada pipet volume.
Kemudian H2SO4 tersebut dimasukan ke dalam labu takar takar 100 ml dan diencerkan
hingga mencapai tanda tera. Lalu, konsentrasi larutan H2SO4 yang telah diencerkan
dapat dihitung dengan menggunakan rumus berikut :
V1.N1 = V2.N2
Keterangan:
V1= Volume larutan asli yang akan dipakai atau diperlukan
V2= Volume larutan standar yang akan dibuat
N1= Normalitas asli
N2= Normalitas larutan standar yang akan dibuat
3.2.5. Titrasi
Buret dicuci dengan cairan pencuci, kemudian dibilas dengan larutan standar yang akan
dipakai yaitu NaOH. Setelah itu, buret tersebut diisi dengan NaOH dan skalanya dicatat.
Kemudian 15 ml H2SO4 yang sudah dibuat dari pengenceran tadi diambil dengan
menggunakan pipet volume dan larutan H2SO4 dimasukan ke dalam Erlenmeyer lalu 3
sampai 4 tetes indikator PP ditambahkan. Keran buret dibuka, dan perlahan-lahan titran
diteteskan ke dalam Erlenmeyer sambil Erlenmeyer digoyang perlahan-lahan. Titran
dihentikan ketikan penambahan setetes NaOH memberikan warna merah muda yang
sangat muda dan tidak hilang saat penggoyanga. Kemudian ketinggian cairan dalam
buret dilihat dan ml larutan standar yang digunakan dicatat. Molaritas NaOH setelah
dilakukan titrasi dapat dihitung dengan menggunakan rumus berikut :
V1.N1 = V2.N2
Keterangan:
V1= Volume larutan asli yang akan dipakai atau diperlukan
V2= Volume larutan standar yang akan dibuat
N1= Normalitas asli
N2= Normalitas larutan standar yang akan dibuat
3.2.6. Pengenalan Gas dengan Kertas Lakmus
Sebanyak 2 ml larutan NH4Cl dimasukan ke dalam tabung reaksi dan 2 ml larutan
NaOH ditambahkan. Kemudian tabung reaksi tersebut dipengang dengan menggunakan
penjepit dan dipanaskan sambil digoyang-goyangkan. Mulut tabung harus sedikit
dicondongkan tetapi tidak boleh diarahkan pada diri sendiri atau kepada orang lain. Saat
air mendidih, zat dalam tabung dijaga agar tidak keluar dari mulut tabung dengan cara
tabung diangkat dari atas api bola zat dalam tabung sudah mulai naik atau hampir
keluar. Zat dibaui dengan cara dikipas-kipas menggunakan tangan di atas mulut tabung
dan hidung pada jarak yang relatif jauh kemudian bau gas tersebut dicatat dan diamati
sebelum dan sesudah zat tersebut bereaksi. Kemudian kertas lakmus merah dipegang di
dekat mulut tabung dan perubahan warna yang terjadi pada kertas lakmus tersebut
diamati lalu dicatat dan diberi kesimpulan.
4. HASIL PENGAMATAN
4.1. Ketelitian Alat-alat Ukur
Hasil pengamatan ketelitian alat-alat ukur dapat dilihat pada Tabel 1.
Tabel 1. Ketelitian Alat-alat Ukur
Kelompok
Alat
Ketelitian (ml)
E1
Labu takar
Gelas ukur
Erlenmeyer
Labu takar
Gelas ukur
Erlenmeyer
Labu takar
Gelas ukur
Erlenmeyer
Labu takar
Gelas ukur
Erlenmeyer
100
<100
>100
100
100
>100
100
>100
>100
100
100
100
E2
E3
E4
E5
Labu takar
100
Gelas ukur
100
Erlenmeyer
>100
E6
Labu takar
100
Gelas ukur
>100
Erlenmeyer
>100
Pada tabel 1 dapat dilihat bahwa volume aquadestilata pada tiap alat berbeda-beda.
Setiap kelompok mempunyai hasil ketelitian yang berbeda-beda, setelah dipindahkan
dari labu takar ke gelas ukur dan ke gelas erlenmeyer.
4.2. Pembuatan Larutan NaCl
Hasil pengamatan pembuatan larutan NaCl dapat dilihat pada Tabel 2.
Tabel 2. Tabel pembuatan larutan NaCl
Kelompok
Massa NaCl (g)
Pengamatan
E1
3
Ada gelembung, tidak ada endapan, tidak keruh
E2
5
Tidak ada gelembung, tidak ada endapan, tidak keruh
E3
10
Tidak ada gelembung, tidak ada endapan, tidak keruh
E4
3
Ada gelembung, tidak ada endapan, tidak keruh
E5
5
Ada gelembung, tidak ada endapan, keruh
E6
10
Tidak ada gelembung, tidak ada endapan, tidak keruh
Pada tabel 2 dapat dilihat bahwa larutan yang terbuat dari 3 gram NaCl memiliki tingkat
kekeruhan yang paling rendah dan larutan yang terbuat dari 10 gram NaCl memiliki
tingkat kekeruhan yang paling tinggi.
4.3. Ketelitian Titrasi Buret
Hasil pengamatan ketelitian titrasi buret dapat dilihat pada Tabel 3.
Tabel 3. Tabel ketelitian Titrasi Buret
Kelompok
E1
E2
Metode
Lambat
Cepat
Lambat
Cepat
Volume (ml)
Waktu (s)
10
10
10
10
602
52
82
4
Pengamatan
Meniskus cekung
Meniskus cekung
Meniskus cekung
Meniskus cekung
10
E3
Lambat
10
329
Meniskus cekung
Cepat
10
34
Meniskus cekung
E4
Lambat
10
952
Meniskus cekung
Cepat
10
173
Meniskus cekung
E5
Lambat
10
85
Meniskus cekung
Cepat
10
49
Meniskus cekung
E6
Lambat
10
359
Meniskus cekung
Cepat
10
39
Meniskus cekung
Pada tabel 3 dapat dilihat bahwa pada metode cepat maupun lambat, meniskus pada
buret berbentuk cekung.
4.4. Pengenceran
Hasil pengamatan pengenceran dapat dilihat pada Tabel 4.
Tabel 4. Tabel pengenceran
Kelompok
Vol H2SO4 awal
Konsentrasi
Vol H2SO4
Konsentrasi
(ml)
awal (N)
akhir (ml)
akhir (N)
E1
10
0,1
100
0,01
E2
10
0,1
100
0,01
E3
10
0,1
100
0,01
E4
10
0,1
100
0,01
E5
10
0,1
100
0,01
E6
10
0,1
100
0,01
Pada tabel 4 dapat dilihat bahwa konsentrasi H2SO4 awal pada volume 10 ml lebih besar
daripada konsentrasi H2SO4 akhir pada volume 100 ml.
4.5. Titrasi dengan Buret
Hasil pengamatan titrasi dengan biuret dapat dilihat pada Tabel 5.
Tabel 5. Tabel titrasi dengan Buret
Kelompok
Volume NaOH (ml)
Normalitas (N)
E1
E2
E3
E4
E5
E6
1,9
1,9
0,8
1,2
1,6
1,8
0,08
0,08
0,19
0,13
0,09
0,08
11
Pada tabel 5 dapat dilihat bahwa untuk menitrasi 15 ml H 2SO4 membutuhkan larutan
NaOH yang berbeda-beda pada masing-masing kelompok. Kelompok E1, E2 sebanyak
1,9 ml; kelompok E3 sebanyak 0,8 ml; kelompok E4 sebanyak 1,2 ml; kelompok E5
sebanyak 1,6 ml; kelompok E6 sebanyak 1,8 ml.
4.6. Pengenalan Gas dengan Kertas Lakmus
Hasil pengamatan pengenalan gas dengan kertas lakmus dapat dilihat pada Tabel 6.
Tabel 6. Tabel pengenalan gas dengan kertas lakmus
Kelompok
E1
Gas yang
terbentuk
NH3
E2
NH3
E3
NH3
E4
NH3
E5
NH3
E6
NH3
Pada tabel 6 dapat
Sifat
Bau
Warna
Lakmus biru biru, lakmus
merah biru
basa Menyengat Lakmus biru biru, lakmus
merah biru
basa Menyengat Lakmus biru biru, lakmus
merah biru
basa Menyengat Lakmus biru biru, lakmus
merah biru
basa Menyengat Lakmus biru biru, lakmus
merah biru
basa Menyengat Lakmus biru biru, lakmus
merah biru
dilihat bahwa terbentuk gas berupa gas NH3. Gas bersifat basa
basa
Menyengat
sehingga merubah lakmus merah menjadi biru, memiliki bau menyengat yang tidak
enak.
5. PEMBAHASAN
12
Pada percobaan ketelitian alat-alat ukur, pertama-tama dilakukan dengan penuangan
aquadestilatas sebanyak 100 ml pada labu takar, kemudian aquadestilata dipindahkan ke
gelas ukur, ternyata didapatkan hasil kurang dari 100 ml pada gelas ukur, setelah itu
aquadestilata dipindahkan ke erlenmeyer, dan didapatkan hasil aquadestilata melebihi
100 ml.
Perbedaan skala volume pada tiap-tiap alat menunjukkan adanya perbedaan ketelitian
pada suatu alat. Suatu alat ukur memiliki ketelitian yang berbeda-beda. Dari ketiga alat
yang digunakan dalam percobaan ini, labu takar memiliki tingkat ketelitan yang paling
tinggi dibandingkan gelas ukur dan erlenmeyer. Labu takar digunakan untuk
mengetahui konsentrasi baru saat mengencerkan suatu larutan sampai seteliti-telitinya
(Day & Underwood, 1998). Sedangkan gelas ukur mempunyai tingkat ketelitian yang
kurang tepat sehingga tidak disarankan untuk mengukur larutan dan tidak digunakan
sebagai pelarut panas (Rahardjo, 1987). Erlemeyer digunakan untuk mereaksikan zat,
biasa ditemukan dalam percobaan titrasi bukan untuk mengukur volume larutan.
Pada percobaan pembuatan larutan NaCl pertama-tama NaCl timbang sebanyak 3 gram,
5 gram, dan 10 gram diatas gelas arloji menggunakan neraca analitik, kemudian NaCl
tersebut dilarutkan dengan aquadestialat menggunakan labu takar hingga mencapai 100
ml dan didapatkan hasil pengamatan yang berbeda-beda pada setiap penambahan massa
NaCl yang berbeda.
Pada larutan 3 gram NaCl terdapat gelembung, tidak terdapat endapan, dan tidak keruh.
Pada larutan 5 gram NaCl terdapat hasil pengamatan yang berbeda antara kelompok E2
dan E5, pada kelompok E2 didapatkan hasil pengamatan tidak terdapat gelembung,
tidak terdapat endapan, tidak keruh, sedangkan pada kelompok E5 didapatkan hasil
pengamatan terdapat gelembung, tidak terdapat endapan dan tidak keruh. Hal ini
mungkin terjadi akibat kesalahan saat percobaan, pada saat penimbangan NaCl dengan
gelas arloji diatas neraca analitik tidak mendapatkan gram yang benar, atau pada saat
melarutkan NaCl dengan aquadestilata hingga mencapai 100 ml terjadi kesalahan
paralaks mengakibatkan volume menjadi lebih atau kurang dari 100 ml. Pada larutan 10
gram NaCl didapatkan hasil pengamatan tidak terdapat gelembung, tidak terdapat
endapan, tidak keruh.
13
Terdapat dua komponen pada larutan yaitu pelarut (solvent) dan zat terlarutnya (solute).
Jumlah pelarut lebih besar dibandingkan jumlah zat terlarut untuk menghasilkan suatu
larutan (Harjadi, 1993). Suatu larutan dapat terjadi endapan jika massa zat terlarut lebih
besar dibandingkan masa pelarutnya, hal itu akan menyebabkan zat terlarut mengendap
di dasar pelarutnya.
Pada percobaan tingkat ketelitian titrasi buret dilakukan dua metode dalam melakukan
titrasi, yaitu metode cepat dan lambat. Pertama-tama buret diisi dengan air destila pada
sembarang angka (kurang lebih 20 ml) dan sebanyak 10 ml dikeluarkan dengan metode
lambat kemudian amati meniskusnya dan diukur waktunya. Pada percobaan kedua
dilakukan hal yang sama tetapi air destila dikeluarkan dengan metode cepat dengan
diukur waktunya dan diamati meniskusnya.
Pada percobaan ini didapatkan hasil meniskus cekung pada kedua metode, cepat
maupun lambat. Akan tetapi pada setiap kelompok dibutuhkan waktu yang berbedabeda untuk melakukan kedua metode tersebut, hal ini dapat terjadi karena pengertian
cepat dan lambat tiap kelompok berbeda-beda, pada metode lambat tidak semua
kelompok melakukan dengan kecepatan yang sama, begitupun dengan dilakukannya
metode cepat. Sehingga didapatkan hasil waktu yang berbeda-beda antar tiap kelompok
untuk mengeluarkan 10 ml larutan dari buret.
Metode lambat lebih efektif untuk melakukan titrasi dibandingkan dengan
melakukannya menggunakan metode cepat. Pada metode lambat meniskus pada larutan
akan tetap karena larutan yang dikeluarkan dari buret dengan cara perlahan-lahan tidak
meninggalkan sisa cairan di dinding buret, sedangkan pada metode cepat larutan akan
tertinggal di dinding buret, larutan yang tertinggal di dinding buret akan turun dan
mengubah kembali meniskus yang sudah ditentukan, hal ini akan merubah volume yang
telah di keluarkan tidak tepat. Maka titrasi dengan metode lambat lebih efektif
dibandingkan dengan metode cepat.
Percobaan pengenceran ini dilakukan dengan cara mengencerkan 10 ml larutan H 2SO4
0,1 N dengan aquadestilata dalam labu takar hingga mencapai 100 ml. Pengenceran
dengan menggunakan labu takar ini harus sekali jadi, dengan maksud tidak boleh
membuang zat yang lebih dari batas karena akan mengakibatkan kesalahan paralax,
dengan begitu digunakan pipet tetes saat larutan sudah hampi dekat dengan tanda tera
14
(Petrucci, 1992). Setelah dilakukan pengenceran, didapatkan hasil konsentrasi H 2SO4
berubah dari 0,1 N menjadi 0,01 N dengan menggunakan rumus V1.N1 = V2.N2.
Hal tersebut dapat terjadi karena molaritas larutan akan menjadi lebih kecil
dibandingkan dengan ketika larutan tersebut masih berupa larutan pekat setelah
dilakukannya pengenceran (Day & Underwood 1992).
Percobaan titrasi dilakukan dengan mengisi buret dengan NaOH, kemudian digunakan
hasil dari percobaan pengenceran yang dituangkan kedalam erlenmeyer dan
ditambahkan indikator PP sebanyak 3 sampai 4 tetes. Sehingga terjadi Perubahan warna
saat mencapai titik akhir titrasi. Perubahan warna tersebut dapat dilihat dengan
menggunakan zat penunjuk yang dinamakan indikator (Petrucci, 1992).
Fungsi dari indikator PP ini untuk menentukan titik akhir titrasi dimana larutan akan
berwarna merah yang sangat muda sebagai tanda bahwa larutan telah mencapai titik
akhir titrasi. Titrasi dilakukan dengan keran buret dibuka dan ditetes dengan perlahanlahan ke dalam erlenmyer dengan menggoyang-goyangkan dengan perlahan. Titrasi
dapat dihentikan setelah larutan menghasilkan warna merah yang sangat muda.
Kemudian catat berapa ml larutan standar (NaOH) yang dibutuhkan, kemudian di
dapatkan konsentrasi larutan standar (NaOH) dengan menggunakan rumus V1.N1 =
V2.N2.
Didapatkan hasil volume NaOH yang dibutuhkan berbeda-beda tiap kelompok. Pada
kelompok E1, E2 membutuhkan volume NaOH sebesar 1,9 ml dan kelompok E6
membutuhkan volume NaOH sebesar 1,8 ml sehingga didapatkan konsentrasi NaOH
0,08 N. Pada kelompok E3 membutuhkan volume NaOH sebesar 0,8 ml sehingga
didapatkan konsentrasi NaOH 0,19 N. Pada kelompok E4 membutuhkan volume NaOH
sebesar 1,2 ml sehingga didapatkan konsentrasi NaOH 0,13 N. Pada kelompok E5
dibutuhkan volume NaOH sebesar 1,6 ml sehingga didapatkan konsentrasi NaOH 0,09
N.
Hal tersebut dapat terjadi karena tiap kelompok mnghentikan proses titrasi pada saat
keadaan yang berbeda-beda. Beberapa kelompok menghentikan proses titrasi saat
larutan berwarna merah sangat muda, sedangkan kelompok lain menghentikan proses
15
titrasi saat larutan berwarna merah muda yang sangat jelas dilihat. Hal ini yang
mengakibatkan volume NaOH yang dibutuhkan tiap kelompok berbeda-beda.
Hambatan dalam melakukan titrasi ini adalah dalam menentukan titik akhir titrasi. Saat
mendekati titik akhir titrasi diperlukan kehati-hatian agar warna merah muda yang
dihasilkan tidak sampai melawati warna yang sudah ditentukan, warna yang dihasilkan
warna merah yang sangat muda, bukan warna ungu.
Untuk menentukan volume NaOH yang dibutuhkan, harus melihat meniskus cekung
yang terdapat pada buret. Meniskus dapat terjadi cekung maupun cembung, meniskus
cekung dapat terjadi jika adhesi lebih besar dari kohesi, sedangkan meniskus cembung
dapat terjadi jika kohesi lebih besar dari adhesi. Kohesi merupakan gaya tarik menarik
antar partikel yang sejenis, sedangkan adhesi merupakan gaya tarik menarik antar
partikela yang tidak sejenis.
Pada percobaan pengenalan gas dengan kertas lakmus dilakukan dengan mencampurkan
2 ml larutan NH4Cl dengan 2 ml larutan NaOH yang kemudian dipanaskan. Gas yang
dihasilkan dapat di baui dengan mengipas-ngipaskan tangan dan kertas lakmus sebagai
indikator didekatkan pada mulut tabung agar didapatkan sifat dari gas tersebut. Dengan
menggunakan kertas lakmus merah dan kertas lakmus biru, dapat ditentukan apakah gas
tersebut bersifat asam, basa ataupun netral. kertas lakmus merah akan berubah menjadi
warna biru jika dikenai senyawa yang sifatnya basa, sedangkan kertas lakmus biru kaan
berubah menjadi warna merah jika dikenai senyawa yang sifatnya asam (Busch, 1978).
Dari percobaan ini didapatkan hasil gas yang terbentuk merupakan gas NH 3 yang
bersifat basa, hal itu dapat dikehatui dengan melihat kertas lakmus merah berubah
menjadi biru dan kertas lakmus biru yang tetap menjadi biru.
16
6. KESIMPULAN
Alat-alat ukur memiliki tingkat ketelitian yang berbeda-beda.
Labu takar merupakan alat ukur dengan tingkat ketelitian yang paling tinggi.
Tiap alat laboratorium terbuat dari bahan yang berbeda-beda dan memiliki fungsi
masing-masing.
Terdapat beberapa alat laboratorium memiliki fungsi yang sama.
Banyaknya zat terlarut menghasilkan hasil pengamatan yang berbeda-beda
tergantung dari banyaknya zat terlarut.
Untuk menentukan meniskus dalam buret, metode lambat lebih efektif dibandingkan
dengan metode cepat.
Dalam melihat meniskus mata harus sejajar dengan tanda tera agar tidak terjadi
kesalahan paralaks.
Pengenceran menghasilkan konsentrasi berubah menjadi lebih kecil.
Untuk melakukan titrasi digunakan indikator PP untuk menentukan titik akhir titrasi.
Titik akhir titrasi menggunakan indikator PP ditandai dengan warna merah muda
pada larutan.
Pada titrasi untuk menentukan konsentrasi larutan standar dapat digunakan rumus
V1.N1 = V2.N2
Penggunaan indikator kertas lakmus digunakan untuk menentukan larutan bersifat
asam atau basa.
Gas NH3 yang terbentuk bersifat basa.
Semarang, 11 November 2015
Asisten Dosen:
-
Fellycia Devi P
Melisa Vicilia
Davita Margareta Zacharias
15.I1.0017
7. DAFTAR PUSTAKA
Busch, D. H ; H. Shull & R. T. Conley. (1978). Chemistry 2nd ed. Allyn and Bacon Inc.
17
Cairns, Donald. 2003. Intisari Kimia Farmasi Edisi Kedua. Buku Kedokteran EGC,
Jakarta.
Day, R.A. Jr & A.L. Underwood. (1992). Analisis Kimia Kuantitatif, edisi kelima.
Erlangga. Jakarta.
Day, R.A. Jr & A.L. Underwood. (1998). Analisa kimia kuantitatif, edisi Revisi,
terjemahan R.Soedoro dkk. Erlangga, Jakarta.
Ebbing, D. B. (1987). General Chemistry. Houghton Mifflin Company. Boston.
Hendaryono, Daisy P. Sriyanti. 1994. Teknik kultur jaringan. Kanisius, Yogyakarta.
Petrucci, R. H. (1992). Kimia Dasar Prinsip Modern dan Terapan Erlangga. Jakarta.
Poedjiadi, Anna. 1984. Buku Pendoman Praktikum dan Manual Alat Laboratorium
Pendidikan Kimia. Departemen Pendidikan dan Kebudayaan, Jakarta.
Rahardjo, Sentot Budi (1987). Buku Petunjuk Kuliah Praktikum Kimia Dasar.
Universitas Sebelas Maret. Surakarta.
Sudarmadji,S., Bambang H. & Suhardi. (1984). Prosedur Analisa untuk Bahan
Makanan & Pertanian.Liberty.Yogyakarta.
8. LAMPIRAN
8.1. Perhitungan
~ Pengenceran
18
Diketahui:
V2 = 100 ml
V1 = 10 ml
N1 = 0,1 N
Ditanya:
N2?
Jawab:
V1.N1 = V2.N2
N2 =
V 1 X N1
V2
N2 =
10 X 0,1
100
N2 = 0,01 N
~ Titrasi Dengan Biuret
E1)
Diketahui:
V 1 = V NaOH = 15 ml
N 1 = N H2SO4 = 0,01 N
V 2 = V H2SO4 = 1,9 ml
Ditanya: N NaOH (N2)?
Jawab:
V1.N1 = V2.N2
N2 =
V 1 X N1
V2
N2 =
15 X 0,01
1,9
N2 = 0,08 N
E2)
Diketahui:
V 1 = V NaOH = 15 ml
N 1 = N H2SO4 = 0,01 N
V 2 = V H2SO4 = 1,9 ml
Ditanya: N NaOH (N2)?
Jawab:
V1.N1 = V2.N2
19
N2 =
V 1 X N1
V2
N2 =
15 X 0,01
1,9
N2 = 0,08 N
E3)
Diketahui:
V 1 = V NaOH = 15 ml
N 1 = N H2SO4 = 0,01 N
V 2 = V H2SO4 = 0,8 ml
Ditanya: N NaOH (N2)?
Jawab:
V1.N1 = V2.N2
N2 =
V 1 X N1
V2
N2 =
15 X 0,01
0,8
N2 = 0,13 N
E4)
Diketahui:
V 1 = V NaOH = 15 ml
N 1 = N H2SO4 = 0,01 N
V 2 = V H2SO4 = 1,2 ml
Ditanya: N NaOH (N2)?
Jawab:
V1.N1 = V2.N2
N2 =
V 1 X N1
V2
N2 =
15 X 0,01
1,2
N2 = 0,13 N
E5)
Diketahui:
V 1 = V NaOH = 15 ml
20
N 1 = N H2SO4 = 0,01 N
V 2 = V H2SO4 = 1,6 ml
Ditanya: N NaOH (N2)?
Jawab:
V1.N1 = V2.N2
N2 =
V 1 X N1
V2
N2 =
15 X 0,01
1,6
N2 = 0,09 N
E6)
Diketahui:
V 1 = V NaOH = 15 ml
N 1 = N H2SO4 = 0,01 N
V 2 = V H2SO4 = 1,8 ml
Ditanya: N NaOH (N2)?
Jawab:
V1.N1 = V2.N2
N2 =
V 1 X N1
V2
N2 =
15 X 0,01
1,8
N2 = 0,08 N
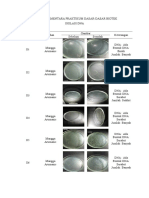
8.2. Laporan Sementara
Anda mungkin juga menyukai
- Drinking YogurtDokumen16 halamanDrinking YogurtDavita Margareta ZBelum ada peringkat
- Pengenalan AlatDokumen20 halamanPengenalan AlatDavita Margareta ZBelum ada peringkat
- 5 AnabolismeDokumen14 halaman5 AnabolismeDavita Margareta ZBelum ada peringkat
- DietaryDokumen5 halamanDietaryDavita Margareta ZBelum ada peringkat
- Permanganometri, Iodimetri Dan Argentometri: Laporan Resmi Praktikum Kimia Dasar IDokumen37 halamanPermanganometri, Iodimetri Dan Argentometri: Laporan Resmi Praktikum Kimia Dasar IDavita Margareta ZBelum ada peringkat
- Asidi AlkaliDokumen40 halamanAsidi AlkaliDavita Margareta ZBelum ada peringkat
- Hasil Pengamatan Kuantitatif Protein Kloter DDokumen8 halamanHasil Pengamatan Kuantitatif Protein Kloter DDavita Margareta ZBelum ada peringkat
- Pembahasan Protein 3 Dan 6Dokumen2 halamanPembahasan Protein 3 Dan 6Davita Margareta ZBelum ada peringkat
- DagingDokumen19 halamanDagingDavita Margareta ZBelum ada peringkat
- Lapres Isolasi DNADokumen2 halamanLapres Isolasi DNADavita Margareta ZBelum ada peringkat
- LIPOLISISDokumen1 halamanLIPOLISISPujangga PuspitoBelum ada peringkat
- Permanganometri, Iodimetri Dan Argentometri: Laporan Resmi Praktikum Kimia Dasar IDokumen37 halamanPermanganometri, Iodimetri Dan Argentometri: Laporan Resmi Praktikum Kimia Dasar IDavita Margareta ZBelum ada peringkat
- Haspeng KarboDokumen10 halamanHaspeng KarboDavita Margareta ZBelum ada peringkat
- Pengenalan AlatDokumen20 halamanPengenalan AlatDavita Margareta ZBelum ada peringkat
- Asidi AlkaliDokumen40 halamanAsidi AlkaliDavita Margareta ZBelum ada peringkat
- Kata PengantarDokumen1 halamanKata PengantarDavita Margareta ZBelum ada peringkat
- KrebsDokumen2 halamanKrebsDavita Margareta ZBelum ada peringkat
- Cover Karya TulisDokumen1 halamanCover Karya TulisDavita Margareta ZBelum ada peringkat
- Kunci JawabanDokumen1 halamanKunci JawabanDavita Margareta ZBelum ada peringkat
- Penge Sah AnDokumen2 halamanPenge Sah AnDavita Margareta ZBelum ada peringkat