XI Termokimia
Diunggah oleh
Korin230 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
3 tayangan1 halamanJudul Asli
XI_Termokimia
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
3 tayangan1 halamanXI Termokimia
Diunggah oleh
Korin23Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 1
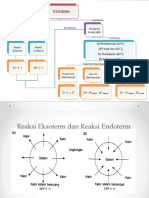
Termokimia B.
JENIS-JENIS ENTALPI REAKSI
A. PERSAMAAN TERMOKIMIA ❖ Entalpi pembentukan standar (ΔH°f) =
Perubahan entalpi reaksi pembentukan 1
Dalam suatu perubahan materi, baik mol senyawa dari unsur-unsurnya
perubahan fisika maupun perubahan kimia ❖ Entalpi penguraian standar (ΔH°d) =
(reaksi kimia) selalu disertai dengan Perubahan entalpi reaksi penguraian 1 mol
perubahan energi yang berupa perpindahan senyawa menjadi unsur-unsurnya
kalor. Perpindahan kalor pada tekanan tetap * Entalpi penguraian standar adalah
disebut perubahan entalpi (ΔH). kebalikan entalpi pembentukan standar
* Unsur-unsur memiliki ΔH°f = 0
Ditinjau dari perubahan entalpinya, reaksi
kimia dapat dikelompokkan menjadi dua jenis Terdapat 3 jenis unsur: monoatomik,
diatomik (H2, N2, O2, F2, Cl2, Br2, I2) dan
yaitu :
poliatomik.
REAKSI KIMIA ΔH suatu reaksi dapat dihitung bila ΔH°f
semua reaksi diketahui, dengan rumus :
ΔH = Ʃ ΔH°f kanan – Ʃ ΔH°f kiri
REAKSI ENDOTERM REAKSI EKSOTERM
❖ Entalpi pembakaran standar (ΔH°c) =
Reaksi yang Reaksi yang
memerlukan energi menghasilkan energi
Perubahan entalpi reaksi pembakaran 1
(menyerap kalor) (melepas kalor) mol suatu zat dengan gas O2
Ciri-ciri reaksi pembakaran :
Kalor berpindah dari Kalor berpindah dari - Merupakan reaksi eksoterm
lingkungan ke sistem sistem ke lingkungan - Melibatkan oksigen (O2) dalam reaksinya
- Karbon terbakar menjadi CO2, hidrogen
ΔH = (+) ΔH = (-) terbakar menjadi H2O, nitrogen terbakar
Diagram tingkat energi : Diagram tingkat energi : menjadi NO2, belerang terbakar menjadi
SO2
Contoh :
Diketahui ΔH°c C = -393,5 kJ mol-1, berapa kalor
yang terjadi pada pembakaran 480 gram
karbon? (Ar C = 12)
Jawab :
𝑚 480
n C (karbon) = = = 40 mol
𝐴𝑟 12
Jumlah kalor dibebaskan = n C x ΔH°c C
Persamaan kimia yang dilengkapi dengan ΔH
= 40 x 393,5
disebut persamaan termokimia.
= 15,740 kJ
Contoh :
Latihan Soal
1. H2 (g) + ½O2 (g) → H2O(l) ΔH = -285,5 kJ Kerjakan soal berikut, tulis di selembar kertas !
Persamaan termokimia ini menunjukkan 1. Sebuah arang (karbon) apabila dibakar
bahwa reaksi pembentukan 1 mol air dengan oksigen menjadi CO2 dan H2O,
disertai dengan perpindahan kalor dari akan dilepaskan kalor sebesar 393,5
sistem ke lingkungan sebesar 285,5 kJ. kJ/mol. Tuliskan persamaan
termokimia dan diagram energinya !
2. 2H2O(g) + O2(g) → 2H2O9(l) ΔH = -571,0 kJ
2. Perubahan entalpi pembakaran
Persamaan termokimia ini menunjukkan standar (ΔH°c) metanol (CH3OH)
bahwa reaksi pembentukan 2 mol air adalah -638,5 kJ/mol. Berapa kalor
disertai dengan perpindahan kalor dari yang dibebaskan untuk pembakaran
sistem ke lingkungan sebesar 571,0 kJ. 640 gram metanol ? (Ar C = 12, H = 1,
O = 16)
Anda mungkin juga menyukai
- TERMOKIMIADokumen37 halamanTERMOKIMIATM-21-084 RIFQI TUBAGUS HILMIBelum ada peringkat
- TermokimiaDokumen8 halamanTermokimiaDian DamayantiBelum ada peringkat
- Felisa M. Termokimia NotesDokumen4 halamanFelisa M. Termokimia NotesFelisa MutiarahmaBelum ada peringkat
- TermokimiaDokumen36 halamanTermokimiamuhamad pajrulBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Termo Materi Dan SoalDokumen2 halamanTermo Materi Dan SoalPipen 5Belum ada peringkat
- Pertemuan 7 - TermokimiaDokumen8 halamanPertemuan 7 - TermokimiaAdelia NurulBelum ada peringkat
- Pertemuan 7 - TermokimiaDokumen8 halamanPertemuan 7 - TermokimiaAdelia NurulBelum ada peringkat
- Jawaban Dari Soal-SoalDokumen5 halamanJawaban Dari Soal-Soalrysfa shafaBelum ada peringkat
- Bab 5-TermokimiaDokumen23 halamanBab 5-TermokimiaDeliaBelum ada peringkat
- Bab 5 TermokimiaDokumen23 halamanBab 5 TermokimiaMalik LamendoBelum ada peringkat
- Term Okimi ADokumen32 halamanTerm Okimi Amutiara tiaraBelum ada peringkat
- ThermokimiaDokumen35 halamanThermokimiaVicky raihan akbar 068Belum ada peringkat
- 0 TermokimiaDokumen25 halaman0 TermokimiaCatharine fidelya AmranBelum ada peringkat
- 002 Termokimia - EnatalpiDokumen37 halaman002 Termokimia - EnatalpiAmar Ma'rufBelum ada peringkat
- Menentukan Delta H ReaksiDokumen10 halamanMenentukan Delta H ReaksiZahabi AlkaniBelum ada peringkat
- TermokimiaDokumen37 halamanTermokimiatuti susilawatiBelum ada peringkat
- TERMOKIMIADokumen63 halamanTERMOKIMIAAri Sofyan SauriBelum ada peringkat
- LKPD Persamaan Standar TermokimiaDokumen6 halamanLKPD Persamaan Standar TermokimiaL. Wira GalihBelum ada peringkat
- Materi Ajar KD 3.5.1Dokumen5 halamanMateri Ajar KD 3.5.1Sedis LoinBelum ada peringkat
- Termokimia 1Dokumen21 halamanTermokimia 1Desi wulandariBelum ada peringkat
- TermokimiaDokumen7 halamanTermokimiaNasyaBelum ada peringkat
- Pengantar Termodinamika 1-1Dokumen13 halamanPengantar Termodinamika 1-1AgusBelum ada peringkat
- KD Mesin 7 8Dokumen40 halamanKD Mesin 7 8Saverianus JakBelum ada peringkat
- I - ThermokimiaDokumen111 halamanI - ThermokimiaTheresia AustinBelum ada peringkat
- Jbptunikompp GDL Dianandria 23521 3 3.kimia ADokumen37 halamanJbptunikompp GDL Dianandria 23521 3 3.kimia Aali akbarBelum ada peringkat
- Materi Kimia Dasar Teknik Pertemuan 15Dokumen28 halamanMateri Kimia Dasar Teknik Pertemuan 15gily StrongBelum ada peringkat
- Termokimia EntalpiDokumen37 halamanTermokimia EntalpiMaharani ZahraBelum ada peringkat
- Term Okimi ADokumen37 halamanTerm Okimi AziziBelum ada peringkat
- TermokimiaDokumen30 halamanTermokimiaLailatul LuthfiyatiBelum ada peringkat
- 3 - TermokimiaDokumen37 halaman3 - TermokimiaSella RamayantiBelum ada peringkat
- Energi IkatanDokumen37 halamanEnergi IkatanAnadia PutriBelum ada peringkat
- Bentuk Molekul Modul 1 Pertemuan 4Dokumen37 halamanBentuk Molekul Modul 1 Pertemuan 4idatulfitriahBelum ada peringkat
- Termokimia KimdasDokumen38 halamanTermokimia KimdasRaniBelum ada peringkat
- Termokimia - Tgs Kimia KLMPK 3Dokumen38 halamanTermokimia - Tgs Kimia KLMPK 3dzaky najwanBelum ada peringkat
- Kimia-Terapan-TermokimiaDokumen39 halamanKimia-Terapan-TermokimiaPutri WandiniBelum ada peringkat
- Materi KuliahtermokimiaDokumen35 halamanMateri KuliahtermokimiaPanitia LuckyBelum ada peringkat
- Termokimia 2Dokumen31 halamanTermokimia 2Rina MonalisaBelum ada peringkat
- Rangkuman TermokimiaDokumen3 halamanRangkuman TermokimiaFelix Gunawan50% (2)
- Materi TermokimiaDokumen32 halamanMateri Termokimianurhikmah_88Belum ada peringkat
- Hand Out Pertemuan 1Dokumen10 halamanHand Out Pertemuan 1deti_chem7899100% (1)
- TermokimiaDokumen41 halamanTermokimiaHanifahDwi SaharaBelum ada peringkat
- Termokimia (12-13) PDFDokumen83 halamanTermokimia (12-13) PDFYuliantari YuliantariBelum ada peringkat
- Bahan Ajar Terrmo 2Dokumen12 halamanBahan Ajar Terrmo 2Gerald TeufBelum ada peringkat
- Perubahan EntalpiDokumen4 halamanPerubahan EntalpiHasanuddin RitongaBelum ada peringkat
- Kimia Dasar 1 EnergitikaDokumen10 halamanKimia Dasar 1 EnergitikaRully RimansyahBelum ada peringkat
- (Kelas 11) BAB 4 TERMOKIMIADokumen13 halaman(Kelas 11) BAB 4 TERMOKIMIAMutia AgustinBelum ada peringkat
- TERMOKIMIADokumen44 halamanTERMOKIMIAIqna AmaliyahBelum ada peringkat
- Bahan BacaanDokumen5 halamanBahan BacaanYeni SenobaanBelum ada peringkat
- Perubahan EntalpiDokumen2 halamanPerubahan EntalpiAfrilia100% (1)
- Termokimia PPTXDokumen24 halamanTermokimia PPTXpipitBelum ada peringkat
- Bab 5 TermokimiaDokumen5 halamanBab 5 TermokimiaHafidz SayyidBelum ada peringkat
- Hand Out Kimia Kelas XI Persamaan Termokimia PDFDokumen5 halamanHand Out Kimia Kelas XI Persamaan Termokimia PDFEmi LiawatiBelum ada peringkat
- TermokimiaDokumen40 halamanTermokimiaMega RestiaBelum ada peringkat
- SKL 5Dokumen8 halamanSKL 5Salsa NoviantiBelum ada peringkat
- Termokimia 2Dokumen83 halamanTermokimia 2Smahangtuah MakassarBelum ada peringkat
- TermokimiaDokumen43 halamanTermokimiapreddy yosuaBelum ada peringkat
- Contoh Soal Termokimia Dan PembahasannyaDokumen23 halamanContoh Soal Termokimia Dan Pembahasannyasumire shiny dartok100% (1)