Pertemuan 7 - Termokimia
Diunggah oleh
Adelia NurulHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Pertemuan 7 - Termokimia
Diunggah oleh
Adelia NurulHak Cipta:
Format Tersedia
Materi Pembibitan Olimpiade Sains Nasional
Bidang : Kimia
Pertemuan Ke-7
Materi = Termokimia : Entalpi, Entalpi pembentukan standar, Hukum Hess, Entalpi pemutusan
ikatan, Siklus Born-Haber, Energi Pelarutan
Sumber Bahan Bacaan Utama =
a. Raymond Chang – BAB 6 (Thermochemistry), BAB 9 (sub 9.1 Bond Enthalpy dan sub
9.3 Lattice Energy)
Soal 1 : Reaksi termit adalah reaksi yang terjadi bila logam aluminium bereaksi dengan
besi(III)oksida 2 Al(s) + Fe2O3(s) Al2O3(s) + 2Fe(l)
Reaksi ini sangat eksotermis dan menghasilkan lelehan besi yang dapat diubah bentuknya
sesuai yang diinginkan.
Hitung panas yang dikeluarkan dalam kJ per gram Al yang bereaksi dengan Fe2O3. Nilai ΔHof
Fe(l) adalah 12,40 kJ/mol; ΔHof Al2O3(s) adalah -1669,8 kJ/mol; ΔHof Fe2O3(s) adalah -882,2
kJ/mol.
A. Termokimia
Konsep:
Termokimia adalah studi mengenai perubahan panas yang terjadi saat proses reaksi
kimia.
B. Entalpi reaksi
Hampir setiap proses reaksi kimia berada dalam keadaan tekanan tetap. Perubahan
panas yang terjadi dalam reaksi kimia pada tekanan tetap disebut entalpi.
Reaktan Produk
Dalam reaksi ini terjadi perubahan entalpi, yang disebut : entalpi reaksi (ΔH)
ΔH = H (produk) – H (reaktan)
Way – Indonesian Chem Olympiad
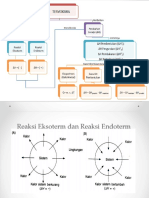
B.1. Nilai entalpi reaksi
Bila nilai ΔH > 0 (bernilai positif) disebut endotermik / butuh kalor
Bila nilai ΔH < 0 (bernilai negatif) disebut eksotermik / melepas kalor
Contoh: H2O (s) H2O (l) ΔH = 6,01 kJ
- Reaksi tersebut disebut : reaksi pelelehan air
- Reaksi tersebut endotermik / butuh kalor, karena ΔH bernilai positif
- Satuan entalpi yaitu mengikuti satuan energy (joule, kalori)
- Satuan entalpi dalam reaksi diatas : kJ
B.2. Modifikasi entalpi reaksi
Reaksi pelelehan air:
H2O (s) H2O (l) ΔH = 6,01 kJ
1. Bila reaksi terjadi ke arah sebaliknya, maka terjadi perubahan nilai entalpi
positif (+) menjadi negatif (–) dan sebaliknya.
H2O (l) H2O (s) ΔH = - 6,01 kJ
2. Bila koefisien diubah
a. Koefisien diubah 2 kali reaksi, maka nilai entalpi juga bernilai 2 kalinya.
2H2O (l) 2H2O (s) ΔH = - 12,02 kJ
b. Koefisien diubah ½ kali reaksi, maka nilai entalpi juga bernilai ½
kalinya.
½ H2O (l) ½ H2O (s) ΔH = - 3,005 kJ
B.3. Hubungan entalpi dengan jumlah zat (mol)
Contoh 1 : H2O (s) H2O (l) ΔH = 6,01 kJ/mol
Artinya: tiap 1 mol reaktan H2O(s) yang berubah menjadi produk H2O(l)
membutuhkan kalor sebanyak 6,01 kilo joule.
3. Apabila H2O(s) diubah menjadi 2 mol, maka kalor yang dibutuhkan 2 kalinya:
ΔH (2 mol H2O) = 6,01 kJ/mol x 2 mol
= 12,02 kJ
Way – Indonesian Chem Olympiad
Contoh 2 : 2SO2 + O2 2SO3 ΔH = -198,2 kJ/mol
4. Apabila SO2 berjumlah 3 mol, maka kalor yang dibutuhkan 3/2 kalinya
Pada reaksi tersebut, ΔH berarti reaksi melepas -198,2 kJ per mol oksigen (O2).
Karena hanya oksigen yang memiliki koefisien 1.
Kita ubah ΔH menjadi per mol SO2 :
SO2 + ½ O2 SO3 ΔH = (-198,2 kJ/mol) / 2
= -99,1 kJ/mol
ΔH (3 mol SO2) = -99,1 kJ/mol x 3 mol
= 297,3 kJ
C. Entalpi pembentukan standar
a. Entalpi pembentukan standar (ΔHof) : entalpi pembentukan suatu zat dari
unsur-unsurnya dalam keadaan standar (1 atm, 25 oC).
ΔHof H2O(l) yaitu: entalpi pembentukan H2O(l) dari hidrogen dan oksigen. Hidrogen
dalam keadaan standar berbentuk H2(g) dan oksigen dalam keadaan standar
berbentuk O2(g).
Sehingga reaksi yang terjadi: H2(g) + ½ O2(g) H2O(l) ΔHof H2O(l)
Nilai ΔHof berbeda tiap zat
Nilai ΔHof unsur-unsur dalam keadaan standar adalah nol (0)
b. Entalpi reaksi standar (ΔHorxn) : entalpi reaksi yang terjadi pada keadaan
standar (1 atm, 25oC).
Bila terdapat reaksi: aA + bB cC + dD
Kita dapat menentukan entalpi reaksi standar dari entalpi pembentukan standar
masing-masing zat yang bergantung jumlah koefisien.
ΔHorxn = [c ΔHof (C) + d ΔHof (D)] – [a ΔHof (A) + b ΔHof (B)]
Way – Indonesian Chem Olympiad
Persamaan umum:
ΔHorxn = Σ n ΔHof (PRODUK) – Σ n ΔHof (REAKTAN) n = koefisien
Metode untuk menghitung entalpi reaksi dibagi menjadi 2
C.1. Metode langsung
Contoh: C(grafit) + O2(g) CO2(g) ΔH = -393,5 kJ/mol
ΔHorxn = [1 x ΔHof (CO2(g))] – [1 x ΔHof (C(grafit)) + 1 x ΔHof (O2(g))]
-393,5 kJ/mol = ΔHof (CO2(g)) – [ 0 + 0 ]
-393,5 kJ/mol = ΔHof (CO2(g))
C.2. Metode tidak langsung (penggabungan reaksi / HUKUM HESS)
Hukum Hess: Ketika reaksi dari reaktan ke produk memiliki banyak step perubahan
entalpi akan sama dengan penjumlahan entalpi di tiap step.
Contoh: Kita ingin mencari entalpi reaksi berikut
(a) C(grafit) + ½ O2(g) CO (g)
Namun data yang kita dapatkan hanya:
(b) C(grafit) + O2(g) CO2(g) ΔHo = -393,5 kJ/mol
(c) CO(g) + ½ O2(g) CO2(g) ΔHo = -283,0 kJ/mol
Kita dapat memanipulasi reaksi b dan c untuk menghasilkan reaksi a.
Way – Indonesian Chem Olympiad
Caranya: Balik arah reaksi (c) menjadi:
(d) CO2(g) CO(g) + ½ O2(g) ΔHo = +283,0 kJ/mol
Jumlahkan reaksi (b) dan (d) yang menghasilkan reaksi (a)
C(grafit) + O2(g) CO2(g) ΔHo = -393,5 kJ/mol
CO2(g) CO(g) + ½ O2(g) ΔHo = +283,0 kJ/mol
C(grafit) + ½ O2(g) CO (g) ΔHo = ?
ΔHo = [-393,5 kJ/mol] + [283,0 kJ/mol]
= -110,5 kj/mol
Soal 2 : Reaksi pembakaran benzena C6H6 dalam udara menghasilkan karbon dioksida
dan air berfasa liquid.
Hitung panas yang dikeluarkan dalam kJ/mol benzena yang bereaksi dengan udara. Nilai
ΔHof C6H6 adalah 49,04 kJ/mol; ΔHof CO2(g) adalah -393,5 kJ/mol; ΔHof H2O(l) adalah -
285,8 kJ/mol.
D. Entalpi (pemutusan) ikatan
Konsep: Stabil atau tidaknya ikatan dalam molekul bergantung pada entalpi ikatannya.
Entalpi ikatan adalah perubahan entalpi yang dibutuhkan untuk memutuskan suatu
ikatan dalam 1 mol molekul gas. (Jika molekul tidak berbentuk gas, maka harus melalui
reaksi pembentukan gas).
Contoh: Molekul diatomik
Terlihat perbedaan signifikan pada ikatan tunggal, rangkap 2 dan rangkap 3.
Way – Indonesian Chem Olympiad
Contoh: Molekul yang bukan diatomik
Walupun sama-sama memutuskan ikatan antara O dan H. Namun nilainya berbeda.
Maka nilai pemutusan O-H (antara O dan H) yaitu rata-rata dari nilai diatas.
Tabel entalpi ikatan molekul diatom (merah) dan rata-rata entalpi ikatan molekul
poliatom (hitam)
Ikatan entalpi ikatan (kJ/mol) Ikatan entalpi ikatan (kJ/mol)
Kita dapat memprediksi ΔHo reaksi menggunakan data entalpi ikatan:
Way – Indonesian Chem Olympiad
Persamaan umum:
ΔHorxn = Σ n entalpi ikatan (REAKTAN) – Σ n entalpi ikatan (PRODUK)
n = jumlah ikatan
Soal 3
Hitung entalpi reaksi dari:
a. H2(g) + Cl2(g) 2HCl(g)
b. 2H2(g) + C2H4 (g) C2H6(g)
c. C(grafit) + O2(g) CO2(g)
E. Siklus Born-Haber
Konsep: Dalam suatu pembentukan padatan senyawa ionik terdapat siklus Born-Haber
yang menunjukkan siklus energinya.
Contoh siklus Born-Haber dari senyawa padatan ionik LiF
ΔHo1 = Energi sublimasi Litium ΔHo2 = Energi disosiasi / atomisasi Fluorin
ΔHo3 = Energi ionisasi Litium ΔHo4 = Afinitas elektron Fluorin
ΔHo5 = - Energi kisi (U) ΔHooverall = Energi pembentukan ikatan
ΔHooverall = ΔHo1 + ΔHo2 + ΔHo3 + ΔHo4 + ΔHo5
Way – Indonesian Chem Olympiad
F. Energi Pelarutan
Energi pelarutan = ΔHosoln NaCl(s) Na+(aq) + Cl-(aq)
Energi kisi =U NaCl(s) Na+(g) + Cl-(g)
Energi hidrasi = ΔHohydr Na+ (g) Na+(aq)
Cl- (g) Cl-(aq)
ΔHosoln = U + ΔHohydr
Energi pelarutan padatan ionik dapat bersifat eksoterm atau endoterm yang bergantung
pada energi kisi dan energi hidrasinya.
Way – Indonesian Chem Olympiad
Anda mungkin juga menyukai
- DONOR DARAH SUKARELA (DORAS) Untuk PMRDokumen20 halamanDONOR DARAH SUKARELA (DORAS) Untuk PMRGie Hartanto93% (45)
- TermokimiaDokumen43 halamanTermokimiapreddy yosuaBelum ada peringkat
- LKPD tERMOKIMIADokumen11 halamanLKPD tERMOKIMIAKrisostomus AnsaBelum ada peringkat
- 10 Matematika Buku GuruDokumen448 halaman10 Matematika Buku GuruFiqri Hasann75% (4)
- Pendidikan Remaja Sebaya (PRS)Dokumen110 halamanPendidikan Remaja Sebaya (PRS)sergeant keroro100% (1)
- Materi TermokimiaDokumen32 halamanMateri Termokimianurhikmah_88Belum ada peringkat
- Pertemuan 7 - TermokimiaDokumen8 halamanPertemuan 7 - TermokimiaAdelia NurulBelum ada peringkat
- Termokimia PPTXDokumen24 halamanTermokimia PPTXpipitBelum ada peringkat
- Termokimia 1Dokumen21 halamanTermokimia 1Desi wulandariBelum ada peringkat
- Termo KimiaDokumen26 halamanTermo KimiaDjoko Sriyadi67% (3)
- MATERI Kim XI TermokimiaDokumen10 halamanMATERI Kim XI Termokimiasatyajulian4Belum ada peringkat
- 14 TermokimiaDokumen23 halaman14 TermokimiaAdamDio ZaidanDhuhaBelum ada peringkat
- LKPD Persamaan Standar TermokimiaDokumen6 halamanLKPD Persamaan Standar TermokimiaL. Wira GalihBelum ada peringkat
- Termokimia SWDDokumen21 halamanTermokimia SWDRita AnggrainiBelum ada peringkat
- Materi Kimia Umum 2Dokumen53 halamanMateri Kimia Umum 2Agung Pratama Hitarijat100% (3)
- TERMOKIMIADokumen37 halamanTERMOKIMIATM-21-084 RIFQI TUBAGUS HILMIBelum ada peringkat
- TermokimiaDokumen17 halamanTermokimiaYosep Kevin DamanikBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIARahayu LestariBelum ada peringkat
- Ringkasan Materi Kimia Kelas XIDokumen65 halamanRingkasan Materi Kimia Kelas XIPAK HERIBelum ada peringkat
- Bab 5-TermokimiaDokumen23 halamanBab 5-TermokimiaDeliaBelum ada peringkat
- Bab 5 TermokimiaDokumen23 halamanBab 5 TermokimiaMalik LamendoBelum ada peringkat
- ThermokimiaDokumen35 halamanThermokimiaVicky raihan akbar 068Belum ada peringkat
- Termokimia SWDDokumen25 halamanTermokimia SWDDede Abdul AzisBelum ada peringkat
- Kimia Kelas Xi SMTR 2Dokumen13 halamanKimia Kelas Xi SMTR 2Muhammad SuaibBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIAikke febri yenikaBelum ada peringkat
- Hand Out Pertemuan 1Dokumen10 halamanHand Out Pertemuan 1deti_chem7899100% (1)
- TERMOKIMIADokumen10 halamanTERMOKIMIAendahBelum ada peringkat
- Ppttermokimia 140206111422 Phpapp01 DikonversiDokumen32 halamanPpttermokimia 140206111422 Phpapp01 DikonversiSinta Dwi PrisiliaBelum ada peringkat
- Term Okimi ADokumen5 halamanTerm Okimi AWiwied Rizky Puspita RahayuBelum ada peringkat
- TermokimiaDokumen7 halamanTermokimiaNasyaBelum ada peringkat
- BAB II TermokimiaDokumen4 halamanBAB II TermokimiaTri FaturrBelum ada peringkat
- 3 TermokimiaDokumen9 halaman3 TermokimiaIvan ApriBelum ada peringkat
- Termokimia PDFDokumen7 halamanTermokimia PDFraftwarriorBelum ada peringkat
- XI TermokimiaDokumen1 halamanXI TermokimiaKorin23Belum ada peringkat
- Modul 5 Kimia Kelas XI MIA KD 3.3 Perubahan Entalpi Dan Hukum HessDokumen6 halamanModul 5 Kimia Kelas XI MIA KD 3.3 Perubahan Entalpi Dan Hukum HessmiftahulBelum ada peringkat
- TERMOKIMIADokumen63 halamanTERMOKIMIAAri Sofyan SauriBelum ada peringkat
- Soal Kimdas 2Dokumen11 halamanSoal Kimdas 2Rachma Rumie RianthiBelum ada peringkat
- Termokimia TGTDokumen18 halamanTermokimia TGTSyafira TiaradipaBelum ada peringkat
- Reaksi EksotermDokumen11 halamanReaksi EksotermYudy ArmantoBelum ada peringkat
- 0 TermokimiaDokumen25 halaman0 TermokimiaCatharine fidelya AmranBelum ada peringkat
- Kimia EntalpiDokumen36 halamanKimia EntalpiJessica PramestiBelum ada peringkat
- Kumpulan Soal TermokimiaDokumen6 halamanKumpulan Soal TermokimiamarsiBelum ada peringkat
- Rangkuman Energetika - IntanPratamaPutra - 10318017Dokumen9 halamanRangkuman Energetika - IntanPratamaPutra - 10318017Intan Pratama PutraBelum ada peringkat
- TermokimiaDokumen41 halamanTermokimiaHanifahDwi SaharaBelum ada peringkat
- Bahan Ajar TERMOKIMIA (Syukri, Yerimadesi, Hardeli)Dokumen38 halamanBahan Ajar TERMOKIMIA (Syukri, Yerimadesi, Hardeli)Mardhiya KBelum ada peringkat
- Jawaban Dari Soal-SoalDokumen5 halamanJawaban Dari Soal-Soalrysfa shafaBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Tugas Resume Kimia Fisika TermokimiaDokumen10 halamanTugas Resume Kimia Fisika TermokimiaTiara DwiscaBelum ada peringkat
- Termokimia SWDXXDokumen25 halamanTermokimia SWDXXLian ElvaniBelum ada peringkat
- Perubahan EntalpiDokumen4 halamanPerubahan EntalpiHasanuddin RitongaBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- TermokimiaDokumen25 halamanTermokimiaidzni desrifaniBelum ada peringkat
- Termokimia PDFDokumen42 halamanTermokimia PDFstrygwyrgtBelum ada peringkat
- Termokimia 2Dokumen9 halamanTermokimia 2fathirskw01Belum ada peringkat
- TermokimiaDokumen20 halamanTermokimiaJunaris Kjm IIBelum ada peringkat
- Termokimia SMADokumen23 halamanTermokimia SMAWahid ArdaniBelum ada peringkat
- TermoDokumen20 halamanTermoIren BungaBelum ada peringkat
- Termokimia Part 2Dokumen15 halamanTermokimia Part 2Devi KurniawatiBelum ada peringkat
- 002 Termokimia - EnatalpiDokumen37 halaman002 Termokimia - EnatalpiAmar Ma'rufBelum ada peringkat
- Kimia Dasar 1 EnergitikaDokumen10 halamanKimia Dasar 1 EnergitikaRully RimansyahBelum ada peringkat
- Termokimia - Tgs Kimia KLMPK 3Dokumen38 halamanTermokimia - Tgs Kimia KLMPK 3dzaky najwanBelum ada peringkat
- TERMOKIMIADokumen3 halamanTERMOKIMIARiestaniaFaradillaBelum ada peringkat
- Pertemuan 6 - Persamaan Dan Reaksi KimiaDokumen8 halamanPertemuan 6 - Persamaan Dan Reaksi KimiaAdelia NurulBelum ada peringkat
- Pertemuan 9 - KesetimbanganDokumen8 halamanPertemuan 9 - KesetimbanganAdelia NurulBelum ada peringkat
- Pertemuan 8 - Kinetika KimiaDokumen4 halamanPertemuan 8 - Kinetika KimiaAdelia NurulBelum ada peringkat
- Pertemuan 6 - Persamaan Dan Reaksi KimiaDokumen8 halamanPertemuan 6 - Persamaan Dan Reaksi KimiaAdelia NurulBelum ada peringkat
- Pertemuan 4 - Persamaan Dan Reaksi KimiaDokumen9 halamanPertemuan 4 - Persamaan Dan Reaksi KimiaAdelia NurulBelum ada peringkat
- Pertemuan 4 - Persamaan Dan Reaksi KimiaDokumen9 halamanPertemuan 4 - Persamaan Dan Reaksi KimiaAdelia NurulBelum ada peringkat
- Buku Panduan Acara 2 RevisiDokumen7 halamanBuku Panduan Acara 2 RevisiAdelia NurulBelum ada peringkat
- Penyuluhan PerikananDokumen2 halamanPenyuluhan PerikananAdelia NurulBelum ada peringkat
- INFORMASI LOMBA-LOMBA 2017 Edit PDFDokumen16 halamanINFORMASI LOMBA-LOMBA 2017 Edit PDFMerindraAjiPamungkasBelum ada peringkat
- Data Refrigeran EsDokumen1 halamanData Refrigeran EsAdelia NurulBelum ada peringkat
- Syllabus - ICHODokumen16 halamanSyllabus - ICHOPramudio PakertiBelum ada peringkat
- Buku Panduan Acara 7. Faktorial Dan Efek PerlakuanDokumen7 halamanBuku Panduan Acara 7. Faktorial Dan Efek PerlakuanAdelia NurulBelum ada peringkat
- Data Refrigeran EsDokumen1 halamanData Refrigeran EsAdelia NurulBelum ada peringkat
- Kurikulum 2019 - Program Studi Sarjana-FpnDokumen31 halamanKurikulum 2019 - Program Studi Sarjana-FpnAdelia NurulBelum ada peringkat
- PA Fakultas Pertanian 2021 Rev 04-08-21Dokumen144 halamanPA Fakultas Pertanian 2021 Rev 04-08-21Adelia NurulBelum ada peringkat
- Makalah Penanganan Hasil PerikananDokumen15 halamanMakalah Penanganan Hasil PerikananAdelia NurulBelum ada peringkat
- Quiz-3Dokumen8 halamanQuiz-3Adelia NurulBelum ada peringkat
- Cara Pendinginan IkanDokumen17 halamanCara Pendinginan IkanAdelia NurulBelum ada peringkat
- Kemunduruan Mutu IkanDokumen20 halamanKemunduruan Mutu IkanAdelia NurulBelum ada peringkat
- Safety Health EnvironmentDokumen18 halamanSafety Health EnvironmentAdelia NurulBelum ada peringkat
- Laprak Biokim 2Dokumen7 halamanLaprak Biokim 2Adelia NurulBelum ada peringkat
- Uji ElektroforesisDokumen8 halamanUji ElektroforesisAdelia NurulBelum ada peringkat