Bab Iv Hasil Percobaan Dan Pembahasan
Diunggah oleh
Ghafa Al RamadhanJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Bab Iv Hasil Percobaan Dan Pembahasan
Diunggah oleh
Ghafa Al RamadhanHak Cipta:
Format Tersedia
P2
BAB IV
HASIL PERCOBAAN DAN PEMBAHASAN
IV.2. PEMBAHASAN
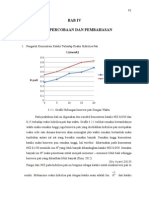
1. Pengaruh Konsentrasi Katalis Terhadap Reaksi Hidrolisa Pati
t (menit)
0.9
0.8
0.7
0.6
HCl 0,05 N
0.5
HCl 0,15N
X pati 0.4
0.3
0.2
0.1
0
0
10
15
20
4.2.1. Grafik Hubungan konversi pati Dengan Waktu
Pada praktikum kali ini digunakan dua variabel konsentrasi katalis HCl 0,05N dan
0,15 terhadap reaksi hidrolisa pati dan waktu. Grafik 4.2.1 terlihat semakin bertambahnya
waktu maka semakin tinggi juga konversi pati yang disebabkan hidrolisa pati merupakan
reaksi orde satu dimana konversi akan meningkat jika waktu semakin bertambah maka
tumbukan antara zat zat yang bereaksi semakin banyak. Semakin tinggi konsentrasi
katalis maka konversi pun semakin tinggi, hal tersebut dikarenakan pada konsentrasi
HCl 0,15N memiliki ion H+ yang lebih banyak dibandingkan katalis HCl 0,05N. Semakin
banyak ion H+ maka pemutusan untuk menjadi monomer monomer lebih baik sehingga
konversi pati yang dihasilkan lebih banyak (Rina, 2012).
(Sry Iryani,2013)
Fungsi dari HCl pada hidrolisa pati ini berguna sebagai katalis untuk menkonversi pati tu
sendiri. Mekanisme reaksi hidrolisa pati dengan katalis asam adalah Ion
+
H
dari katalis
P2
asam bergabung dengan pati membentuk suatu intermediet (kompleks pati). Kompleks pati
tersebut kemudian diikat oleh ion -OH yang berasal dari air membentuk glukosa ( Mastuti
dkk., 2010). Katalis digunakan untuk menurunkan energi aktivasi, dikarenakan Penggunaan
katalis tersebut mampu mendorong aktivitas penguraian molekul air dengan adanya
kandungan ion hidrogen pada asam (Rina,2012), apabila energi aktivasi semakin kecil
maka akan memperbesar konstanta kecepatan reaksi, sesuai persamaan Arrhenius :
k = A exp(-Ea/RT
Dengan :
k
= konstanta laju reaksi
= frekuensi tumbukan
= konstanta gas
= temperatur
Ea = energi aktivasi
( Levenspiel, 1985)
Konstanta kecepatan reaksi yang semakin besar menyebabkan konversi semakin
besar, menurut persamaan :
-ln (1Xpati) = kt + c
kt
Xpati
= 1- e
(elista.akprind.ac.id)
Oleh karena itu semakin tinggi konsentrasi maka konversi pati yang dihasilkan semakin
besar.
2. Pengaruh Konsentrasi Katalis Terhadap Konstanta Kecepatan Reaksi
P2
t ( menit)
2
1.8
1.6
1.4
1.2
HCl 0,05 N
HCl 0,15 N
-ln(1-Xp)
0.8
0.6
0.4
0.2
0
0
10
15
20
4.2.1. Grafik Hubungan konstanta kecepatan reaksi dengan waktu
Dari Grafik 4.2.1. dapat diketahui nilai k pada masing-masing variabel yang
merupakan nilai slope dari masing-masing kurva. Variabel 1 memiliki nilai k sebesar
0,0333 menit 1
1
sedangkan pada variabel 2 nilai k sebesar 0,0539 menit
. Grafik
4.2.1. menunjukkan nilai k pada kosentrasi katalis 0,15 N lebih besar dari nilai k pada
konsentrasi katalis 0,05 N.
Ion
+
H
dari katalis asam bergabung dengan pati membentuk suatu intermediet
(kompleks pati). Kompleks pati tersebut kemudian diikat oleh ion -OH yang berasal dari
air membentuk glukosa.
Katalis menurunkan energi aktivasi dengan menurunkan energi intermediet
sehingga energi yang harus dilewati untuk menjadi produk menjadi kecil. Energi aktivasi
reaksi merupakan banyaknya energi minimum yang dibutuhkan oleh reaksi agar reaksi
dapat berlangsung.. Mekanisme reaksinya adalah sebagai berikut
P2
Katalis menurunkan energi aktivasi dengan menurunkan energi intermediet
sehingga energi yang harus dilewati untuk menjadi produk menjadi kecil. Energi aktivasi
reaksi merupakan banyaknya energi minimum yang dibutuhkan oleh reaksi agar reaksi
dapat berlangsung Semakin kecil energi aktivasi maka semakin kecil pula konstanta
kecepatan reaksinya menurut persamaan :
k = A exp(-Ea/RT
Oleh karena itu, semkain tinggi konsentrasi maka semakin besar juga konstanta
rekasinya. Pada percobaan kali ini konstanta kecepatan reaksi dengan konsentrasi katalis
0,15N lebih besar dibandingkan konstanta konsentrasi katalis 0,05N.
(Annuurunnisa, 2010)
3. Hubungan Konstanta Kecepatan Reaksi dengan Konversi yang didapat
Konversi yang didapat dipengaruhi oleh konstanta kecepatan reaksi. Semakin
besar konstanta kecepatan reaksi maka konversi yang diperoleh pun semakin tinggi, hal
tersebut sesuai dengan persamaan :
P2
Xpati
kt
= 1- e
(elista.akprind.ac.id)
Dari persamaan diatas, maka diperoleh nilai konstanta k pada setiap variabel :
Tabel 4.1.1 Hasil Percobaan Hidrolisa Pati Variabel 1 (Katalis 0,05N)
X pati ( HCl 0,05N)
0,383
0,444
0,1172
0,566
0,0835
0,596
0,0604
0,162
0,0581
Setelah mendapatkan harga k, maka dapat diperoleh energy aktivasi, melalui
persamaan :
k= k0e-Ea/RT
Harga dari k0 diperoleh melalui regresi, diperoleh harga k0 untuk konsentrasi
katalis HCl 0,05N adalah 0,03356 menit-1 dan konsentrasi katalis HCl 0,15N adalah
0,05388 menit-1. Energy aktivasi yang diperoleh dari persamaan tersebut semakin lama
akan semakin menurun. Pada percobaan kali ini, konsentrasi katalis HCl 0,15n memiliki
konversi yang lebih besar dibandingkan katalis HCl 0,05N. (Enny, 2006)
4. Back to Titration
Titrasi kembali (Back titration), cara ini dilakukan bila sampel tidak bereaksi
dengan larutan baku atau reaksinya lambat. Dalam hal ini ditambahkan zat ketiga
(Fehling A dan Fehling B) yang telah diketahui kepekatannya dan jumlahnya diukur
tetapi berlebihan dan kelebihannya dititrasi dengan larutan baku ( Glukosa Standart).
Untuk metode back to titration dengan cara menambahkan titran secara berlebih,
setelah reaksi dengan analit berjalan sempurna, kelebihan titran ditentukan dengan
P2
menitrasi dengan larutan standar lainnya( Glukosa standart). Dengan mengetahui mmol
titran dan menghitung mmol yang tak bereaksi, akan diperoleh mmol titran yang
bereaksi dengan analit.
( Agus Rusgiyono,2013)
BAB V
PENUTUP
V.1 KESIMPULAN
1. Semakin tinggi konsentrasi katalis maka konversi pun semakin tinggi, hal tersebut
dikarenakan pada konsentrasi HCl 0,15N memiliki ion H+ yang lebih banyak
dibandingkan katalis HCl 0,05N. Semakin banyak ion H+ maka pemutusan untuk menjadi
monomer monomer lebih baik sehingga konversi pati yang dihasilkan lebih banyak
P2
2. Hidrolisa dengan konsentrasi katalis sebesar 0,15 N menghasilkan harga konstanta
1
kecepatan reaksi 0,0539 menit
, lebih besar dibandingkan dengan hidrolisa dengan
1
konsentrasi katalis 0,05 N yaitu sebesar 0,0335 menit
.
3. Konversi yang didapat dipengaruhi oleh konstanta kecepatan reaksi. Semakin besar
konstanta kecepatan reaksi maka konversi yang diperoleh pun semakin tinggi
4. Hidrolisa pati merupakan hidrolisa yang menggunakan teori back to titrarion
V.2 SARAN
1
2
Suhu operasi harus dijaga konstan.
Usahakan sampel tidak menggumpal, lebih baik dilakukan pengadukan.
3 Pastikan pH netral sebelum ditirasi.
Anda mungkin juga menyukai
- Batbar Ghafa Al Ramadhan 21030113140183Dokumen6 halamanBatbar Ghafa Al Ramadhan 21030113140183Ghafa Al RamadhanBelum ada peringkat
- AntooDokumen5 halamanAntooGhafa Al RamadhanBelum ada peringkat
- Norman EdwinDokumen1 halamanNorman EdwinGhafa Al RamadhanBelum ada peringkat
- Bab Iv P5Dokumen5 halamanBab Iv P5Ardhi FirmansyahBelum ada peringkat
- ENKAP ANTOSIANINDokumen49 halamanENKAP ANTOSIANINGhafa Al RamadhanBelum ada peringkat
- Utilitas TerjemahanDokumen38 halamanUtilitas TerjemahankhonsasyahidahBelum ada peringkat
- KwuDokumen9 halamanKwuGhafa Al RamadhanBelum ada peringkat
- Perhitungan Ekonomi Produksi BiodieselDokumen22 halamanPerhitungan Ekonomi Produksi BiodieselGhafa Al RamadhanBelum ada peringkat
- Dataindustrisawit PermintaanmasyDokumen17 halamanDataindustrisawit PermintaanmasyRector KhanBelum ada peringkat
- Sejarah Pecinta Alam IndonesiaDokumen4 halamanSejarah Pecinta Alam IndonesiaGhafa Al Ramadhan100% (1)
- BuyingDokumen7 halamanBuyingGhafa Al RamadhanBelum ada peringkat
- SIMULASIDokumen19 halamanSIMULASIGhafa Al Ramadhan100% (1)
- Utilitas Kel.1 - MK - IIDokumen35 halamanUtilitas Kel.1 - MK - IIGhafa Al RamadhanBelum ada peringkat
- Tugas KewirausahaanDokumen5 halamanTugas KewirausahaanGhafa Al RamadhanBelum ada peringkat
- 10 Macam Peluang Kerja Lulusan Teknik Kimia: I. Oil & Gas (Owner & Services)Dokumen7 halaman10 Macam Peluang Kerja Lulusan Teknik Kimia: I. Oil & Gas (Owner & Services)Ghafa Al RamadhanBelum ada peringkat
- Bab IDokumen1 halamanBab IGhafa Al RamadhanBelum ada peringkat
- Sejarah Pecinta Alam IndonesiaDokumen4 halamanSejarah Pecinta Alam IndonesiaGhafa Al Ramadhan100% (1)
- Permasalahan Pada Lapisan Perpindahan PanasDokumen5 halamanPermasalahan Pada Lapisan Perpindahan PanasGhafa Al RamadhanBelum ada peringkat
- Pengolahan Air Limbah Secara Biologi AnaerobDokumen3 halamanPengolahan Air Limbah Secara Biologi AnaerobGhafa Al RamadhanBelum ada peringkat
- Tugas Kewirausahaan IIDokumen6 halamanTugas Kewirausahaan IIGhafa Al RamadhanBelum ada peringkat
- Hidrodinamika Reaktor 11Dokumen26 halamanHidrodinamika Reaktor 11Ghafa Al RamadhanBelum ada peringkat
- KONTROL SUHU DAN LEVEL AIR PIDDokumen16 halamanKONTROL SUHU DAN LEVEL AIR PIDSitaHifdiahMaulidiniBelum ada peringkat
- Bab Iv Hasil Percobaan Dan PembahasanDokumen7 halamanBab Iv Hasil Percobaan Dan PembahasanGhafa Al RamadhanBelum ada peringkat
- Laporan SementaraDokumen4 halamanLaporan SementaraGhafa Al RamadhanBelum ada peringkat
- HACCPDokumen3 halamanHACCPGhafa Al RamadhanBelum ada peringkat
- Lapres Isolasi Enzim Dan Reaksi Enzimatis PDFDokumen36 halamanLapres Isolasi Enzim Dan Reaksi Enzimatis PDFEka Tamara Pebriani100% (1)
- Laporan SementaraDokumen4 halamanLaporan SementaraGhafa Al RamadhanBelum ada peringkat
- Catatan KFI ProsesDokumen4 halamanCatatan KFI ProsesNatalia Rosa SimanjuntakBelum ada peringkat
- Inti SariDokumen2 halamanInti SariGhafa Al RamadhanBelum ada peringkat