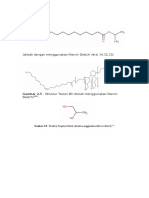
Perbedaan
Diunggah oleh
Elisa Cynthia ArdarickaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Perbedaan
Diunggah oleh
Elisa Cynthia ArdarickaHak Cipta:
Format Tersedia
Perbedaan Pembuatan Produk Steril dan Pembuatan Obat
Produk Biologi
Perbedaa
Pembuatan produk
Pembuatan obat produk
n
steril
biologi
Prinsip
Produk steril hendaklah dibuat dengan
Pembuatan obat produk biologi memerlukan
persyaratan
tujuan
pertimbangan khusus yang berasal dari sifat
memperkecil risiko pencemaran mikroba,
alami produk dan proses. Cara yang digunakan
partikulat
untuk
khusus
dan
dengan
pirogen,
yang
sangat
pembuatan,
pengendalian
serta
tergantung dari ketrampilan, pelatihan
penggunaan obat produk biologi memerlukan
dan
perhatian khusus. Pengendalian obat produk
sikap
personil
yang
terlibat.
Pemastian Mutu sangatlah penting dan
pembuatan
produk
sepenuhnya
mengikuti
biologi
pada
umumnya
steril
harus
analisis
yang
mempunyai
secara
ketat
tinggi
dibanding
dengan
melibatkan
teknik
variabilitas
penentuan
lebih
kimia-
metode pembuatan dan prosedur yang
fisika. Jadi pengawasan selama-proses berperan
ditetapkan
sangat penting pada pembuatan obat produk
dengan
tervalidasi.
seksama
Pelaksanaan
proses
dan
akhir
biologi.
atau pengujian produk jadi tidak dapat
dijadikan sebagai satu-satunya andalan
untuk menjamin sterilitas atau aspek
mutu lain.
Umum
Pembuatan
produk
steril
hendaklah
Metode yang digunakan dalam pembuatan obat
dilakukan di area bersih, memasuki area
produk biologi merupakan faktor kritis untuk
ini hendaklah melalui ruang penyangga
menyusun peraturan pengawasan yang sesuai.
udara untuk personil dan/atau peralatan
Oleh karena itu obat produk biologi dapat
dan bahan. Area bersih hendaklah dijaga
ditentukan
tingkat kebersihannya sesuai standar
pembuatannya.
dengan
mengacu
pada
metode
kebersihan yang ditetapkan dan dipasok
dengan udara yang telah melewati filter
Obat produk biologi yang dicakup dalam Aneks
dengan efisiensi yang sesuai.
ini
adalah
yang
dibuat
dengan
metode
pembuatan berikut :
Area bersih untuk pembuatan produk
steril
digolongkan
karakteristik
lingkungan
dipersyaratkan.
pembuatan
berdasarkan
Tiap
membutuhkan
yang
kegiatan
tingkat
kebersihan ruangan yang sesuai dalam
keadaan
operasional
untuk
meminimalkan risiko pencemaran oleh
a) biakan mikroba; tidak termasuk hasil dari
teknik r-DNA;
b)
biakan sel dan mikroba; termasuk yang
dihasilkan dari teknik rekombinan DNA atau
hibridoma;
c) ekstraksi dari jaringan biologi; dan
partikulat dan/atau mikroba pada produk
dan/atau bahan yang ditangani.
d) propagasi substrat hidup pada embrio atau
hewan.
Kondisi
operasional
dan
nonoperasional hendaklah ditetapkan
untuk
tiap
ruang
bersih.
Keadaan
nonoperasional adalah kondisi di mana
fasilitas telah terpasang dan beroperasi,
lengkap
tetapi
dengan
tidak
ada
peralatan
personil.
produksi
Kondisi
operasional adalah kondisi di mana
fasilitas dalam keadaan berjalan sesuai
modus pengoperasian yang ditetapkan
dengan sejumlah tertentu personil yang
sedang bekerja. Agar tercapai kondisi
operasional
hendaklah
maka
didesain
area
tersebut
untuk
mencapai
tingkat kebersihan udara tertentu pada
kondisi
nonoperasional.
Pada
pembuatan produk steril dibedakan 4
Kelas kebersihan.
Personalia
37. 1. Hanya personil dalam jumlah terbatas
1. Semua personil (termasuk yang menangani
yang diperlukan boleh berada di area
pembersihan,
bersih; hal ini penting khususnya pada
mutu) yang dipekerjakan di area di mana obat
proses aseptis. Inspeksi dan pengawasan
produk
hendaklah
pelatihan tambahan yang spesifik terhadap
dilaksanakan
sedapat
mungkin dari luar area bersih.
biologi
produk
yang
Personil
38. 2. Personil yang bekerja di area bersih
dan
steril
untuk
dibuat
dibuat
hendaklah
dan
pengawasan
hendaklah
serta
diberi
mendapat
tugas
mereka.
informasi
yang
relevan serta pelatihan tentang higiene dan
dipilih
secara
mikrobiologi.
memastikan
bahwa
diselenggarakan
hendaklah
seksama
perawatan
Semua
pelatihan
secara
hendaklah
reguler
dan
mereka dapat diandalkan untuk bekerja
didokumentasikan dengan baik. *Produk biologi
dengan
tidak
yang diproduksi dengan metode ini mencakup:
mengidap suatu penyakit atau dalam
vaksin, immunosera, antigen, hormon, sitokin,
kondisi
enzim
penuh
disiplin
kesehatan
menimbulkan
dan
yang
bahaya
dapat
pencemaran
dan
produk
lain
hasil
fermentasi
(termasuk antibodi monoklonal dan produk
yang berasal dari r-DNA).
mikrobiologis terhadap produk.
39. 3. Semua personil (termasuk bagian
2. Personil yang bertanggung jawab dalam
pembersihan dan perawatan) yang akan
produksi
bekerja
memiliki latar belakang yang memadai dalam
di
area
tersebut
hendaklah
dan
pengawasan
mutu
hendaklah
dalam
disiplin ilmu yang relevan, seperti bakteriologi,
dengan
biologi, biometri, kimia, kedokteran, farmasi,
pembuatan produk steril yang benar,
farmakologi, virologi, imunologi dan kedokteran
termasuk
dan
hewan, serta memiliki pengalaman praktis yang
Bila
memadai
mendapat
bidang
pelatihan
yang
teratur
berkaitan
mengenai
pengetahuan
dasar
higiene
mikrobiologi.
personil dari luar yang tidak pernah
menerima
(misal
pelatihan
kontraktor
seperti
di
bangunan
untuk
melaksanakan
fungsi
manajemen pada proses terkait.
atas
atau
3.
Status
imunologi
personil
dipertimbangkan
area bersih, perhatian khusus hendaklah
keamanan produk. Semua personil (termasuk
diberikan
inspektur)
pengawasan.
dengan
instruksi
dan
yang
dengan
hendaklah
perawatan), yang harus masuk ke dalam
terlibat
seksama
dalam
untuk
produksi,
perawatan, pengujian dan penanganan hewan,
jika perlu, hendaklah divaksinasi dengan vaksin
yang
sesuai
serta
diperiksa
kesehatannya
secara reguler. Terlepas dari kenyataan ada
permasalahan
keterpaparan
operator
pada
agens infektif, toksin kuat atau alergen, juga
perlu untuk menghindarkan risiko pencemaran
bets produksi oleh agens infektif. Pengunjung
hendaklah dilarang memasuki area produksi.
4. Personil yang mengalami perubahan status
imunologi yang dapat merugikan mutu produk
hendaklah dilarang bekerja di area produksi.
Produksi vaksin BCG dan produk tuberculin
hendaklah dibatasi pada petugas yang secara
regular
dipantau
status
imunologi
atau
pemeriksaan sinar-X paru-paru.
5. Pada hari yang sama, personil dari area di
mana terdapat paparan organisme hidup atau
hewan dilarang melintas ke area di mana
produk lain atau organisme yang berbeda
sedang ditangani. Jika lintasan tersebut tidak
dapat
dihindarkan,
maka
tindakan
dekontaminasi yang ditetapkan dengan jelas,
termasuk ganti baju dan sepatu dan, jika perlu,
mandi hendaklah dipatuhi oleh personil yang
terlibat dalam produksi.
6. Personil hendaklah melaporkan tiap kondisi
seperti diare, batuk, pilek, infeksi kulit atau
rambut, luka, demam yang tidak diketahui
penyebabnya yang dapat menyebarkan kuman
ke dalam lingkungan kerja.
7.
Personil
yang
terlibat
dalam
proses
pembuatan hendaklah berbeda dengan personil
yang menangani hewan.
Bangunan,
Fasilitas,
Peralatan
49. 1.
dan
Semua
bangunan
fasilitas
1. Tingkat pengendalian lingkungan terhadap
hendaklah, sedapat mungkin, didesain
pencemaran oleh partikulat dan mikroba di
untuk
yang
sarana produksi hendaklah diterapkan pada
atau
produk
tidak
pertimbangan tingkat pencemaran bahan awal
mencegah
melakukan
personil,
pengawasan
pengendalian,
diperlukan.
hendaklah
dan
masuk
Area
bila
Kelas
didesain
sehingga
dan
dan
tahap
produksi,
dengan
dan risiko terhadap produk jadi.
semua
kegiatan dapat diamati dari luar.
2. Risiko pencemaran silang antar obat produk
biologi, terutama pada tahap proses pembuatan
50. 2. Di area bersih, semua permukaan
di mana digunakan organisme hidup, dapat
yang terpapar hendaklah halus, kedap
memerlukan tindakan pencegahan tambahan
air dan tidak retak untuk mengurangi
terhadap
pelepasan atau akumulasi partikel atau
penggunaan fasilitas dan peralatan tersendiri,
mikroba
produksi secara kampanye dan penggunaan
dan
untuk
memungkinkan
fasilitas
dan
peralatan,
seperti
penggunaan berulang bahan pembersih
sistem tertutup. Sifat produk dan peralatan
dan bahan disinfektan.
yang
digunakan
akan
menentukan
tingkat
pemisahan yang diperlukan untuk mencegah
51. 3. Untuk mengurangi akumulasi debu
dan
memudahkan
pencemaran silang.
pembersihan
hendaklah tidak ada bagian yang sukar
10. 3.
Pada
prinsipnya,
hendaklah
digunakan
dibersihkan dan lis yang menonjol, rak,
fasilitas tersendiri untuk produksi vaksin BCG
lemari serta peralatan hendaklah dalam
dan
jumlah
digunakan dalam produksi produk tuberkulin.
terbatas.
Pintu
hendaklah
penanganan
organisme
hidup
yang
didesain untuk menghindarkan bagian
yang
tersembunyi
dan
sukar
11. 4. Fasilitas tersendiri hendaklah digunakan
dibersihkan; pintu sorong hendaklah untuk
penanganan
Bacillus
anthracis,
dihindarkan karena alasan tersebut.
Clostridium botulinum dan Clostridium tetani
sampai proses inaktivasi selesai.
52.
4. False ceilings hendaklah disegel
untuk mencegah pencemaran dari ruang
12. 5. Produksi secara kampanye dapat diterima
di atasnya.
untuk mikroorganisme lain pembentuk spora
dengan ketentuan bahwa fasilitas tersendiri
53. 5.
Pipa
dan
pendukung
dengan
saluran
lain
serta
hendaklah
tepat
sarana
untuk kelompok produk ini dan tidak boleh lebih
dipasang
dari 1 (satu) produk diproses pada saat yang
sehingga
tidak
sama.
menimbulkan tempat tersembunyi yang
sukar dibersihkan.
13. 6. Produksi secara simultan di area yang sama
menggunakan
54. 6. Bak cuci dan drainase hendaklah
biofermentor
monoklonal
penyekat udara hendaklah dipasang di
menggunakan teknik r-DNA.
mesin
atau
bak
cuci
tertutup
dapat diterima untuk produk seperti antibodi
dilarang di area Kelas A/B. Di area lain,
antara
sistem
dan
produk
yang
dibuat
dan
drainase. Saluran pembuangan untuk
14. 7. Tahap proses setelah panen dapat dilakukan
daerah yang lebih rendah tingkat secara simultan di area produksi yang sama
kebersihannya, jika dipasang, hendaklah asalkan tindakan pencegahan yang tepat
dilengkapi dengan jebakan yang efektif
dilakukan untuk mencegah pencemaran silang.
atau penutup air untuk mencegah aliran
Untuk vaksin yang dimatikan dan toksoid,
balik.
hendaklah
proses yang paralel hendaklah hanya dilakukan
terbuka dan mudah dibersihkan serta
setelah inaktivasi biakan atau sesudah proses
dihubungkan
detoksifikasi.
Semua
saluran
dengan
air
drainase
luar
dengan tepat untuk mencegah cemaran
mikrobiologis masuk.
15. 8.
Produk
seperti
vaksin
yang
dimatikan,
termasuk yang dibuat secara teknik r-DNA,
55. 7. Ruang ganti pakaian hendaklah hanya
digunakan
untuk
personil
digunakan
untuk
lalu
dan
lintas
toksoid dan ekstrak bakteri setelah diinaktivasi
tidak
dapat diisikan ke dalam wadah di bangunan
bahan,
yang sama seperti obat produk biologi steril
wadah dan peralatan.
lain,
dengan
dekontaminasi
56. 8.
Ruang
ganti
pakaian
hendaklah
didesain seperti ruang penyangga udara
ketentuan
dilakukan
tindakan
yang
memadai
setelah
pengisian, termasuk, jika perlu, sterilisasi dan
pencucian.
dan digunakan sebagai pembatas fisik
untuk
pakaian
berbagai
dan
tahap
penggantian
16. 9. Area bertekanan positif hendaklah digunakan
memperkecil cemaran untuk pengolahan produk steril, namun untuk
mikroba dan partikulat terhadap pakaian
area tertentu yang digunakan untuk mikroba
pelindung.
tersebut
patogen hendaklah bertekanan negatif untuk
hendaklah dibilas secara efektif dengan
mencegah penyebaran mikroba patogen keluar
udara
Tahap
dari area tersebut. Apabila area bertekanan
terakhir dari ruang ganti hendaklah,
negatif atau lemari pengaman digunakan untuk
pada
nonoperasional,
memproses mikroba patogen secara aseptik,
kebersihan
area tersebut hendaklah dikelilingi area steril
Ruang
yang
ganti
telah
tersaring.
kondisi
mempunyai
sama
tingkat
dengan
ruang
yang
berikutnya.
bertekanan positif.
Penggunaan ruang ganti terpisah untuk
memasuki
dan
meninggalkan
daerah
17. 10. Unit pengendali udara hendaklah spesifik
bersih kadang-kadang diperlukan. Pada untuk area pengolahan tertentu dan resirkulasi
umumnya hendaklah fasilitas pencucian udara tidak boleh dilakukan dari area di mana
tangan disediakan hanya pada tahap
organisme
awal ruang ganti pakaian.
dibuang melalui filter sterilisasi yang kinerjanya
diperiksa
57. 9. Pintu-pintu ruang penyangga udara
hendaklah
tidak
dibuka
secara
bersamaan. Sistem interlock atau sistem
peringatan
visual
dan/atau
patogen
secara
hidup
rutin
ditangani,
atau
tapi
tindakan
dekontaminasi lain untuk mencegah organisme
patogen di atas kelompok risiko 2 keluar ke
lingkungan sekitar.
audio
hendaklah dioperasikan untuk mencegah
18. 11. Tata letak dan desain area produksi dan
lebih dari satu pintu terbuka pada saat peralatan hendaklah memungkinkan proses
yang bersamaan.
pembersihan dan dekontaminasi yang efektif
(misal fumigasi). Prosedur pembersihan dan
58. 10.
Pasokan
udara
yang
disaring
dekontaminasi hendaklah divalidasi.
hendaklah dapat menjaga perbedaan
tekanan positif dan aliran udara ke area
19. 12. Peralatan yang digunakan untuk menangani
sekelilingnya yang berkelas kebersihan organisme hidup hendaklah didesain untuk
lebih rendah pada seluruh kondisi menjaga agar biakan tetap dalam keadaan
operasional
dan
hendaklah
dapat
membilas area tersebut dengan efektif.
Ruang
bersebelahan
kebersihan
selama proses.
kelas
hendaklah
20. 13. Sistem pemipaan, katup dan filter ventilasi
mempunyai perbedaan tekanan berkisar hendaklah
didesain
secara
tepat
untuk
10 - 15 pascal (nilai acuan). Perhatian memudahkan
proses
pembersihan
dan
khusus
yang
dengan
murni dan tidak tercemar oleh sumber eksternal
berbeda
hendaklah
perlindungan
diberikan
kepada
zona
untuk
sterilisasi. Penggunaan sistem bersihkan di
yang
tempat dan sterilisasi di tempat sangat
mempunyai risiko tertinggi, yaitu, daerah
dianjurkan.
yang udaranya berhubungan langsung
hendaklah dapat disterilisasi dengan uap air
dengan produk dan komponen yang
secara
telah
hendaklah
dibersihkan
yang
akan
bersentuhan dengan produk. Berbagai
Katup
pada
sempurna.
tangki
Filter
hidrofobis
dan
fermentasi
ventilasi
udara
jangka
waktu
pemakaiannya divalidasi.
rekomendasi mengenai pasokan udara
dan
perbedaan
tekanan
mungkin
21. 14.Pengungkung primer hendaklah didesain dan
memerlukan modifikasi bila diperlukan
diuji untuk membuktikan bebas dari risiko
untuk menahan beberapa bahan, misal
kebocoran.
bahan
yang
bersifat
patogenis,
bertoksisitas
tinggi, radioaktif, bahan
22. 15. Limbah cair yang mungkin mengandung
atau produk berupa virus atau berupa
mikroba patogen hendaklah didekontaminasi
bakteri hidup. Dekontaminasi fasilitas
tersebut dan pengolahan udara yang
keluar
dari
area
bersih
secara efektif.
mungkin
diperlukan untuk beberapa kegiatan.
23. 16.
Karena
keanekaragaman
produk
atau
proses biologi, beberapa bahan aditif atau
59. 11. Hendaklah dibuktikan bahwa pola
bahan baku harus diukur atau ditimbang selama
aliran-udara tidak menimbulkan risiko
proses produksi (misal dapar). Dalam hal ini
pencemaran, misal perhatian hendaklah
bahan dapat disediakan dalam jumlah sedikit
diberikan
yang disimpan di area produksi tapi hendaklah
untuk
memastikan
bahwa
aliran udara tidak menyebarkan partikel
dari personil yang menimbulkan partikel,
kegiatan
atau
mesin
ke
zona
yang
mempunyai risiko lebih tinggi terhadap
produk.
60. 12.
Sistem
tersedia
peringatan
untuk
hendaklah
mengindikasikan
kegagalan
pasokan
udara.
perbedaan
tekanan
udara
Indikator
hendaklah
dipasang di antara area di mana hal
tersebut
sangat
penting.
Perbedaan
tekanan udara ini hendaklah dicatat
secara teratur atau didokumentasikan.
61. 13.
Suhu
hendaklah
dan
dijaga
kelembaban
pada
ruangan
tingkat
yang
tidak menyebabkan personil berkeringat
secara
berlebihan
dalam
pakaian
kerjanya.
62. 14. Sistem mekanis atau elektris untuk
komunikasi
lisan
dari
dan
ke
area
kegiatan steril hendaklah didesain dan
dipasang dengan tepat sehingga mudah
dibersihkan
dan
didisinfeksi
secara
efektif.
63. 15. Area bersih untuk kegiatan produksi
steril hendaklah tidak digunakan untuk
melaksanakan
kegiatan
sterilitas dan pengujian
pengujian
mikrobiologis
lain.
64. 16. Pertimbangan perlu diberikan untuk
membatasi akses yang tidak diperlukan
ke area pengisian kritis, misal zona
pengisian Kelas A dengan memasang
barier fisik.
65. 17. Ban berjalan tidak boleh menembus
tidak dikembalikan lagi ke gudang umum.
sekat yang membatasi area Kelas A atau
B dengan ruang proses yang mempunyai
standar kebersihan lebih rendah, kecuali
ban
berjalan
tersebut
dapat
secara
terus-menerus disterilkan (misal melalui
terowongan sterilisasi).
66. 18. Sedapat mungkin peralatan yang
digunakan
untuk
memproses
produk
steril hendaklah dipilih supaya dapat
disterilisasi
secara
efektif
dengan
menggunakan uap, atau panas kering
atau metode lain.
67. 19. Peralatan, fiting dan sarana lain,
sejauh
memungkinkan,
hendaklah
dirancang dan dipasang sedemikian rupa
sehingga
kegiatan,
perawatan
dan
perbaikan dapat dilaksanakan dari luar
area
bersih.
Jika
proses
sterilisasi
diperlukan hendaklah dilakukan setelah
perakitan
kembali
selesai,
bila
memungkinkan.
20. Bila standar kebersihan tidak dapat
dipertahankan saat dilakukan pekerjaan
perawatan yang diperlukan di dalam
ruang bersih, ruang tersebut hendaklah
dibersihkan,
didisinfeksi
disterilkan
sebelum
dan/atau
proses
dimulai
kembali.
69. 21.
nstalasi
distribusi
pengolahan
air
dikonstruksi
menjamin
dan
agar
memenuhi
dan
hendaklah
dirawat
air
yang
persyaratan
sistem
didesain,
untuk
dihasilkan
mutu
yang
sesuai. Hendaklah dipertimbangkan agar
perawatan sistem air mencakup program
pengujian
yang
diperlukan.
Sistem
hendaklah tidak dioperasikan melampaui
kapasitas yang dirancang.
70. 22. Hendaklah dilakukan validasi dan
perawatan terencana terhadap semua
peralatan
seperti
penanganan
ventilasi
dan
udara
sterilisator,
sistem
penyaringan
udara,
dan
filter
gas
serta
sistem pengolahan, penyimpanan dan
pendistribusian air; penggunaan kembali
setelah dilakukan perawatan hendaklah
disetujui dan dicatat.
Pengawasan
Mutu
155.1. Uji sterilitas yang dilakukan terhadap 1. Pengawasan selama-proses berperan sangat
produk jadi hendaklah dianggap hanya
penting untuk menjamin konsistensi mutu
sebagai
bagian
dari
rangkaian
obat produk biologi. Pengawasan yang kritis
pengendalian
untuk
terhadap mutu (misal: penghilangan virus),
memastikan sterilitas dari produk. Uji
tapi yang tidak dapat dilakukan pada produk
sterilitas ini hendaklah divalidasi untuk
jadi,
tindakan
akhir
produk yang berkaitan.
dilakukan
produksi yang tepat.
2. Perlu menyimpan sampel
156.2. Sampel yang diambil untuk pengujian
sterilitas
hendaklah
hendaklah
mewakili
keseluruhan bets, tetapi secara khusus
pada
tahap
produk
antara
dalam kondisi penyimpanan yang tepat dan
jumlah
yang
cukup
untuk
dilakukan
pengujian ulang atau konfirmasi kontrol dari
bets.
yang 3. Proses produksi tertentu misal fermentasi
diambil dari bagian bets yang dianggap
hendaklah dipantau terus- menerus. Data
paling berisiko terhadap kontaminasi,
yang terkumpul menjadi bagian dari catatan
hendaklah
mencakup
sampel
misal:
bets.
4. Jika menggunakan biakan kontinu (continuous
secara
culture), pertimbangan khusus hendaklah
aseptis, sampel hendaklah mencakup
diberikan terhadap persyaratan pengujian
wadah yang diisi pada awal dan akhir
mutu yang timbul dari cara produksi jenis
proses
ini.
a)
untuk
produk
pengisian
yang
bets
diisi
serta
setelah
intervensi yang signifikan; dan
b) untuk produk yang disterilisasi cara
panas
dalam
wadah
akhir,
sampel
hendaklah diambil dari bagian muatan
dengan suhu terendah.
157.3. Kepastian sterilitas dari produk jadi
diperoleh
melalui
validasi
siklus
sterilisasi untuk produk yang disterilisasi
akhir, dan melalui media fill untuk
produk yang diproses secara aseptis.
Catatan pengolahan bets dan, dalam hal
proses aseptis, catatan mutu lingkungan,
hendaklah diperiksa sejalan dengan hasil
uji sterilitas. Prosedur pengujian sterilitas
hendaklah divalidasi untuk produk yang
berkaitan.
Metode
farmakope
harus
digunakan untuk validasi dan kinerja
pengujian sterilitas.
158.4. Untuk produk injeksi, Air untuk Injeksi
(WFI), produk antara dan produk jadi
hendaklah dipantau terhadap endotoksin
dengan
menggunakan
metode
farmakope yang diakui dan tervalidasi
untuk tiap jenis produk. Untuk larutan
infus volume-besar, pemantauan air atau
produk
antara
hendaklah
selalu
dilakukan sebagai pengujian tambahan
terhadap pengujian yang dipersyaratkan
dalam
monografi
produk
jadi
yang
disetujui. Bila terdapat kegagalan uji
sampel, penyebab kegagalan hendaklah
diinvestigasi
dan
dilakukan
perbaikan bila diperlukan.
tindakan
Anda mungkin juga menyukai
- Tambahan Tinjauan PustakaDokumen2 halamanTambahan Tinjauan PustakaElisa Cynthia ArdarickaBelum ada peringkat
- Bab IiiDokumen4 halamanBab IiiElisa Cynthia ArdarickaBelum ada peringkat
- MetodeDokumen1 halamanMetodeElisa Cynthia ArdarickaBelum ada peringkat
- Caker UjiDokumen1 halamanCaker UjiElisa Cynthia ArdarickaBelum ada peringkat
- Formulasi Post Test Ointment PrintDokumen19 halamanFormulasi Post Test Ointment PrintElisa Cynthia ArdarickaBelum ada peringkat
- Jurnal DbsooooooooDokumen8 halamanJurnal DbsooooooooElisa Cynthia ArdarickaBelum ada peringkat
- Basis Krim Dbso As SalisDokumen24 halamanBasis Krim Dbso As SalisElisa Cynthia Ardaricka100% (1)
- Bab 3Dokumen4 halamanBab 3Elisa Cynthia ArdarickaBelum ada peringkat
- Spektrofotometri UVDokumen4 halamanSpektrofotometri UVElisa Cynthia ArdarickaBelum ada peringkat
- Tugas PoctDokumen2 halamanTugas PoctElisa Cynthia ArdarickaBelum ada peringkat
- DBSODokumen31 halamanDBSOElisa Cynthia ArdarickaBelum ada peringkat
- Dextro PVPDokumen4 halamanDextro PVPElisa Cynthia ArdarickaBelum ada peringkat
- ADR Tipe A Kelompok9Dokumen14 halamanADR Tipe A Kelompok9Elisa Cynthia ArdarickaBelum ada peringkat
- ADR Tipe A Kelompok9Dokumen14 halamanADR Tipe A Kelompok9Elisa Cynthia ArdarickaBelum ada peringkat
- StrukturDokumen3 halamanStrukturElisa Cynthia ArdarickaBelum ada peringkat
- Formulasi Post Test Ointment PrintDokumen19 halamanFormulasi Post Test Ointment PrintElisa Cynthia ArdarickaBelum ada peringkat
- StrukturDokumen2 halamanStrukturElisa Cynthia ArdarickaBelum ada peringkat
- Afk ResumeDokumen7 halamanAfk ResumeElisa Cynthia ArdarickaBelum ada peringkat
- Fix DbsoDokumen9 halamanFix DbsoElisa Cynthia ArdarickaBelum ada peringkat
- Dbso Tugas ElisaDokumen5 halamanDbso Tugas ElisaElisa Cynthia ArdarickaBelum ada peringkat
- METODOLOGIDokumen2 halamanMETODOLOGIElisa Cynthia ArdarickaBelum ada peringkat
- Spektrofotometri UVDokumen4 halamanSpektrofotometri UVElisa Cynthia ArdarickaBelum ada peringkat
- Mikrobio Bakteri2Dokumen4 halamanMikrobio Bakteri2Elisa Cynthia ArdarickaBelum ada peringkat
- ADR Tipe A Kelompok9Dokumen14 halamanADR Tipe A Kelompok9Elisa Cynthia ArdarickaBelum ada peringkat
- SEDIAAN SEMI PADATDokumen21 halamanSEDIAAN SEMI PADATElisa Cynthia ArdarickaBelum ada peringkat
- Tanya Jawab FKOKDokumen1 halamanTanya Jawab FKOKElisa Cynthia ArdarickaBelum ada peringkat
- Tugas POCT ElisaDokumen2 halamanTugas POCT ElisaElisa Cynthia ArdarickaBelum ada peringkat
- Mikrobio BakteriDokumen3 halamanMikrobio BakteriElisa Cynthia ArdarickaBelum ada peringkat
- PPF Transdermal Daftar IsiDokumen5 halamanPPF Transdermal Daftar IsiElisa Cynthia ArdarickaBelum ada peringkat