Anorganik Trnsleitan
Diunggah oleh
Evi0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
13 tayangan2 halamanKompleks planar persegi kurang umum dibandingkan kompleks tetrahedral karena pengaruh sterik. Beberapa ion logam seperti Ni2+, Pd2+, Pt2+ dan Au3+ membentuk kompleks planar persegi dengan ligan medan kuat seperti sianida. Kompleks planar persegi Cd(OAr)2(thf)2 baru-baru ini dilaport untuk Cd2+ meskipun biasanya geometri oktahedral lebih umum untuk spesies d10.
Deskripsi Asli:
Mklah
Judul Asli
anorganik trnsleitan
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniKompleks planar persegi kurang umum dibandingkan kompleks tetrahedral karena pengaruh sterik. Beberapa ion logam seperti Ni2+, Pd2+, Pt2+ dan Au3+ membentuk kompleks planar persegi dengan ligan medan kuat seperti sianida. Kompleks planar persegi Cd(OAr)2(thf)2 baru-baru ini dilaport untuk Cd2+ meskipun biasanya geometri oktahedral lebih umum untuk spesies d10.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
13 tayangan2 halamanAnorganik Trnsleitan
Diunggah oleh
EviKompleks planar persegi kurang umum dibandingkan kompleks tetrahedral karena pengaruh sterik. Beberapa ion logam seperti Ni2+, Pd2+, Pt2+ dan Au3+ membentuk kompleks planar persegi dengan ligan medan kuat seperti sianida. Kompleks planar persegi Cd(OAr)2(thf)2 baru-baru ini dilaport untuk Cd2+ meskipun biasanya geometri oktahedral lebih umum untuk spesies d10.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
komplex planar persegi kurang disukai secara strerik
daripada kompleks tetrahedral (lihat tabel 12.1) dan
karena itu sangat padat oleh ligan besar
di sisi lain, jika ligan cukup kecil untuk membentuk
kompleks planar persegi, kompleks oktahedral dengan
dua ikatan sigma tambahan van biasanya terbentuk
dengan sedikit atau tanpa tambahan tolakan sterik
kompleks persegi planar dengan demikian hanya dibentuk
oleh beberapa ion logam.
Yang paling terkenal adalah spesies d8 seperti Ni2 +, Pd2
+, Pt2 + dan Au3 +.Ada juga kompleks Cu2 + (d9), Co2 +
(d7), Cr2 + (d4) dan bahkan Co3 + (d6) yang berbentuk
bujur sangkar, tetapi kompleks seperti itu tidak umum
prasyarat untuk stabilitas kompleks planar persegi ini
adalah adanya ligan medan yang kuat dan tidak kuat yang
berikatan vhi cukup baik untuk mengimbangi energi yang
"hilang" melalui empat dari pada enam koordinasi. Untuk
Ni2 +, misalnya, ion sianida membentuk kompleks planar
persegi, sedangkan amonia dan air membentuk kompleks
tetrahedral. Untuk logam yang lebih berat persyaratan
steriknya lebih longgar dan kekuatan medan efektif semua
ligan meningkat. dalam kondisi ini, bahkan anion
tetrachloropalladate (II), tetrachloropalladate (II), dan
tetrachloroaurate (III) adalah planar spin rendah persegi
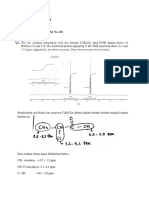
satu kompleks planar kuadrat tak terduga [Cd (OAr) 2
(thf) 2] (Gbr.12.4) baru-baru ini dilaporkan. ini adalah
contoh pertama dalam geometri ini untuk d10 Cd2 +.
sejauh kompleks yang terkait erat dengan ion seng yang
lebih kecil. [Zn (OAr) 2 (thr) 2], telah mendistorsi
geometri tetrahedral, faktor sterik yang sederhana tidak
dapat menjelaskan gejala pseudo-D2h dari kompleks
kadmium, meskipun untuk memastikan, relaksasi sterik
dari atom logam yang lebih besar dan bidang tegak lurus
cincin thf dan fenoksida dengan baik ditampung olehnya.
Selanjutnya, geometri oktahedral tidak akan biasa dalam
spesies d10.
tetapi kelompok 2,6-di-t-butil dapat mencegah koordinasi
ligan kelima dan keenam
Anda mungkin juga menyukai
- Pembagian Kelompok KimiaDokumen1 halamanPembagian Kelompok KimiaEviBelum ada peringkat
- Ibu Menyusui PuskesmasDokumen7 halamanIbu Menyusui PuskesmasEviBelum ada peringkat
- Bab 1 Survei SDDokumen12 halamanBab 1 Survei SDEviBelum ada peringkat
- ANALISIS EFEKTIFITAS PROGRAM SEKOLAH LIMA HARI (Repaired)Dokumen27 halamanANALISIS EFEKTIFITAS PROGRAM SEKOLAH LIMA HARI (Repaired)EviBelum ada peringkat
- TugasDokumen2 halamanTugasEvi Lestari SihombingBelum ada peringkat
- Bahasa IndonesiaDokumen4 halamanBahasa IndonesiaEviBelum ada peringkat
- Dokumen AaaDokumen3 halamanDokumen AaaEviBelum ada peringkat
- Elusidasi StrukturDokumen1 halamanElusidasi StrukturEviBelum ada peringkat
- Anorganik Trnsleitan KelarDokumen6 halamanAnorganik Trnsleitan KelarEviBelum ada peringkat
- Tugas 2Dokumen2 halamanTugas 2EviBelum ada peringkat
- Ketikan KoordinasiDokumen10 halamanKetikan KoordinasiEviBelum ada peringkat
- Terpen 2Dokumen1 halamanTerpen 2EviBelum ada peringkat
- Terpen 2Dokumen1 halamanTerpen 2EviBelum ada peringkat
- DokumenDokumen19 halamanDokumenEviBelum ada peringkat
- DokumenDokumen3 halamanDokumenEviBelum ada peringkat
- Tugas Kimia TanahDokumen4 halamanTugas Kimia TanahEviBelum ada peringkat
- Peran Pemerintah Dalam Memerangi BeritaDokumen23 halamanPeran Pemerintah Dalam Memerangi Beritafasilitasi aplikasiBelum ada peringkat
- Biokimia "Protein": Dosen Pemngampu Irwandi Y. Suaka S.PD.,M.PDDokumen18 halamanBiokimia "Protein": Dosen Pemngampu Irwandi Y. Suaka S.PD.,M.PDEviBelum ada peringkat
- MMMMDokumen1 halamanMMMMEviBelum ada peringkat
- 5 6080068395569512617Dokumen3 halaman5 6080068395569512617EviBelum ada peringkat
- Pengaruh Penambahan Tepung Ikan Gabus Pada Pembuatan Biskuit Terhadap Status Gizi BalitaDokumen5 halamanPengaruh Penambahan Tepung Ikan Gabus Pada Pembuatan Biskuit Terhadap Status Gizi BalitaEviBelum ada peringkat
- 7-Orientasi & In-Service Training (Revjan'03)Dokumen17 halaman7-Orientasi & In-Service Training (Revjan'03)Abdul Qohin Ar RombangiBelum ada peringkat
- Isi 1Dokumen14 halamanIsi 1EviBelum ada peringkat
- Tugas 1Dokumen4 halamanTugas 1EviBelum ada peringkat
- MembranDokumen5 halamanMembranEviBelum ada peringkat
- Senyawa KoordinasiDokumen18 halamanSenyawa KoordinasiEvi100% (1)
- Angket Bagaimana Tampilan KopiDokumen1 halamanAngket Bagaimana Tampilan KopiEviBelum ada peringkat
- Hipotesis PenelitianDokumen36 halamanHipotesis PenelitianEviBelum ada peringkat
- DBD Dan MalariaDokumen33 halamanDBD Dan MalariaEviBelum ada peringkat