12 Soal Persiapan Pas Ganjil
Diunggah oleh
19 Ni Kadek Dea Purnami0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
89 tayangan9 halaman1. Soal pertama memberikan pilihan tentang jumlah air yang digunakan untuk membuat larutan 1 molal NaOH.
2. Soal kedua menanyakan sifat koligatif yang tidak termasuk penurunan titik beku.
3. Soal ketiga memberikan data tentang tekanan uap larutan NaCl dan menanyakan nilai tekanan uapnya.
Deskripsi Asli:
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Ini1. Soal pertama memberikan pilihan tentang jumlah air yang digunakan untuk membuat larutan 1 molal NaOH.
2. Soal kedua menanyakan sifat koligatif yang tidak termasuk penurunan titik beku.
3. Soal ketiga memberikan data tentang tekanan uap larutan NaCl dan menanyakan nilai tekanan uapnya.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
89 tayangan9 halaman12 Soal Persiapan Pas Ganjil
Diunggah oleh
19 Ni Kadek Dea Purnami1. Soal pertama memberikan pilihan tentang jumlah air yang digunakan untuk membuat larutan 1 molal NaOH.
2. Soal kedua menanyakan sifat koligatif yang tidak termasuk penurunan titik beku.
3. Soal ketiga memberikan data tentang tekanan uap larutan NaCl dan menanyakan nilai tekanan uapnya.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 9
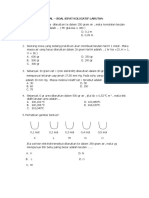
1.
Larutan 1 molal NaOH terbuat dari 1 mol (40
gram) NaOH dengan …
A. 1 liter air
B. 960 gram air
C. 1000 gram air
D. 960 mL air
E. Air hingga volume larutan 1 liter
2. Diantara sifat larutan di bawah ini yang tidak
termasuk sifat koligatif larutan adalah ….
A. Penurunan tekanan uap
B. Tekanan osmosis Dilarutkan 5 gram Dilarutkan 5 gram
C. Kenaikan titik beku gula dalam 48 gram NaCl dalam 48 gram
D. Penurunan titik beku air sehingga titih air sehingga titih
E. Kenaikan titik didih didihnya 100,3oC didihnya 101,85oC
3. Tekanan uap jenuh air pada 29oC adalah 30
Jika Mr NaCl = 58,5, Mr glukosa = 180 dan Tb
mmHg. Pada suhu yang sama, tekanan uap
air = 100oC, tetapan kenaikan titik didih molal air
larutan dari 58,5 gram NaCl (Mr =58,5) dalam
dalam larutan glukosa dan NaCl adalah ….
900 gram air adalah … mmHg
A. 0,52oC/molal
A. 21/51 x 30
B. 0,54oC/molal
B. 9/10 x 30
C. 0,55oC/molal
C. 18/19 x 30
D. 0,56oC/molal
D. 1/50 x 30
E. 0,57oC/molal
E. 50/52 x 30
7. Perhatikan larutan garam berikut!
4. Untuk menaikkan titik didih 250 mL air menjadi
(1) Besi (III) klorida 0,5 m
100,1oC pada tekanan 1 atm (Kb = 0,50 oC/molal),
(2) Natrium sulfat 0,5 m
maka jumlah gula (Mr =342) yang harus
(3) Magnesium nitrat 0,5m
dilarutkan adalah …. gram
(4) Kalium klorida 0,5m
A. 17,1
(5) Aluminium sulfat 0,5 m
B. 86
Larutan yang memiliki titik beku paling tinggi
C. 342
adalah garam nomor …
D. 684
A. (1)
E. 171
B. (2)
5. Berikut ini data percobaan tentang titik beku
C. (3)
beberapa larutan.
D. (4)
Larutan E. (5)
Zat
No Konsentrasi Titik beku
terlarut 8. Ke dalam 200 mL air ( = 1 g/mL) dilarutkan
(m) (oC)
suatu basa M(OH)2. Larutan ini mendidih pada
(1) C6H12O6 1 - 0,5 suhu 102,6oC. Jika basa tersebut mempunya Mr =
(2) C6H12O6 2 - 1,0 74 dan mengion 80%, massa basa yang dilarutkan
(3) BaCl2 1 -1,5 adalah ….( Kb air = 0,52oC/molal)
Pada konsentrasi yang sama, larutan C 6H12O6 dan A. 4,35 gram
BaCl2 memiliki titik beku yang berbeda. Hal ini B. 24,67 gram
disebabkan karena …. C. 28,46 gram
A. Mempunyai derajat ionisasi yang sama D. 37,00 gram
B. Mempunyai jumlah partikel yang sama E. 74,00 gram
C. Kedua senyawa terbentuk secara kovalen 9. Sebanyak 1,17 gram NaCl (Ar Na = 23; Cl =
D. Jumlah partikel BaCl2 lebih banyak daripada 35,5) dilarutan dalam air sampai volume 500 mL,
C6H12O6 pada suhu 27oC. Tekanan osmosis larutan yang
E. Derajat ionisasi BaCl2 lebih kecil daripada terjadi sebesar ….
C6H12O6 A. 0,394 atm
6. Perhatikan percobaan pengukuran titik didih gula B. 19,68 atm
(glukosa) dan garam dapur (NaCl) berikut! C. 39,36 atm
(1) (2)
D. 1,968 atm B. 10 mmHg
E. 3,936 atm C. 20 mmHg
10. Di antara larutan berikut yang mempunyai titik D. 25 mmHg
E. 30 mmHg
didih tertinggi adalah ….
16. Sebanyak 15 gram suatu senyawa nonelektrolit
A. 0,1 M NaOH
dan 29,25 gram NaCl (Ar Na = 23; Cl = 35,5)
B. 0,1 M KCl
C. 0,1 M Na2SO4 dilarutkan dalam 500 gram air. Larutan tersebut
D. 0,1 M HCl membeku pada suhu -4,65°C (Kf air = 1,86).
E. 0,1 M Fe(NO3)2 Harga Mr senyawa non-elektrolit itu adalah …
11. Tiga gram zat nonelektrolit dalam 250 gram air A. 60 D. 90
mempunyai penurunan titik beku setengah dari B. 120 E. 180
penurunan titik beku 5,85 gram garam dapur (Mr C. 240
= 58,5) dalam 500 gram air. Maka massa molekul 17. Suatu larutan glukosa dalam 500 gram air (Kb =
relatif dari zat nonelektrolit adalah .... 0,52) mendidih pada suhu 100,65°C. Apabila
A. 45 D. 120 seluruh glukosa difermentasikhn menjadi alkohol
B. 60 E. 342 menurut reaksi:
C. 76 C6H1206 2 C2H5OH + 2 CO2
12. Diketahui tetapan gas ideal R = 0,082 L atm K -1 maka volume gas CO2 yang terbentuk pada STP
mol-1 dan Mr sukrosa = 342 g mol -1 dilarutkan adalah ….
dalam air sampai volume 100 mL maka pada A. 5,6 liter D. 14 liter
temperatur 27 oC larutan tersebut akan B. 8 liter E. 22,4 liter
C. 11,2 liter
mempunyai tekanan osmotik sebesar ….
18. Suatu zat nonelektrolit dilarutkan ke dalam air
A. 0,092 atm
dengan perbandingan massa 2 : 3, dan ternyata
B. 0,984 atm
C. 4,92 atm larutan itu mempunyai tekanan uap 15 mmHg
D. 6,15 atm pada suhu 20°C. Jika tekanan uap air pada suhu
E. 9,84 atm tersebut' adalah 18 mmHg, massa molekul zat
13. Dari pengukuran titik didih diiperoleh data nonelektrolit itu adalah ….
sebagai berikut: A. 45 D. 54
Nama Zat Titik Didih B. 60 E. 72
Air murni 100 oC C. 75
Larutan urea 1 m 100,52 oC 19. Pada suhu tertentu benzena murni mempunyai
Larutan NaCl 1 m 101,04 oC tekanan uap jenuh 75 mmHg. Tekanan uap jenuh
Larutan urea 2 m 101,04 oC benzena pada larutan 6,4% naftalena (Mr = 128)
Larutan NaCl 2 m 102,08 oC dalam benzena (Mr = 78) adalah ....
Berdasarkan data di atas, dapat disimpulkan A. 3 mmHg D. 45 mmHg
bahwa titik didih larutan ditentukan olah …. B. 72 mmHg E. 15 mmHg
A. jenis zat terlarut C. 63 mmHg
B. konsentrasi larutan 20. Pada reaksi redoks
C. jumlah partikel zat terlarut
D. massa zat terlarut 3Cl2 + 6NaOH 5NaCl + NaClO3 + 2H2O.
E. massa jenis zat Bilangan oksidasi atom Cl berubah dari ….
14. Sebanyak 500 mL larutan glukosa (Mr = 180) A. 0 menjadi -1 dan +5
isotonik dengan larutan CaCl 2 0,1 M. Banyaknya B. -1 menjadi +1
glukosa yang terdapat dalam larutan tersebut C. 0 menjadi -1 dan +7
adalah …. D. 0 menjadi -1
A. 9 g E. +1 menjadi -1
B. 18 g 21. Bilangan oksidasi Cr pada ion Cr 2O72- dan
C. 27 g senyawa K2CrO4 secara berturut-turut adalah ….
D. 36 g A. +3 dan +3
E. 54 g
B. +4 dan +3
15. Tekanan uap air pada temperature 26 oC adalah
C. +5 dan +5
25 mmHg. Jika 46 g etanol (C 2H5OH) dicampur
D. +6 dan +4
dengan 72 g air pada temperatur tersebut, tekanan
E. +6 dan +6
uap larutan menjadi …. (Ar C = 12, H = 1, O =
22. Perhatikan persamaan reaksi redoks berikut!
16)
A. 5 mmHg
MnO2 + 2H2SO4 + 2 NaI MnSO4 + Na2SO4 + I2 D. 1 dan 2
+ 2H2O E. 1, 2, 3
Spesi yang merupakan oksidator pada persamaan 28. MnO4- + SO32- Mn2+ + SO42-, maka setiap mol
reaksi tersebut adalah …. ion permanganat dapat megoksidasi ion sulfit
A. MnO2, karena mengalami penurunan bilangan sebanyak ….
oksidasi A. 1 mol
B. H2SO4, karena mengalami kenaikan bilangan B. 2 mol
oksidasi C. 4 mol
D. 2,5 mol
C. NaI, karena dapat mereduksi H2O
E. 5 mol
D. Mn2+, karena dapat mengoksidasi H2O 29. Suatu reaksi redoks: aKBr + KMnO4 + bH2SO4
E. I-, karena mengalami reduksi
cBr2 + MnSO4 + dK2SO4 + H2O. Setelah
23. Pada reaksi Fe2+ + MnO4- Fe3+ + Mn2+, disetarakan maka harga koefisien a,b,c, dan d
pernyataan yang benar adalah …. berturut-turut adalah ….
A. Mn dioksidasi A. 10, 8, 6, 5
B. Fe2+ direduksi B. 2, 8, 1, 6
C. Bilangan oksidasi Mn dari +2 menjadi +7 C. 10, 2, 5, 8
D. Setengah reaksi oksidasinya MnO4- Mn2+ D. 10, 8, 5, 6
E. Bilangan oksidasi Mn dari +7 menjadi +2 E. 2, 8, 5, 3
24. Untuk mengoksidasi 0,4 mol Na2S2O3 dalam 30. Bilangan oksidasi Mn sama dengan 7 terdapat
suasana basa dengan reaksi dalam senyawa ….
A. K2MnO4
S2O32- + MnO4- + H2O MnO2 + SO42- + OH-
B. KMnO4
(belum setara) diperlukan KMnO4 sebanyak …. C. MnO2
A. 1,06 mol D. Mn2O3
B. 3 mol E. MnSO4
C. 2,5 mol 31. Reduksi 1 mol ion BrO3- menjadi Br-
D. 4 mol membutuhkan elektron sebanyak ….
E. 2 mol A. 5 mol
25. Pada persamaan reaksi redoks : aMnO 4- + H+ + B. 4 mol
C2O42- Mn2+ + H2O + CO2. Harga a dan b C. 3 mol
D. 2 mol
berturut-turut adalah ….
E. 6 mol
A. 2 dan 3 D. 2 dan 4 32. Pada reaksi redoks: Sn + 4HNO 3 SnO2 + 2NO2
B. 2 dan 2 E. 2 dan 5
+ 2H2O, yang berperan sebagai reduktor adalah
C. 1 dan 5
26. Pada reaksi redoks: Br2 Br- + BrO3-, jika Br2 …
menjadi Br- menerima x elektron, dan Br 2 A. Sn
B. HNO3
menjadi BrO3- melepaskan y elektron. Apabila x
C. SnO2
dan y dinyatakan dengan angka, maka x dan y D. NO2
adalah …. E. H2O
A. 1 dan 2 33. Bilangan oksidasi klor tertinggi terdapat pada
B. 2 dan 8 senyawa ….
C. 1 dan 5 A. Natrium perklorat
D. 2 dan 5 B. Kalium klorit
E. 2 dan 10 C. Kalium klorat
27. Perhatikan pernyataan berikut D. Kalium klorida
1) Reaksi pelepasan hidrogen E. Natrium hipoklorit
2) Reaksi penurunan biloks 34. Logam aluminium bereaksi dengan ion nitrat
3) Reaksi pembebasan elektron NO3- dalam larutan basa untuk membentuk AlO 2-
4) Reaksi pengikatan oksigen.
dan gas NH3. Persamaan reaksi yang setara akan
Dari pernyataan di atas yang merupakan konsep
memerlukan ….
dari reduksi adalah …
A. Lima H2O diruas kiri
A. 3 dan 4 B. Dua H2O diruas kanan
C. Delapan H2O diruas kiri
B. 1 dan 3
D. Dua H2O diruas kiri
C. 2 dan 4 E. Lima H2O diruas kanan
35. Diketahui reaksi: MnO4- + I- + 16H+ Mn2+ + I2 B. 2, 6, 8, 2, 4, 5
+ 8H2O jika disetarakan koefisien I2 adalah … C. 2, 2, 7, 2, 6, 8
A. 3 D. 2, 6, 7, 2, 5, 8
B. 2 E. 2, 3, 8, 2, 6, 8
C. 1 43. Reaksi redoks: H2S + Cr2O72- S + Cr3+
D. 5 berlangsung dalam lingkungan asam. Setiap mol
E. 4 Cr2O72- memerulak ion H+ sebanyak ….
36. Perhatikan reaksi berikut: 2HI + 2HNO2 2H2O A. 10 mol
+ 2NO + I2. Pernyataan berikut yang benar adalah B. 4 mol
…. C. 6 mol
A. HI adalah zat pereduksi D. 8 mol
B. HNO2 adalah zat pereduksi E. 12 mol
C. I2 adalah zat pereduksi 44. Reaksi : aZn + bNO3- cZn2+ + NH4+ (asam)
D. H2O adalah zat pengoksidasi Jika disetarakan koefisien H2O adalah ….
E. H2O adalah zat pereduksi A. 1
37. Perhatikan reaksi berikut: B. 2
Cl2 + 2KOH KCl + KClO + H2O C. 3
Bilangan oksidasi yang terdapat pada reduktor dan D. 4
hasil oksidasinya adalah …. E. 5
A. -1 dan 0 45. Reaksi: SO42- SO2 setelah disetarakan maka
B. -1 dan +1 penambahan elektron …
C. +1 dan 0 A. 2e dikiri tanda panah
D. 0 dan +1 B. 1 e dikanan tanda panah
E. 0 dan -1 C. 1 e dikiri tanda panah
38. Reaksi reduksi dibawah ini yang membutuhkan 2 D. 4e dikiri tanda panah
elektron adalah …. E. 2e dikanan tanda panah
A. S2O32- S 46. Untuk reaksi: MnO4- + C2O42- Mn2+ + 2CO2
B. ClO3- Cl- dalam suasana asam, maka pernyataan yang
C. SO42- SO2 benar adalah …
D. NO3- NO A. Membutuhkan 4 mol H2O diruas kiri
E. AlO2- Al B. Setiap mol C2O42- menghasilakn 5 mol CO2
39. Unsur yang memiliki bilangan oksidasi sama C. Membutuhkan 14 elektron untuk
dengan unsur Cl didalam HClO3 adalah … menyetarakan reaksi
A. Br dalam HBrO4 D. Setiap mol MnO4- menghasilkan 2 mol Mn2+
B. Fe dalam Fe2O3 E. Menghasilkan 10 mol gas CO2
C. Sb dalam ion SbO43- 47. Reaksi: NO NO2 disetarakan dalam suasana
D. Mn dalam KMnO4 asam, sampai tahap
E. Cr dalam ion Cr2O42- NO + H2O NO2, langkah selanjutnya adalah ….
40. Oksidasi 1 mol Cr2+ menjadi CrO42- melepaskan A. 2H+ kiri dan 2e kanan
elektron sebanyak … B. 2H+ dan 2e dikiri
A. 5 mol C. 2H+ dan 2e dikanan
B. 4 mol D. 2H+ dan 1e dikanan
C. 3 mol E. 2H+ dan 2e dikiri
D. 1 mol 48. Gas klorin dalam suasana basa dapat mengalami
E. 2 mol disproposionasi menjadi ion klorida dan ion
41. Reaksi: Br2 + Zn2+ BrO3- + Zn (basa), jika klorat. Persamaan reaksi setaranya adalah …
disetarakan koefisiennya berturut-turut adalah A. 5Cl2 + 8OH- 6Cl- + 4ClO3- + 6H2O
….. B. 4Cl2 + 2OH- 5Cl- + 2ClO3- + 2H2O
A. 5, 2, 1, 5 C. 2Cl2 + 4OH- 2Cl- + ClO3- + 2H2O
B. 1, 3, 5, 5 D. Cl2 + 2OH- Cl- + ClO3- + H2O
C. 1, 5, 2, 5 E. 3Cl2 + 6OH- 5Cl- + ClO3- + 3H2O
D. 5, 2, 5, 1 49. Menurut reaksi
E. 5, 1, 5, 2 aBr- + 2NO3- + b H+ Br2 + 2NO2 + cH2O
42. Diketahui reaksi di bawah ini, jika disetarakan Agar reaksi redoks tersebut setara maka nilai a, b,
nilai a, b, c, d, e dan f berturut-turut adalah … dan c berturut-turut adalah ….
aMnO + bPbO2 + cH+ d MnO4- + ePb2+ + fH2O A. 2, 8, 4
A. 2, 5, 8, 2, 5, 4 B. 1, 2, 1
C. 2, 4, 1 C. Mg + H2SO4 MgSO4 + H2
D. 3, 8, 4 D. H2 + Cl2 HCl
E. 2, 4, 2 E. Na + H2O NaOH + H2
50. Bilangan oksidasi V dan S dalam senyawa 57. Jika reaksi: Cu2+ + NO Cu + NO3- (belum
VOSO4 berturut-turut adalah …. setara) dilengkapi maka persamaan reaksi itu
A. +6 dan +6 mengandung ….
B. +2 dan -2 A. 10 H+ dan 5 H2O
C. – 4 dan + 4 B. 8 H+ dan 4 H2O
D. – 2 dan + 2 C. 4OH- dan 2H2O
E. + 4 dan +6 D. 8 OH- dan 4 H2O
51. Gas klor dapat dibuat melalui reaksi redoks E. 4H+ dan 2H2O
berikut 58. Pada reaksi : MnO4- + C2O42- Mn2+ + CO2.
aK2Cr2O7 + 14HCl 2KCl + bCrCl3 + c Cl2 + d Jumlah mol C2O42- yang dapat dioksidasi oleh 1
H2O mol MnO4- adalah ….
Setelah disetarakan nilai koefisien reaksi a, b, c,
A. 0,4
dan secara berurutan adalah ….
B. 2,5
A. 2, 2, 3, 7
C. 5
B. 2, 1, 2, 7
D. 2
C. 1, 2, 3, 7
E. 1
D. 1, 2, 2, 7
59. Diantara reaksi-reaksi dibawah ini yang bukan
E. 1, 2, 1, 7
52. Pada persamaan reaksi redoks: merupakan reaksi redoks adalah ….
aCu + b NO3- + H+ c Cu2+ + NO + dH2O A. MnO2 + 4HCl MnCl2 + 2H2O + Cl2
Harga koefisien a, b, c, dan d berturut-turut adalah B. H2 + Cl2 2HCl
… C. SnCl2 + I2 + 2HCl SnCl4 + 2HI
A. 2, 1, 2, dan 2 D. Cu2O + C 2Cu + CO
B. 4, 1, 2, dan 4 E. CuO + 2HCl CuCl2 +H2O
C. 4, 1, 2, dan 3 60. Diperhatikan reaksi redoks:
D. 2, 1, 2, dan 4 Cr2O72- + SO32- Cr3+ + SO42-
E. 3, 2, 3, dan 4 Setelah reaksi disetarakan perbandingan
53. Reaksi redoks: banyaknya mol ion Cr2O72- dengan SO42- dalam
aCr2O72- + bC2O42- + H+ dCr3+ + e CO2 + fH2O reaksi tersebut adalah …
Setelah disetarakan mempunyai a, b, d, dan e A. 3 : 2
berturut-turut … B. 1 : 3
A. 6, 2, 3, 1 C. 1 : 6
B. 2, 3, 2, 3 D. 3 : 1
C. 1, 3, 1, 6 E. 2 : 3
D. 2, 3, 2, 6 61. Jumlah mol yang terlibat dalam
E. 1, 3, 2, 6 As + NO3- AsO43- + NO adalah …
54. Pada persamaan redoks: A. 15
aMnO4- + 6H+ + b C2H2O4 aMn2+ + 8 H2O + B. 3
10CO2, nilai a dan b berturut-turut adalah … C. 5
A. 2 dan 3 D. 9
B. 4 dan 4 E. 12
C. 2 dan 5 62. Reduksi 1 mol ion BrO3- menjadi Br-
D. 2 dan 4 membutuhkan elektron sebanyak …
E. 3 dan 5 A. 3 mol
55. Reaksi redoks: Cl2 +KOH KCl + KClO + H2O. B. 2 mol
Bilangan oksidasi unsur yang mengalami reaksi C. 4 mol
autodeoks beribah dari … D. 6 mol
A. – 2 menjadi 0 dan +1 E. 5 mol
B. 0 menjadi – 1 dan – 2 63. Suatu reaksi redoks
C. – 1 menjadi +1 dan 0 aBr2 + bOH- cBrO3- + dBr- + eH2O
D. +1 menjadi – 1 dan 0 harga a, b, c, d, dan e berturut-turut agar reaksi
E. 0 menjadi – 1 dan +1 diatas setara adalah …
56. Dibawa ini yang bukan reaksi redoks adalah … A. 3, 6, 5, 1, dan 3
A. CaCO3 + HCl CaCl2 + H2O + CO2 B. 6, 1, 3, 5, dan 3
B. Zn + CuSO4 ZnSO4 + Cu C. 3, 6, 1, 5, dan 3
D. 1, 5, 3, 6, dan 3 70. Diketahui:
E. 6, 1, 5, 2, dan 3 Mg2+ + 2 e– Mg E° = –2,37 V
64. Unsur Mn yang memiliki bilangan oksidasi sama Ni2+ + 2 e– Ni E° = –0,25 V
dengan bilangan oksidasi Cr dalam K 2Cr2O7 Besarnya potensial sel yang ditimbulkan oleh
adalah … reaksi:
A. MnO2 Mg + NiCl2 MgCl2 + Ni adalah ....
B. MnO A. –2,12 V D. –2,62 V
C. KMnO4
B. +2,12 V E. +2,62 V
D. MnSO4
E. K2MnO4 C. +1,06 V
65. Perhatikan reaksi redoks berikut 71. Diketahui reaksi:
aCr2O72- + bH+ + cCl- dCr3+ + eH2O + f Cl2 2 AgNO3 + Cu 2 Ag + Cu(NO3)2
Nilai koefisien reaksi untuk a, b, dan c berturut- Notasi sel volta yang didasarkan reaksi di atas
turut adalah … adalah ....
A. 1, 2, dan 4 A. Cu / Cu2+ || Ag+ / Ag
B. 1, 14, dan 2 B. Cu / Cu2+ || Ag / Ag+
C. 1, 2, dan 2
C. Ag2+ / Cu || Ag / Cu2+
D. 2, 7, dan 6
E. 1, 14, dan 6 D. Ag / Ag+ || Cu / Cu2+
66. H2S dapat dioksidasi oleh KMnO 4 menghasilkan E. Ag+ / Ag || Cu / Cu2+
K2SO4 dan MnSO4. Dalam reaksi ini, setiap mol 72. Berikut ini beberapa percobaan siswa untuk
H2S melepas …. mempelajari perkaratan
A. 5 mol elektron 1) Paku dimasukkan tabung terbuka berisi air
B. 4 mol elektron 2) Paku dimasukkan tabung tertutup berisi CaCl 2
C. 7 mol elektron anhidrat
D. 2 mol elektron 3) Paku dimasukkan tabung tertutup berisi air
E. 8 mol elektron dididihkan
67. Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan 4) Paku dimasukkan tabung terbuka berisi larutan
elektron sebanyak … NaCl
5) Paku tabung terbuka berisi minyak tanah
A. 3 mol
Paku paling cepat mengalami korosi terdapat pada
B. 4 mol
percobaan nomor ….
C. 2 mol
D. 5 mol A. 1
E. 1 mol B. 2
68. Logam L dapat mengendapkan tembaga dari C. 3
larutan CuSO4, tetapi logam L tidak dapat D. 4
bereaksi dengan ZnCl2, maka urutan logam E. 5
berikut yang sifat reduktornya makin kuat adalah 73. Diketahui
…. Fe2+ + 2e Fe Eo = - 0,44 Volt
A. Zn, Cu, L Ni2+ + 2e Ni Eo = - 0,25 Volt
B. Cu, L, Zn Mg2+ + 2e Mg Eo = - 2,37 Volt
C. Cu, Zn, L Cu2+ + 2e Cu Eo = + 0,34 Volt
D. L, Cu, Zn Ag+ + e Ag Eo = + 0,80 Volt
E. Zn, L, Cu Pb2+ + 2e Pb Eo = - 0,13 Volt
69. Diketahui Logam yang dapat melindungi besi dari perkaratan
Zn/Zn2+//Cu2+/Cu Eo = 1,10 volt dengan perlindungan katodik adalah ….
Mg/Mg2+//Pb2+/Pb Eo = 2,21 volt
A. Ni
Pb/Pb2+//Cu2+/Cu Eo = 0,47 volt
B. Mg
Dari data diatas, maka harga potensial sel dari
C. Cu
Mg/Mg2+//Cu2+/Cu adalah ….
D. Ag
A. 2,00 volt
E. Pb
B. 0,21 volt
74. Logam yang dapat mencegah korosi besi yang
C. 0,57 volt
ditanam di dalam tanah adalah ….
D. 2,68 volt
A. Nikel
E. 0,12 volt
B. Magnesium
C. Timbal E. 16 gram
D. Tembaga 82. Pada elektrolisis larutan MSO4 di katode
E. Timah terbentuk 0,295 gram logam M. Larutan hasil
75. Faktor-faktor yang berasal dari lingkungan elektrolisis dapat dinetralkan oleh 50 mL larutan
berikut dapat mempengaruhi korosi, kecuali NaOH 0,2 M. Massa atom relatif logam M adalah
A. Keasaman ....
B. Kelembaban A. 29,50 D. 73,75
C. Suhu B. 44,25 E. 118,0
D. Udara C. 59,00
E. Struktur Bahan 83. Sendok yang terbuat dari logam aluminium akan
76. Mudah atau tidaknya logam berkarat tergantung dilapisi perak dengan cara disepuh. Larutan yang
pada … dipakai adalah larutan AgNO3. Penyepuhan
A. Keaktifan Logam dilakukan dengan cara elektrolisis larutan AgNO 3
B. Banyaknya oksigen dengan elektrode Ag (katode) dan aluminium
C. Suhu Lingkungan (anode) menggunakan arus listrik 10 A dan
D. Tingkat Kebasaan waktu 8 menit. Massa perak yang mengendap di
E. Banyaknya air katode adalah …. (Ar Ag =108; 1 F = 96500
77. Pelapisan besi menggunakan plastik lebih cocok C/mol)
digunakan pada alat …. 108 × 10 ×8
A. Alat rumah tangga
gram
A. 96500
B. Kerangka jembatan
96500×8
C. Alat memasak gram
D. Kerangka rumah B. 108 × 10 ×60
E. Onderdil sepeda motor 108 × 10 ×8× 60
78. Logam yang dapat mencegah korosi pada bumper gram
C. 96500
mobil adalah ….
A. Timah 96500
gram
B. Timbal D. 108 × 10 ×60×8
C. Nikel 108 × 60
D. Magnesium gram
E. Kromium E. 96500 ×8×60
79. Elektrolisis larutan CuSO4 dengan elektrode 84. Proses pelapisan kunci pintu yang terbuat dari
tembaga pada anode terjadi reaksi .... besi dengan logam tembaga menggunakan sel
A. Cu(s) Cu2+(aq) + 2 e– elektrolisis. Simpulan yang benar tentang proses
B. Cu2+(aq) + 2e– Cu(s) elektrolisis yang terjadi pada katode pada
penyepuhan kunci pintu dari besi adalah …
C. 2 H2O(l) 4 H+(aq) + O2(g) + 4 e–
A. Cu(s) Cu2+(aq) + 2e
D. 2 H2O(l) + 2 e– 2 OH–(l) + H2(g)
B. Fe(s) Fe2+(aq) + 2e
E. SO42–(aq) SO2(g) + 2 e–
80. Reaksi yang terjadi pada katode dari elektrolisis C. Cu2+(aq) + 2e Cu(s)
larutan Na2SO4 adalah .... D. 2H2O(aq) + 2e H2(g) + 2OH-(aq)
A. 2 H2O(l) + 2 e– 2 OH–(l) + H2(g) E. 2H2O(aq) O2(g) + 4H+ + 4e
B. 2 H+(g) + 2 e– H2(g) 85. Arus listrik yang sama dialirkan ke dalam larutan
CuSO4 dan AgNO3. Bila massa tembaga yang
C. Na+(s) + e– Na(s)
diendapkan adalah 0,3175 gram, maka massa
D. SO42–(aq) SO2(g) + O2(g) + 2 e–
perak yang mengendap adalah .... (Ar Ag = 108
E. 2 H2O(l) 4 H+(g) + O2(g) + 4 e–
dan Cu = 63,5).
81. Bila larutan AgNO3 dialiri listrik 10 ampere
A. 0,108 gram D. 3,175 gram
selama 1 jam, maka pada katode akan diendapkan
B. 1,08 gram E. 10,8 gram
logam perak sebanyak …. (Ar Ag = 108)
C. 6,35 gram
A. 80,58 gram
86. Kedalam dua sel yang berisi larutan LSO4 dan
B. 20,145 gram
AgNO3 yang disusun secara seri dialirkan arus
C. 8,06 gram
listrik ternyata diendapkan 3,25 gram logam L
D. 40,29 gram
dan 10,8 gram logam Ag (Ar Ag = 108). Massa 91. Unsur halogen tidak terdapat dalam keadaan
atom relative L adalah … bebas di alam karena ….
A. 63,5 A. Senyawa halogen tidak stabil
B. 65,0 B. Halogen terdapat sebagai molekul diatomik
C. 72,0 C. Halogen sangat stabil
D. 32,5 D. Senyawa halogen sukar terurai
E. 70,5 E. Halogen sangat reaktif
92. Unsur-unsur nonlogam berikut yang terdapat
87. Satu Liter AgNO3 dielektrolisis dengan elektrode dalam keadaan bebas di alam adalah ….
Pt. Jika muatan listrik sebanyak 965 coloumb A. Fluor, klor, brom, dan iod
dialirkan maka pH larutan yang dihasilkan adalah B. Oksigen, nitrogen, argon, dan klor
.... C. Nitrogen, argon, belerang, dan oksigen
A. 2 D. Argon, klor, nitrogen, dan iod
B. 4 E. Nitrogen, argon, brom, dan belerang
C. 6 93. Unsur-unsur gas mulia memiliki sifat-sifat
D. 8 berikut, kecuali ….
E. 10 A. Memiliki 2 elektron atau 8 elektron di kulit
88. Ke dalam sel elektrolisis berisi larutan CrCl 3 di terluarnya
alirkan arus listrik dengan kuat arus 193A selama B. Terdapat sebagai unsur bebas monoatomik
300 detik. Massa logam krom (Ar Cr = 52) yang C. Merupakan unsur yang tidak stabil
mengendap pada katode, adalah ... D. Sukar bereaksi dengan unsur lain
A. 20,8 g E. Memiliki jari-jari atom dari atas kebawah
B. 15,6 g semakin besar
C. 10,4 g 94. Reaksi berikut dapat berlangsung kecuali reaksi
D. 5,2 g antara ....
E. 2,6 g A. larutan KI dengan gas Br2
89. Pada elektrolisis 400 mL larurtan CuSO4 0,01 M, B. larutan KI dengan gas Cl2
untuk mengendapkan seluruh ion tembaga C. larutan KCl dengan gas Br2
diperlukan arus listrik dengan muatan sebesar .... D. larutan KBr dengan gas Cl2
A. 0, 024 F E. larutan KCl dengan gas F2
B. 0, 008 F 95. Nama senyawa [Cu(NH3)4](NO3)2 adalah ….
C. 0, 004 F A. Tetraamindinitrotembaga(II)
D. 0, 003 F B. Tetraamindinitrokuprat(II)
E. 0, 001 F C. Tetraamintembaga(II)nitrat
90. Pada elektrolisis larutan BaCl2 dengan elektrode D. Tetraaminkuprat(II)nitrat
karbon dialirkan muatan listrik sebanyak 0,06 F. E. Tetraamintembaga(II)dinitrat
Volume gas yang dihasilkan jika diukur pada 96. Perhatikan tabel berikut
tekanan dan suhu dimana massa 1 liter gas O2 No Mineral Unsur
massanya 1,6 gram (Ar O=16), adalah .... (1) Kalsit Kalium
A. 1200 mL (2) Magnetit Magnesium
B. 1000 mL (3) Bauksit Natrium
C. 600 mL (4) Pirolusit Mangan
D. 400 mL (5) Kriolit Aluminium
E. 200 mL Pasangan data yang tepat antara mineral dan
1. Jika pada elektrolisis larutan NaCl dihasilkan kandungan unsurnya adalah….
11,2 liter gas (STP), maka muatan listrik yang A. (1) dan (2)
dialirkan ke dalam larutan sebesar B. (1) dan (3)
A. 0,10 F C. (2) dan (3)
B. 0,25 F D. (3) dan (4)
C. 0,5 F E. (4) dan (5)
D. 1,0 F 97. Gas klorin dapat dibuat melalui proses Down
E. 2,0 F (-) : Na+(l) + 1e Na(s)
(+): Cl- ½ Cl2(g) + 1e B. 0
Perhatikan beberapa pernyataan berikut! C. 4+
(1) Gas O2 dihasilkan di katode D. 2-
(2) Logam Cu atau Ag dapat dijadikan anode E. 2+
(3) Gas klorin dihasilkan di anode 102. Jika zat radioaktif disimpan selama 30 jam
(4) Sumber utama pembuatan gas tersebut adalah sehingga massanya berkurang 87,5%, maka
garam batu waktu paruh dari zat tersebut adalah ….
Pernyataan yang tepat ditunjukkan oleh nomor A. 3 jam D. 15 jam
…. B. 10 jam E. 20 jam
A. (1) dan (2) C. 12 jam
B. (1) dan (3) 103. Suatu unsur radioaktif mempunyai waktu paruh
C. (2) dan (3) 60 tahun. Berapa tahun waktu yang dibutuhkan
D. (2) dan (4) untuk terjadinya peluruhan sehingga radioisotop
E. (3) dan (4) tersebut masih tersisa 12,5%?
98. Perhatikan data tentang manfaat beberapa A. 90 tahun
senyawa!
B. 120 tahun
(1) Bahan baku pembuatan sabun
(2) Zat penjernih air kolam renang C. 180 tahun
(3) Bahan baku pembuatan pupuk D. 140 tahun
(4) Zat yang digunakan untuk mematikan bakteri E. 320 tahun
air PDAM 104. Suatu unsur radioaktif mempunyai waktu paruh
(5) Bahan untuk membalut bagian tubuh yang 18 hari. Jika unsur radioaktif tersebut disimpan
patah tulang selama 72 hari, maka sisa unsur radioaktif
Pasangan pernyataan yang benar tentang manfaat tersebut adalah ....
senyawa Ca(ClO)2 ditunjukkan oleh nomor …..
A. (1) dan (2) A. 50%
B. (1) dan (3) B. 25%
C. (2) dan (4) C. 12,5%
D. (3) dan (4)
D. 6,25%
E. (4) dan (5)
99. Bilangan koordinasi pada senyawa kompleks E. 3,12%
K4[Fe(CN)6], [Ag(NH3)2]Cl, dan [Cu(NH3)4]C12
berturut-turut adalah … 14 17 1
A. 6, 2, 6. 105. Dalam reaksi inti 7 N + X 8O + 1H
B. 4,.4, 6. X adalah sinar ....
C. 4, 2, 6. A. alfa
D. 6, 2, 4. B. beta
E. 6, 4, 4. C. negatif
100. Suatu senyawa bromida merupakan senyawa D. X
kompleks. Ion kompleksnya terdiri dari atom E. beta positif
pusat kobal(III) yang mengikat ligan-ligan akua 234
106. Jika nuklida 90 Th berturut-turut memancarkan
dan bromo. Rumus senyawa tersebut adalah …
6 partikel beta dan 7 partikel alfa, maka akan
A. ,[Co(H2O)6]Br3.
menghasilkan ....
B. [Co(H2O)4Br2]Br2. 208
C. [Co(H2O)5Br]Br. A. 82 Pb
D. [Co(H2O)5Br]Br2. 210
B. 83 Bi
E. [Co(H2O)3Br3]. 210
101. Logam transisi dengan simbol M, membentuk C. 81 Ti
ion kompleks dengan rumus [M(CN) 6]4-. Logam 206
D. 83 Bi
yang sama dalam tingkat oksidasi yang sama, 206
membentuk ion kompleks dengan rumus E. 82 Pb
[M(NH3)4]x. Berapakah nilai x?
A. 4-
Anda mungkin juga menyukai
- PTS Kelas XIIDokumen8 halamanPTS Kelas XIIahasti aldaBelum ada peringkat
- Soal Sifat Koligatif Larutan LengkapDokumen5 halamanSoal Sifat Koligatif Larutan Lengkapwiwin jayantiBelum ada peringkat
- Soal SKL 46Dokumen12 halamanSoal SKL 46195060501111027 RahmaTMBelum ada peringkat
- KIMIADokumen5 halamanKIMIAMuhamad RidwanBelum ada peringkat
- Soal Sifat Koligatif Larutan (Latihan)Dokumen1 halamanSoal Sifat Koligatif Larutan (Latihan)Ilhamsya Nurghaly AldrianBelum ada peringkat
- Soal Latihan Ulangan Sifat KoligatifDokumen4 halamanSoal Latihan Ulangan Sifat Koligatifsamuel.purbonegoroBelum ada peringkat
- Soal Sifat Koligatif Larutan (Lengkap)Dokumen2 halamanSoal Sifat Koligatif Larutan (Lengkap)Sherly Liana0% (1)
- Koligatif LarutanDokumen2 halamanKoligatif LarutanmirdaprismaBelum ada peringkat
- Soal Latihan Bab 1 - Sifat Koligatif LarutanDokumen3 halamanSoal Latihan Bab 1 - Sifat Koligatif LarutanIndrabenBelum ada peringkat
- Soal Master Xii 2017Dokumen3 halamanSoal Master Xii 2017Muhamad YusufBelum ada peringkat
- Latihan Soal Sifat Koligatif LarutanDokumen2 halamanLatihan Soal Sifat Koligatif Larutansiti nuraeniBelum ada peringkat
- Sifat Koligatif, RedoksDokumen3 halamanSifat Koligatif, RedoksThasya FetoBelum ada peringkat
- Soal Ulangan Harian 1Dokumen15 halamanSoal Ulangan Harian 1DwianggraeniBelum ada peringkat
- Booster KimiaDokumen7 halamanBooster KimiaAlison burgerBelum ada peringkat
- Dokumen - Tips Soal Sifat Koligatif Larutan LengkapDokumen3 halamanDokumen - Tips Soal Sifat Koligatif Larutan LengkapekaemilianaBelum ada peringkat
- Soal Handbook Mapel Kimia Sci 2019 PDFDokumen200 halamanSoal Handbook Mapel Kimia Sci 2019 PDFSusi Susanti100% (2)
- Kimia - Sifat Koligatif LarutanDokumen5 halamanKimia - Sifat Koligatif LarutanClouseizBelum ada peringkat
- Uh Sifat Koligatif Larutan Kode Soal ADokumen9 halamanUh Sifat Koligatif Larutan Kode Soal AatanageBelum ada peringkat
- Latihan KoligatifDokumen3 halamanLatihan KoligatifAfriiqntiBelum ada peringkat
- Uh 2014Dokumen8 halamanUh 2014Maria JuanaBelum ada peringkat
- Sma - Sifat Koligatif LarutanDokumen1 halamanSma - Sifat Koligatif LarutanAdli Rayhan FarizaBelum ada peringkat
- Soal Sifat Koligatif Larutan LengkapDokumen3 halamanSoal Sifat Koligatif Larutan Lengkapseptina restuBelum ada peringkat
- Uji Kompetensi Kelas 12Dokumen2 halamanUji Kompetensi Kelas 12Dewi KamidaBelum ada peringkat
- Uji Kompetensi Kelas 12Dokumen2 halamanUji Kompetensi Kelas 12Dewi KamidaBelum ada peringkat
- Latihan Soal KimiaDokumen6 halamanLatihan Soal KimiaErwin TambaBelum ada peringkat
- Soal - Soal Konsentrsi Dan Tekanan Uap Jenuh Dan TitikdidihDokumen8 halamanSoal - Soal Konsentrsi Dan Tekanan Uap Jenuh Dan Titikdidihsyalumkaila30Belum ada peringkat
- Us SMT 1Dokumen4 halamanUs SMT 1Moh. Sidik RohmanBelum ada peringkat
- Ulangan Harian 1Dokumen3 halamanUlangan Harian 1YAYAN SUYANTA100% (4)
- Uh Sifat Koligatif LarutanDokumen1 halamanUh Sifat Koligatif LarutanSheline Hirfa HirfaBelum ada peringkat
- Kimia Kelas Xii Sifat Koligatif LarutanDokumen9 halamanKimia Kelas Xii Sifat Koligatif Larutannadya8845Belum ada peringkat
- Kumpulan Soal Sifat Koligatif LarutanDokumen1 halamanKumpulan Soal Sifat Koligatif LarutanDedi WahyudinBelum ada peringkat
- Latihan Sifat Koligatif LarutanDokumen5 halamanLatihan Sifat Koligatif LarutanRens AlbinBelum ada peringkat
- Soal Pas Ganjil Kimia Kelas 12Dokumen13 halamanSoal Pas Ganjil Kimia Kelas 12ayu eva trisnaBelum ada peringkat
- Kimia PH 1-1Dokumen10 halamanKimia PH 1-1Aura SyifaBelum ada peringkat
- Kimia Xii Sem 1Dokumen25 halamanKimia Xii Sem 1Eli SuharlinaBelum ada peringkat
- Soal Kimia 12Dokumen5 halamanSoal Kimia 12Kha Ha JaBelum ada peringkat
- Koligatif PilganDokumen3 halamanKoligatif PilganNovan AliBelum ada peringkat
- Soal SoalDokumen8 halamanSoal SoallsukkieBelum ada peringkat
- Soal Semester 1 Kelas Xii TP 2021-2022Dokumen4 halamanSoal Semester 1 Kelas Xii TP 2021-2022Mifha RhamadaniBelum ada peringkat
- PTS Kimia Kelas 12 ADokumen5 halamanPTS Kimia Kelas 12 Aksm waru1979Belum ada peringkat
- Kimia-2 SKL 2Dokumen3 halamanKimia-2 SKL 2Abil DarmaBelum ada peringkat
- LATIHAN SOAL PTS SIFAT KOLIGATIF DAN REDOKS (VOLTA) 2018 RevisiDokumen5 halamanLATIHAN SOAL PTS SIFAT KOLIGATIF DAN REDOKS (VOLTA) 2018 RevisiArisanti MaulidinaBelum ada peringkat
- Soal Uh Sifat Koligatif 2022Dokumen2 halamanSoal Uh Sifat Koligatif 2022Sofi SalsaBelum ada peringkat
- Sifat KoligatifDokumen4 halamanSifat KoligatifismailfirmanBelum ada peringkat
- Pas Kimia XiiDokumen3 halamanPas Kimia XiiThohari AnwardahBelum ada peringkat
- Soal Sifat Koligatif LarutanDokumen2 halamanSoal Sifat Koligatif LarutanGito Sucipto100% (1)
- Soal Sifat Koligatif (PG)Dokumen5 halamanSoal Sifat Koligatif (PG)Ryuo GamingBelum ada peringkat
- Koligatif SiapDokumen4 halamanKoligatif SiapZettry SainsBelum ada peringkat
- Kim SoalDokumen58 halamanKim Soal195060501111027 RahmaTMBelum ada peringkat
- Siti Nabila Xii Ipa 2Dokumen2 halamanSiti Nabila Xii Ipa 2yesi candra dewiBelum ada peringkat
- Soal PDF Untuk SiswaDokumen8 halamanSoal PDF Untuk SiswaDA MaiBelum ada peringkat
- Soal Uts Semester Gasal Kelas XII 2017-2018Dokumen5 halamanSoal Uts Semester Gasal Kelas XII 2017-2018agussujadmikoBelum ada peringkat
- PTN KoligatifDokumen3 halamanPTN KoligatifPb Nugroho M PjBelum ada peringkat
- Soal Sifat KoligatifDokumen3 halamanSoal Sifat KoligatifKhalidBelum ada peringkat
- Soal Sifat KoligatifDokumen3 halamanSoal Sifat KoligatifKhalidBelum ada peringkat
- Soal Sifat2 KoligatifDokumen4 halamanSoal Sifat2 KoligatifHeri EffendyBelum ada peringkat
- Soal Sifat Koligatif KimiaDokumen9 halamanSoal Sifat Koligatif KimiaroslainileniBelum ada peringkat
- M.Kevin Yashman XII MIPA 3 TUGAS KIMIA REMEDIAL PTSDokumen5 halamanM.Kevin Yashman XII MIPA 3 TUGAS KIMIA REMEDIAL PTSBojez KevinBelum ada peringkat
- SOALDokumen10 halamanSOALImam SoetopoBelum ada peringkat
- Teks ProsedurDokumen1 halamanTeks Prosedur19 Ni Kadek Dea PurnamiBelum ada peringkat
- Bab 1Dokumen17 halamanBab 1Tyaa LapoloBelum ada peringkat
- Bab 3Dokumen17 halamanBab 3Dian FatonahBelum ada peringkat
- 12 Soal Persiapan Pas GanjilDokumen9 halaman12 Soal Persiapan Pas Ganjil19 Ni Kadek Dea PurnamiBelum ada peringkat
- JadwalDokumen1 halamanJadwal19 Ni Kadek Dea PurnamiBelum ada peringkat
- Name Tag Balon Pengurus OSIS DwismaDokumen2 halamanName Tag Balon Pengurus OSIS Dwisma19 Ni Kadek Dea PurnamiBelum ada peringkat
- Nilai TobeloDokumen2 halamanNilai Tobelo19 Ni Kadek Dea PurnamiBelum ada peringkat
- Nilai TobeloDokumen2 halamanNilai Tobelo19 Ni Kadek Dea PurnamiBelum ada peringkat