Latihan Individu 20
Diunggah oleh
dranasridJudul Asli
Hak Cipta
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniLatihan Individu 20
Diunggah oleh
dranasrid4541/2 KIMIA Kertas 2 10 SPM
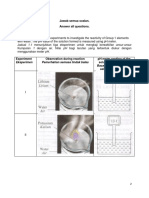
5 Two experiments are conducted to investigate the factor that affects the rate of
reaction for Experiment I and Experiment II respectively.
Dua eksperimen telah dijalankan untuk mengkaji faktor yang mempengaruhi kadar
tindak balas masing-masing bagi Eksperimen I dan Eksperimen II.
Experiment I : 3 g zink granules + 25 cm3 1.0 mol dm-3 of hydrochloric acid
Eksperimen I : 3 g ketulan zink + 25 cm3 asid hidroklorik 1.0 mol dm-3
Experiment II : 3 g zink powder + 25 cm3 1.0 mol dm-3 of hydrochloric acid
Eksperimen II : 3 g serbuk zink + 25 cm3 asid hidroklorik 1.0 mol dm-3
Table 5.1 and Table 5.2 show the result obtained from Experiment I and Experiment II.
Jadual 5.1 dan Jadual 5.2 menunjukkan keputusan yang diperoleh daripada
Eksperimen I dan Eksperimen II.
Experiment I
Eksperimen I
Time (s)
0 20 40 60 80 100 120 140 160
Masa (s)
Volume of gas
released (cm3)
Isipadu gas 0.00 6.50 12.50 17.80 23.50 27.20 31.80 35.00 35.00
yang terbebas
(cm3)
Table 5.1 / Jadual 5.1
Experiment II
Eksperimen II
Time (s)
0 20 40 60 80 100 120 140 160
Masa (s)
Volume of gas
released (cm3)
Isipadu gas 0.00 8.50 15.50 21.00 26.80 31.50 35.00 35.00 35.00
yang terbebas
(cm3)
Table 5.2 / Jadual 5.2
(a) (i) State the name the gas released from both experiment.
Nyatakan namakan gas yang terbebas daripada kedua-dua eksperimen.
Hidrogen
……………………………………………………………………………………
[1 mark]
(ii) Describe a chemical test to verify the gas in (a) (i).
Huraikan satu ujian kimia untuk mengesahkan gas di (a) (i).
Letakkan kayu uji menyala pada mulut tabung uji yang mengandungi gas
………………………………………………………………………………………
hidrogen. Bunyi pop terhasil menandakan kehadiran gas hidrogen
[Lihat halaman sebelah
BK3 – PERCUBAAN 2017 10 SULIT
4541/2 KIMIA Kertas 2 11 SPM
………………………………………………………………………………………
[2 marks]
(b) (i) Referring to Table 5.1 and Table 5.2; calculate the average rate of reaction
for Experiment I and Experiment II.
Merujuk kepada Jadual 5.1 dan Jadual 5.2; hitungkan kadar tindak balas
purata untuk Eksperimen I dan Eksperimen II.
Experiment I / Eksperimen I Experiment II / Eksperimen II
kadar = 35cm3/140s = 0.25cm3s-1 Kadar = 35cm3/120s = 0.29cm3s-1
[2 marks]
(ii) Compare the rate of reaction of Experiment I and Experiment II.
Bandingkan kadar tindak balas bagi Eksperimen I dan Eksperimen II.
Kadar tindakbalas eksperimen II lebih tinggi
……………………………………………………………………………………….
[1 mark]
(iii) Explain your answer in (b) (ii) referring to the collision theory.
Terangkan jawapan anda di (b) (ii) dengan merujuk teori perlanggaran.
Saiz zink eksperimen II lebih kecil.
……………………………………………………………………………………….
Jumlah luas permukaan zink lebih besar dalam eskperimen II
Frekuensi perlanggaran antara atom Zink dan ion H+ eksperimen II lebih tinggi
……………………………………………………………………………………….
Frekuensi perlanggaran berkesan antara zink dan ion H+ eksperimen II lebih
……………………………………………………………………………………….
[3 marks]
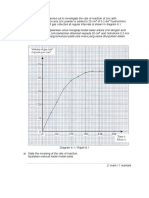
(c) Sketch the graph of the volume of gas produced against time for both
experiments on the same axis.
Lakarkan graf isipadu gas yang terbebas melawan masa bagi kedua-dua
eksperimen pada paksi yang sama.
[Lihat halaman sebelah
BK3 – PERCUBAAN 2017 11 SULIT
Anda mungkin juga menyukai
- T5B4 I 1) Haba PenyesaranDokumen3 halamanT5B4 I 1) Haba Penyesaransuzana22Belum ada peringkat
- Latihan Bab 5 UdaraDokumen8 halamanLatihan Bab 5 UdaraMun'xJarvisBelum ada peringkat
- Kpad Kimia Kadar Tindak BalasDokumen4 halamanKpad Kimia Kadar Tindak BalasJOANNA MAGDALIN A/P JOSEPH MoeBelum ada peringkat
- Exam Akhir Tahun Tingkatan 4Dokumen18 halamanExam Akhir Tahun Tingkatan 4Nur Anida Gdm SmktpBelum ada peringkat
- Kimia Kertas 3Dokumen7 halamanKimia Kertas 3newrules333100% (1)
- Kertas 2 Set 2 Soalan Kbat Kinta SelatanDokumen15 halamanKertas 2 Set 2 Soalan Kbat Kinta SelatanYvonne ChuaBelum ada peringkat
- Modul Peningkatan Prestasi Kimia Tingkatan 4 (PPT) 2014 K2Dokumen16 halamanModul Peningkatan Prestasi Kimia Tingkatan 4 (PPT) 2014 K2Victoria PetrusBelum ada peringkat
- Up 1 Kimia f5Dokumen14 halamanUp 1 Kimia f5Nuraishah SamsuryBelum ada peringkat
- Soalan Kbat PPDKS P3Dokumen7 halamanSoalan Kbat PPDKS P3张晨曦Belum ada peringkat
- Chemistry SPM ModuleDokumen42 halamanChemistry SPM Moduleadella7550% (2)
- Ujian Mac Kimia Tingkatan 4 2017Dokumen7 halamanUjian Mac Kimia Tingkatan 4 2017Mariana AhmadBelum ada peringkat
- Chapter 1Dokumen20 halamanChapter 1Juni FarhanaBelum ada peringkat
- PPC Kimia Kertas2 Sepang Set 10Dokumen15 halamanPPC Kimia Kertas2 Sepang Set 10nurulhuda_01Belum ada peringkat
- Soalan Sains Setengah Tahunting 5 2013Dokumen15 halamanSoalan Sains Setengah Tahunting 5 2013Nurul Huda IsaBelum ada peringkat
- Set 7 Cemerlang Kimia K3 PDFDokumen9 halamanSet 7 Cemerlang Kimia K3 PDFSarvesh SegaranBelum ada peringkat
- Struktur BerpanduDokumen4 halamanStruktur BerpandujamesBelum ada peringkat
- Chemistry Spot SPMDokumen6 halamanChemistry Spot SPMhazimrozaimi05Belum ada peringkat
- Sains tg5Dokumen20 halamanSains tg5cikguana79Belum ada peringkat
- CTH Jawapan Struktur BerpanduDokumen4 halamanCTH Jawapan Struktur BerpanduALICIA SENIA ANAK JIMMY MoeBelum ada peringkat
- KBSM t4 Kimia k3Dokumen6 halamanKBSM t4 Kimia k3kancil416670Belum ada peringkat
- Betul Kimia Ub1 2017 F5Dokumen8 halamanBetul Kimia Ub1 2017 F5Nik Diana Hartika Nik HusainBelum ada peringkat
- K3 Modul Cemerlang SET 2Dokumen8 halamanK3 Modul Cemerlang SET 2annurshah05Belum ada peringkat
- Trial Kertas 3 2016Dokumen19 halamanTrial Kertas 3 2016norhidayah binti pazilBelum ada peringkat
- Sains Paper 2 Form 5Dokumen19 halamanSains Paper 2 Form 5Bbiesoth AJBelum ada peringkat
- Kuiz Termokimia Pemendakan PenyesaranDokumen8 halamanKuiz Termokimia Pemendakan Penyesaranaidarahim0205Belum ada peringkat
- Paper 2Dokumen17 halamanPaper 2Achik LiaBelum ada peringkat
- Kimia Kertas 3Dokumen5 halamanKimia Kertas 3Aaliyah Wendy ChongBelum ada peringkat
- Percubaan Kimia Kelantan 2013Dokumen17 halamanPercubaan Kimia Kelantan 2013Siti ShuhanaBelum ada peringkat
- 5ae5176e133af5.72027665SPMPERTHNSNK2 SET 1Dokumen19 halaman5ae5176e133af5.72027665SPMPERTHNSNK2 SET 1Mohamad HattaBelum ada peringkat
- Bab 1 Kertas 1Dokumen17 halamanBab 1 Kertas 1Siva GuruBelum ada peringkat
- Fizik Kertas 2 F4 PPT Fariz 2021Dokumen16 halamanFizik Kertas 2 F4 PPT Fariz 2021Fariz FdzBelum ada peringkat
- Ujian Penilaian 1 Kimia Tingkatan 5Dokumen6 halamanUjian Penilaian 1 Kimia Tingkatan 5Nor Atikah100% (2)
- 2022 Perlis Chemistry K3Dokumen8 halaman2022 Perlis Chemistry K3Akma Batrisyia AkhmarrezalBelum ada peringkat
- BAB 4 T4 Jirim Dan Bahan (Murid)Dokumen14 halamanBAB 4 T4 Jirim Dan Bahan (Murid)Yee MeiBelum ada peringkat
- SPM 2017Dokumen33 halamanSPM 2017SZ Science Academy OfficialBelum ada peringkat
- Bahan Akhir Kertas 3Dokumen45 halamanBahan Akhir Kertas 3miszhoneymBelum ada peringkat
- Soalan Gunasama Kertas 2 AR3 Sains T4 2018Dokumen19 halamanSoalan Gunasama Kertas 2 AR3 Sains T4 2018Lily MardyanaBelum ada peringkat
- HubunganDokumen9 halamanHubunganrihyonBelum ada peringkat
- Q Fiz2 PHG 2015Dokumen34 halamanQ Fiz2 PHG 2015nusaibahBelum ada peringkat
- Pat F4 P2 2018Dokumen27 halamanPat F4 P2 2018Jue MayaBelum ada peringkat
- Latihan Pengukuhan Sains SPM 1Dokumen5 halamanLatihan Pengukuhan Sains SPM 1pinkyoya86100% (1)
- Percubaan SPM 2013Dokumen19 halamanPercubaan SPM 2013AqishAthiraBelum ada peringkat
- Soalanpatfzk 2016k2printDokumen25 halamanSoalanpatfzk 2016k2printmohd sabila IbnuzawawiBelum ada peringkat
- Paper 2 First Trial (2015)Dokumen15 halamanPaper 2 First Trial (2015)Noky KiaBelum ada peringkat
- Kertas 2 Pep. Set 1 SPM 2016 - SoalanDokumen27 halamanKertas 2 Pep. Set 1 SPM 2016 - Soalanaqilah100% (1)
- Percubaan SBP 2015 - Kertas 3: Adura Azlin Bin Ishak - 2015Dokumen8 halamanPercubaan SBP 2015 - Kertas 3: Adura Azlin Bin Ishak - 2015ramzilahBelum ada peringkat
- STGH THN Sains t4p2 2016Dokumen20 halamanSTGH THN Sains t4p2 2016Nor HudaBelum ada peringkat
- Projek Skor Kimia 2014 Siri 7Dokumen21 halamanProjek Skor Kimia 2014 Siri 7ZulBelum ada peringkat
- Kertas 2 KimiaDokumen21 halamanKertas 2 KimiaSusi HongBelum ada peringkat
- Physics Paper 2 SPM Perak 2011Dokumen26 halamanPhysics Paper 2 SPM Perak 2011Raymond Cheang Chee-CheongBelum ada peringkat
- Bab 2 f5Dokumen16 halamanBab 2 f5Michael WeissBelum ada peringkat
- P 2 FizikDokumen26 halamanP 2 FizikzaliniBelum ada peringkat