Mol 29 Agt
Diunggah oleh
19923022Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Mol 29 Agt
Diunggah oleh
19923022Hak Cipta:
Format Tersedia
KONSEP MOL adalah 13,1%. Massa molar (CHu) x (H.0)y adalah 496 g/mol.
dany
X
pada rumusmolekul metana hidrat adalah
ofsubstance thatcontains same number
Amount
...
(CHa),(H2Oly
64,976tHyx/*4,001 -4
mol
ofatoms or molecules or particles as there are
0
in 13,1%86,9%431,02440x 23,946 mol
=
= 24
atoms
10 g H20
-
mol 6,02 1023 atom M64,9769431,0249 (CHu) (H20l6
1 x
(CHu)y. (H20) zy
=
=
y
molecule
-
1 1
particle
-P -496888.
.
4,96 Rumus Empiris RumusMolekul
12
12 9 OFC-12 < 6,02.1023 inre⑤
-M
e-
latom (-12:1,99 10- R EAKSI PEMBATAS
g C-12
10-23
%hasil:30%,
1,99 x
10-24
1,66 x 100
g 1 2 Al FecOs >AlzOs+ 2Fe
85,25%
=
sma +
=
I =
6P Gn 12
↳dibagi IP/In 1249 601g -4,6 mol Ae x m20sx1028:234,69
c-M
> Jumlah atom carbon
reak si
pembatas ↑ -
Al2O
Mi
Al 1 mol FecOS 160 gFezO3=
mol!! - Imol
Al x 4,6 molAl X 367 g FecOs
Benzena. CyHyperbandingan 1249
=
- X
27 q Al
- -
2 mol Al I M01 03
,
~ Jumlah atom Hidrogen
1 -
mol Fez03 2 -
mol Al 27 g Al
4
-
-
n (CH)b 601 g -
FezOs x
160203
X
ecOS
I m
X
/ molAl
-
202, 0
=
g
Al
, -
It
CHIn:Massa Molar
(
1 maCoHs:baton
:6 molC
=6 mol H
Percobaan
C H 0 >CO2 + H20 (reaksi setelah dipanaskan)
11,59 229 13,59
2
129
x=
I mol
22 --
0, 5m ol C X -
6g(
902 X
yugc
- 1 -
molC
1 mol H20
- 2 mol H 19 H
13,5 g -
H20 X X
H20
-
=1, 5mol
4
X
M01H
I -
=
1,59H
189
- H20 101-
/M010
q0 11,5-(6 + 1,5) 440x
=
1650
=0,25mol 0
LATSOAL
Metana hidrat adalah padatan yg ditemukan di dasar lautden rumus
molekul (CHa)x(Hi0)y. Dik persen metana (CH) dalam metana hidrat
Anda mungkin juga menyukai
- Hidrokarbon Dan Minyak BumiDokumen19 halamanHidrokarbon Dan Minyak BumiAyu Fadilla AfifahBelum ada peringkat
- LKPD 5Dokumen1 halamanLKPD 5serli sabenanBelum ada peringkat
- Skema 2Dokumen1 halamanSkema 2Dendi ChoirullohBelum ada peringkat
- KBF 18 Mar 24Dokumen4 halamanKBF 18 Mar 24Qolbu Nurul HidayahBelum ada peringkat
- Transformasi Geometri 4 1Dokumen1 halamanTransformasi Geometri 4 1kewi skiBelum ada peringkat
- Yang AdaDokumen1 halamanYang AdabastianBelum ada peringkat
- Img 20230315 0002Dokumen4 halamanImg 20230315 0002UMI NUR AZIZAHBelum ada peringkat
- MTK MinatDokumen10 halamanMTK Minatzeva su'azraBelum ada peringkat
- Salinan Terjemahan 1 Social-Capital-Trusting-And-Trustworthiness-Evidence-From-Peer-To-Peer-LendingDokumen120 halamanSalinan Terjemahan 1 Social-Capital-Trusting-And-Trustworthiness-Evidence-From-Peer-To-Peer-Lendingayu nirmalaBelum ada peringkat
- Baxter: Injeksi Dekstrosa Dan Natrium Klorida, USPDokumen19 halamanBaxter: Injeksi Dekstrosa Dan Natrium Klorida, USPWidy OktaviaBelum ada peringkat
- Untitled Notebook MinDokumen4 halamanUntitled Notebook MinYvonne Kusumasanti SiraitBelum ada peringkat
- 4.rencana RumdisDokumen1 halaman4.rencana Rumdiscv damar saktiBelum ada peringkat
- Latihan 26Dokumen1 halamanLatihan 26septya hanantaBelum ada peringkat
- Tugas 3 Termo 10221024 DintaDokumen10 halamanTugas 3 Termo 10221024 DintadintaBelum ada peringkat
- K3 Asrama HajiDokumen3 halamanK3 Asrama HajiLawang SegaraBelum ada peringkat
- Pemantapan 1Dokumen5 halamanPemantapan 1Redaksi SmandaBelum ada peringkat
- Adobe Scan 05 May 2023Dokumen1 halamanAdobe Scan 05 May 2023zainalabidin3388Belum ada peringkat
- Materi PKDM-II-25-1-2017-layaDokumen10 halamanMateri PKDM-II-25-1-2017-layaJalil IslahuddinBelum ada peringkat
- 2013 Lfer PDFDokumen15 halaman2013 Lfer PDFhanif fBelum ada peringkat
- Shop Drawing Man 1 KotamobaguDokumen57 halamanShop Drawing Man 1 KotamobaguephencvlBelum ada peringkat
- MASTERPLAN RPJP UM 2021-2045 Ke 2Dokumen1 halamanMASTERPLAN RPJP UM 2021-2045 Ke 2toniBelum ada peringkat
- 022.layout GSP GSB Perumahan Mutiara Mas Regency LalinDokumen1 halaman022.layout GSP GSB Perumahan Mutiara Mas Regency Lalinpbg tomimotoBelum ada peringkat
- Rangkuman MTKDokumen1 halamanRangkuman MTKdinda setiawardaniBelum ada peringkat
- Bab V Sambungan Kuda-KudaDokumen4 halamanBab V Sambungan Kuda-KudaMuhammad Yusuf RamadhanBelum ada peringkat
- CV Digabungkan DikompresiDokumen10 halamanCV Digabungkan DikompresihulmanBelum ada peringkat
- Konsep Mol 1 (X-M)Dokumen11 halamanKonsep Mol 1 (X-M)mianBelum ada peringkat
- AR12KIM0499Dokumen4 halamanAR12KIM0499Rahim AimBelum ada peringkat
- Pemodelan Transpor SedimenDokumen4 halamanPemodelan Transpor Sedimenwibowo1980Belum ada peringkat
- Uas Itb Sm1 1415Dokumen3 halamanUas Itb Sm1 1415Ferdinand Yohannes Van LankhorstBelum ada peringkat
- Grafik Kes Indra 2021Dokumen2 halamanGrafik Kes Indra 2021IqbalBelum ada peringkat
- XLEN LTI244 06TENW UKL UPL Segmen M8.6 M8.7Dokumen121 halamanXLEN LTI244 06TENW UKL UPL Segmen M8.6 M8.7Amelia LiaBelum ada peringkat
- 001 - (Materi) Sistem PersamaanDokumen3 halaman001 - (Materi) Sistem PersamaanshabrinaannajahBelum ada peringkat
- PROMESDokumen2 halamanPROMESarian ferdanaBelum ada peringkat
- Earth WorksDokumen3 halamanEarth WorksArman ManBelum ada peringkat
- Transformasi Koordinat 2D-AffineDokumen7 halamanTransformasi Koordinat 2D-AffineRay BlueBelum ada peringkat
- HIDROKARBONDokumen2 halamanHIDROKARBONweniBelum ada peringkat
- Daftar PeralatanDokumen154 halamanDaftar Peralatankapten subasaBelum ada peringkat
- Dokumen - Tips - Format Penilaian Lomba MewarnaiDokumen1 halamanDokumen - Tips - Format Penilaian Lomba MewarnaiRiwandhi Prasetyo (BOMBOM)Belum ada peringkat
- Ikatan Kovalen Teori Dan LatihanDokumen31 halamanIkatan Kovalen Teori Dan LatihanHilyaa HilyaBelum ada peringkat
- Halban A0 layout1VECTORDokumen1 halamanHalban A0 layout1VECTORHamdana Aulia HidayahBelum ada peringkat
- Resume KimiaDokumen1 halamanResume KimiaNadya meilani Putri salimBelum ada peringkat
- Andi Maria UlfaDokumen7 halamanAndi Maria UlfasofiziafBelum ada peringkat
- H h0x HoyDokumen166 halamanH h0x Hoycp yahBelum ada peringkat
- Siteplan Pematangan LahanDokumen1 halamanSiteplan Pematangan Lahanreza chaerandiBelum ada peringkat
- Denah Canopy Potongan A Tampak Depan: Pemberi TugasDokumen1 halamanDenah Canopy Potongan A Tampak Depan: Pemberi TugassaefulBelum ada peringkat
- STK PHKT Tko b6-016 SWPDokumen232 halamanSTK PHKT Tko b6-016 SWP1234beoBelum ada peringkat
- Apt. Septianita - Lesson From RSDC, Pharmacist Point of ViewDokumen11 halamanApt. Septianita - Lesson From RSDC, Pharmacist Point of ViewClarissa HartawanBelum ada peringkat
- Desain PenelitianDokumen1 halamanDesain PenelitianPewe WulandariBelum ada peringkat
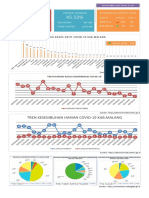
- Tren Kesembuhan Harian Covid-19 Kab - Malang: Capaian Vaksinasi Ketersediaan Tempat Tidur Total KasusDokumen4 halamanTren Kesembuhan Harian Covid-19 Kab - Malang: Capaian Vaksinasi Ketersediaan Tempat Tidur Total KasusmochkurniawanBelum ada peringkat
- Pembahasan LT6Dokumen4 halamanPembahasan LT6Diva Nisfu MustikaBelum ada peringkat
- Batas Dan UkuranDokumen1 halamanBatas Dan UkuranRetnoBelum ada peringkat
- JSA Pemasangan U-BoltDokumen1 halamanJSA Pemasangan U-BoltIqbal GobulBelum ada peringkat
- Protein Formol G2 FixDokumen9 halamanProtein Formol G2 FixHellcroZBelum ada peringkat
- Catetan Gerak HarmonikDokumen4 halamanCatetan Gerak Harmonikgeorgefan7821Belum ada peringkat
- Denah Embung Uwai Miturang 2Dokumen1 halamanDenah Embung Uwai Miturang 2fujiBelum ada peringkat
- Pengumuman Registrasi Mahasiswa Baru TH 2012Dokumen1 halamanPengumuman Registrasi Mahasiswa Baru TH 2012hamzah khairulBelum ada peringkat
- Laju Reaksi Novia & April - Minggu 16 Oktober 2022Dokumen25 halamanLaju Reaksi Novia & April - Minggu 16 Oktober 2022Dini HandayaniBelum ada peringkat
- Term Odin A MikaDokumen18 halamanTerm Odin A MikadintaBelum ada peringkat
- Spum Gaji 2021Dokumen37 halamanSpum Gaji 2021Belha Bebbel BebbeyyongBelum ada peringkat