Resume BA BE - Mantiqa Syafa DG
Diunggah oleh
Mantiqa SyafaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Resume BA BE - Mantiqa Syafa DG
Diunggah oleh
Mantiqa SyafaHak Cipta:
Format Tersedia
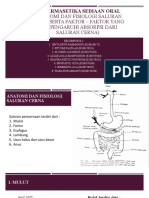
Bioavailabilitas Bioekivalensi
Definisi Persentase dan kecepatan zat Dua produk obat disebut bioekivalen
aktif → mencapai/ tersedia jika keduanya mempunyai ekivalensi
dalam sirkulasi sistemik farmaseutik atau merupakan
dalam bentuk utuh/aktif alternatif farmaseutik. Wajib
setelah pemberian produk dilakukan sblm obat copy
obat tersebut. diproduksi dalam jumlah besar.
Parameter Bioavailabilitas absolut: Faktor kemiripan (F2) : 50-100 ->
bila dibandingkan dengan menunjukkan kesamaan atau
sediaan intravena yang ekivalensi ke 2 kurva, yang berarti
bioavailabilitasnya 100%. kemiripan profil disolusi ke 2 produk.
Bioavailabilitas relative :
bila dibandingkan dengan
sediaan bukan intravena.
Uji Disolusi Terbanding (Uji Ekivalensi In vitro): Produk copy yang hanya beda kekuatan,
BCS kelas 1, BCS kelas 3, disolusi cepat.
Uji Ekivalen in vivo : Oral lepas cepat yang bekerja sistemik,non oral non parenteral yang
didesain scara sistemik cth transdermal, supp. Sediaan lepas lambat yang termodifikasi
bekerja scara sistemik
Uji disolusi Komperatif (UDT) : Secara garis besa UDT dipengaruhi 2 faktor absorbsi dan
solubility (kelarutan), hal ini yang mnjadi dasar BCS
Uji Bioekivalensi : jika produk copy yang akan diproduksi LEBIH TINGGI
dibanding produk sebelumnya
Uji Disolusi Terbanding (UDT) : jika produk copy yang akan diproduksi LEBIH
RENDAH dibandingkan produk sebelumya.
Obat yang wajib diuji bioekivalensinya adalah obat yang memiliki kekuatan tertinggi.
Apabila setelahnya ingin memproduksi sediaan yang sama dengan kekuatan yang lebih kecil,
maka sediaan tersebut boleh hanya melakukan uji bioekivalensi in vitro (UDT)
Anda mungkin juga menyukai
- CND 43Dokumen28 halamanCND 43Mantiqa SyafaBelum ada peringkat
- Kelompok IV Pulmonary DDSDokumen14 halamanKelompok IV Pulmonary DDSMantiqa SyafaBelum ada peringkat
- Kasus MODUL I Golongan I (Kelas AB, EF, IJ, MN)Dokumen4 halamanKasus MODUL I Golongan I (Kelas AB, EF, IJ, MN)Mantiqa SyafaBelum ada peringkat
- Materi Secara Garis Besar Dan Contoh SoalnyaDokumen142 halamanMateri Secara Garis Besar Dan Contoh SoalnyaMantiqa SyafaBelum ada peringkat
- Kelompok 4 Nasal DDSJDokumen16 halamanKelompok 4 Nasal DDSJMantiqa SyafaBelum ada peringkat
- Formulasi EkstrakDokumen49 halamanFormulasi EkstrakMantiqa SyafaBelum ada peringkat
- Brosur Ikm Penyalahgunaan ObatDokumen2 halamanBrosur Ikm Penyalahgunaan ObatMantiqa SyafaBelum ada peringkat
- Biofarmasetika Sediaan Oral FixDokumen28 halamanBiofarmasetika Sediaan Oral FixMantiqa SyafaBelum ada peringkat
- Kelompok 16 - Laporan SO - LeafletDokumen28 halamanKelompok 16 - Laporan SO - LeafletMantiqa SyafaBelum ada peringkat
- REVISI PKM - P - Kulit - Pisang - Raja - AmbonDokumen26 halamanREVISI PKM - P - Kulit - Pisang - Raja - AmbonMantiqa SyafaBelum ada peringkat
- PKM P - Mohammad Farid AlfaridziDokumen28 halamanPKM P - Mohammad Farid AlfaridziMantiqa SyafaBelum ada peringkat
- Resistensi AntibiotikDokumen10 halamanResistensi AntibiotikMantiqa SyafaBelum ada peringkat
- Biofarmasetika B 3Dokumen10 halamanBiofarmasetika B 3Mantiqa SyafaBelum ada peringkat