Hukum-Hukum Dasar Kimia Kelas X
Diunggah oleh
Zildarama 12100 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
22 tayangan11 halamanJudul Asli
Hukum-hukum Dasar Kimia kelas X
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
22 tayangan11 halamanHukum-Hukum Dasar Kimia Kelas X
Diunggah oleh
Zildarama 1210Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 11
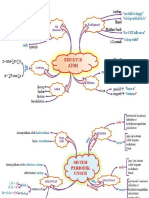
Hukum-hukum Dasar Kimia
1. Hukum Kekelan Massa (Hukum Lavoisier)
2. Hukum Perbandingan Tetap (Hukum Proust)
3. Hukum Kelipatan Perbandingan (Hukum Dalton)
4. Hukum Perbandingan Volum (Hukum Gay-Lussac)
1. Hukum Kekelan Massa (Hukum
Lavoisier)
“Di dalam suatu sistem tertutup massa zat-zat sebelum dan reaksi sama dengan
massa zat sesudah reaksi “
Zat A + Zat B Zat C
Massa A + B = Massa C
Contoh :
1 8
H2(g) + O2 (g) 2H2O (l)
4 gram 32 gram 36 gram
Menghitung perbandingan molekul atom
Ar H = 1 2H2O = 4 atom H, 2 atom O
Ar O = 16 4 x 1 : 2 x 16
= 4 : 32
= 1 : 8
Soal
1. Berikut ini tabel reaksi antara tembaga dan belerang (sulfur)
yang menghasilkan Tembaga (II) Sulfida bedasarkan Hukum
Kekekalan Massa,hitung perbandingan massa dan lengkapi tabel
berikut
2 Cu(s ) +S (S) Cu2S(s)
Massa sebelum reaksi Massa sesudah
No
reaksi
Temabaga (gram) Belerang (gram)
1 0,24 0,36
2 0,3 0,15
3 0,2 0,6
4 0,6 0,4
Hukum Perbandingan Tetap (Hukum Proust)
“Perbandingan masa unsur-unsurdalam suatu senyawa adalah tetap”
1 8
Contoh 1 : Hidrogen + Oksigen air (H2O)
Mula” 4 gram 40 gram 36 gram
Bereaksi 4 gram x4 = 32 gr 36 gram
Contoh 2 : jika reaksi antara gas Hidrogen dan gas Oksigen menghasilkan 18
gram uap air, berapakah massa H dan massa O dalam H2O. (Ar H = 1, Ar O=
16)
Jwb : dalam molekul H2O Massa( 2 atom H x 1) :(1 atom O x 16 )
2 : 16
1 : 8
Jadi massa 1 molekul H2O = 1 + 8 = 9
Massa H = x Massa senyawa H2O =x18 gram = 2 gram
Cari Massa O !
Soal
1. Perbaondingan masa karbon dan oksigen dalam senyawa
karbon dioksida (CO2) adalah 3:8, berapa gram karbon
dioksida yang dapat bereaksi dengan 24 gram oksigen
2. Di dalam senyawa AB, perbandingan massa A:B = 2:1jika
terdapat 120 gram senyawa AB tentukan massa masing-
masing unsur dalam senyawa tersebut
Hukum Kelipatan Perbandingan (Hukum Dalton)
“Jika dua jenis unsurbergabung membentuk lebih dari satu
senyaw, dan jika massa salah satu unsurdalam senyawa
tersebut sama, sedangkan massa unsur lainya berbeda, maka
perbandingan massa unsur kan bilangan lainya dalam
senyawa tersebut merupakan bilangan bulat sederhana”
Contoh soal
Unsur P dan Q membentuk 2 macam senyawa berikut
Senyawa Unsur P (%) Unsur Q (%)
I 25% 75%
II 50% 50%
Jika massa P dibuat tetap, tentukan perbandingan massa unsur Q
dalam senyawa I dan II
Penyelesaian
P Q P Q
I 25% X 2 75% X 2 50% 150%
II 50% X 1 50% X 1 50% 50%
Maka perbandingan Q senyawa I : senyawa II
150% : 50%
3 1
Soal
1. Nitrogen dapat membentuk senyawa-senyawa N2O, NO2,
N2O3, N2O4 dengan komposisi sebagai berikut
Senyawa Massa N Massa O
N 2O 28 16
NO2 14 16
N2 O 3 28 48
N2 O 4 28 64
Bila Massa N dibuat tetap, maka carilah perbandingan masa
Oksigen dalam senyawa N2O, NO2, N2O3, N2O4
Hukum Perbandingan volum (Hukum Gay
Lussac)
“ Pada suhu dan tekanan yang sama, volume gas-gas yang
bereaksi dan volume gas-gas berbanding sebagai bilangan
bulat dan sederhana “
• H2 (g) + Cl2 (g) 2HCl (g)
2L 2L 4L (sama-sama dibagi 2)
Perbandingan volume H2 : Cl2 : HCl= 1 : 1 : 2
• 2H2 (g) + O2 (g) 2H2O (g)
2L 1L 2L (sama-sama dibagi 1)
Perbandingan volume H2 : Cl2 : HCl= 2 : 1 : 2
Soal
1. Gas SO3 dibuat dari reaksi gas O2 dengan gas SO3 menurut
persamaan reaksi
SO2 (g) + O2 (g) SO3 (g)
Jika volume gas O2 yang direaksikan adalah 10 mL hitung
volume SO2 yang bereaksi dan volume SO3 (hasil reaksi ) jika di
ukur pada P (tekanan) dan T (suhu) yang sama
Hukum Avogadro
“Pada suhu dan tekanan yang sama semua gas bervolume
sama mengandung jumlah molekul yang sama pula “
=
Contoh soal
Sejumlah y molekul gas metana CH4 mempunyai Volume 2L
pada P dan T yang sama, volume 1,5 y gas CO2
Jawab : =
=
=
V CO2 = 3L
Anda mungkin juga menyukai
- Kunci LKPD Hukum DasarDokumen6 halamanKunci LKPD Hukum DasarErlina Septiani Putri50% (2)
- Hukum-Hukum Dasar KimiaDokumen26 halamanHukum-Hukum Dasar KimiamuaffifahBelum ada peringkat
- Hukum-Hukum Dasar KimiaDokumen16 halamanHukum-Hukum Dasar KimiaDhanu Eric0% (2)
- STOIKIOMETRIDokumen30 halamanSTOIKIOMETRIPrsklaDkBelum ada peringkat
- Hukum Dasar KimiaDokumen3 halamanHukum Dasar KimiaWINDABelum ada peringkat
- Bab 5 StoikiometriDokumen40 halamanBab 5 StoikiometriRifalda Fadilla-LadyBelum ada peringkat
- Stoikiometri 2 RevisiDokumen43 halamanStoikiometri 2 RevisiNaafi Biya100% (1)
- Kimdas - StoikiometriDokumen92 halamanKimdas - StoikiometriviviBelum ada peringkat
- Hukum Dasar KimiaDokumen6 halamanHukum Dasar KimiaTika NovianasariBelum ada peringkat
- Kuliah 6 StoikiometriDokumen31 halamanKuliah 6 StoikiometriCiputt MarmutBelum ada peringkat
- Stoikiometri (Kelompok 8)Dokumen25 halamanStoikiometri (Kelompok 8)Andi Isna YunitaBelum ada peringkat
- Tugas KimiaDokumen26 halamanTugas KimiaMalau ChristianBelum ada peringkat
- Pers - Reaksi &HK DasarDokumen4 halamanPers - Reaksi &HK DasarfirginaaBelum ada peringkat
- StoikiometriDokumen36 halamanStoikiometrialgi fariBelum ada peringkat
- 6-7 Kimia StoikiometriDokumen14 halaman6-7 Kimia StoikiometriIzal MuriduBelum ada peringkat
- Hukum-Hukum Dasar KimiaDokumen30 halamanHukum-Hukum Dasar KimiaNoval PutraBelum ada peringkat
- Hukum Dasar KimiaDokumen4 halamanHukum Dasar KimiaAlesandro EkoBelum ada peringkat
- StokiometriDokumen90 halamanStokiometriRiyan WibawaBelum ada peringkat
- (X-2) Konsep Mol Dan StoikiometriDokumen57 halaman(X-2) Konsep Mol Dan StoikiometriFarhahBelum ada peringkat
- StoikiometriDokumen29 halamanStoikiometriAdinda Rizki AmeliaBelum ada peringkat
- Hukum - Hukum Dasar Kimia Dan StoikiometriDokumen24 halamanHukum - Hukum Dasar Kimia Dan StoikiometriImam TaufikBelum ada peringkat
- Hukum Dasar KimiaDokumen22 halamanHukum Dasar KimiaYuanita AndrianiBelum ada peringkat
- Rangkuman Hukum Dasar Kimia Dan Perhitungan KimiaDokumen6 halamanRangkuman Hukum Dasar Kimia Dan Perhitungan KimiaRostati KhadijahBelum ada peringkat
- 1.stoikiometri Kimia.2017pptxDokumen29 halaman1.stoikiometri Kimia.2017pptxHaura SekarBelum ada peringkat
- 1 HK Dasar & Konsep MolDokumen21 halaman1 HK Dasar & Konsep MolZhe' Fitheighta HalizaizzaluphnoorsaypanjogerBelum ada peringkat
- 5 - Stoikiometri 6Dokumen41 halaman5 - Stoikiometri 6Hairun NisaBelum ada peringkat
- Hukum Hukum DasarDokumen4 halamanHukum Hukum DasarSeyhu Ahmed WaeeBelum ada peringkat
- 10 Hukum KimiaDokumen7 halaman10 Hukum KimiaseptianaBelum ada peringkat
- Bahan Ajar Hukum Dasar KimiaDokumen6 halamanBahan Ajar Hukum Dasar Kimiakiky skyBelum ada peringkat
- 5 6 Stoikiometri PDFDokumen42 halaman5 6 Stoikiometri PDFNathaliaSihombingBelum ada peringkat
- Hukum Hukum Dasar KimiaDokumen12 halamanHukum Hukum Dasar Kimia20 039Elvi SafitriBelum ada peringkat
- Kimia Dasar 09 Stoikiometri 1Dokumen31 halamanKimia Dasar 09 Stoikiometri 1Wahyu Dwi SetiawanBelum ada peringkat
- Hitungan KimiaDokumen8 halamanHitungan KimiaancharBelum ada peringkat
- Modul Stoikiometri (12 Maret 2021) PDFDokumen32 halamanModul Stoikiometri (12 Maret 2021) PDFRatna SariBelum ada peringkat
- (X) HK Dasar Kimia (27apr2021)Dokumen19 halaman(X) HK Dasar Kimia (27apr2021)naila.ramadhani4101Belum ada peringkat
- Hukum Dasar Kimia SMT 2 (Daring)Dokumen4 halamanHukum Dasar Kimia SMT 2 (Daring)Tatag Syah Putra LewiBelum ada peringkat
- Contoh Soal Dan Pembahasan Hukum Dasar Ilmu KimiaDokumen6 halamanContoh Soal Dan Pembahasan Hukum Dasar Ilmu KimiaLeny LatifaturohmahBelum ada peringkat
- Bab Iv Hukum - Hukum Dasar Kimia: ContohDokumen4 halamanBab Iv Hukum - Hukum Dasar Kimia: Contohm abid wafiBelum ada peringkat
- Hukum Dasar KimiaDokumen15 halamanHukum Dasar KimiaWilyam NabenBelum ada peringkat
- 5 Hukum Dasar KimiaDokumen14 halaman5 Hukum Dasar KimiaLin YulitaBelum ada peringkat
- HK Dasar Kimia-2 (SFILEDokumen8 halamanHK Dasar Kimia-2 (SFILEDI DIBelum ada peringkat
- Kd-8,9,10 - Stoikiometri - Hukum Dasar Kimia Dan Ar Mr-1-1Dokumen20 halamanKd-8,9,10 - Stoikiometri - Hukum Dasar Kimia Dan Ar Mr-1-1ajhiesoetiawanBelum ada peringkat
- Hukum Dasar KimiaDokumen22 halamanHukum Dasar KimiaDzul HadisBelum ada peringkat
- Hukum Hukum Dasar KimiaDokumen25 halamanHukum Hukum Dasar KimiaFiTri Yani SyarbiniBelum ada peringkat
- StoikiometriDokumen27 halamanStoikiometrinopitaBelum ada peringkat
- 6 Reaksi Kimia & PerhitunganDokumen38 halaman6 Reaksi Kimia & PerhitunganAnadia PutriBelum ada peringkat
- StoikiometriDokumen45 halamanStoikiometriAdnanRifqyGhiffarinBelum ada peringkat
- Hukum Dasar Kimia - Kelompok 5 FixDokumen12 halamanHukum Dasar Kimia - Kelompok 5 Fixنداء الحسنةBelum ada peringkat
- Hukumdasarkimia 210416140528Dokumen22 halamanHukumdasarkimia 210416140528ronalBelum ada peringkat
- Review Lengkap StoikiometriDokumen7 halamanReview Lengkap StoikiometrifaisalBelum ada peringkat
- 02 Hukum Dasar Kimia - MHSWDokumen36 halaman02 Hukum Dasar Kimia - MHSWEquator IdBelum ada peringkat
- Kimia Dasar Untuk FisikaDokumen14 halamanKimia Dasar Untuk Fisikanida ulfBelum ada peringkat
- 12892364Dokumen15 halaman12892364SheZk FitrianiBelum ada peringkat
- Hukum Hukum Dasar KimiaDokumen16 halamanHukum Hukum Dasar KimiaTengku Alfaisal HardianBelum ada peringkat
- Hitungan KimiaDokumen9 halamanHitungan KimiaAmiliah R. SafitriBelum ada peringkat
- Tugas Online 2 KLS X Mipa 3Dokumen4 halamanTugas Online 2 KLS X Mipa 3Dewi WidowatiBelum ada peringkat