Tugas Termodinamika
Diunggah oleh
Hengky KurniaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Tugas Termodinamika
Diunggah oleh
Hengky KurniaHak Cipta:
Format Tersedia
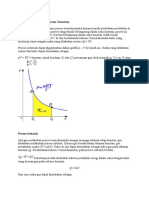
PROSES-PROSES PERUBAHAN KEADAAN GAS DALAM TERMODINAMIKA
1) Proses Isometrik (volume konstan)
Isometrik adalah proses perubahan keadaan yang terjadi pada volume tetap. Jika gas melakukan proses termodinamika dalam volume yang konstan, gas dikatakan melakukan proses isokhorik. Karena gas berada dalam volume konstan (V = 0), gas tidak melakukan usaha (W = 0) dan kalor yang diberikan sama dengan perubahan energi dalamnya. Kalor di sini dapat dinyatakan sebagai kalor gas pada volume konstan QV. QV = U Bila volume konstan, p/T = konstan, pi/ Ti = pf/Tf p f
i V Pada proses ini V = 0, maka usaha yang dilakukan W = 0, sehingga Q = U = n cv T
Penerapan Proses Isometrik Terjadi pada sebuah kipas dan baterai dalam sebuah wadah tertutup. Kipas bisa berputar menggunakan energi yang disumbangkan baterai. Untuk kasus ini, kipas, baterai dan udara yang berada di dalam wadah dianggap sebagai sistem. Ketika kipas berputar, kipas melakukan kerja terhadap udara yang ada dalam wadah. Pada
saat yang sama, energi kinetik kipas berubah menjadi energi dalam udara. Energi listrik pada baterai tentu saja berkurang karena sudah berubah bentuk menjadi energi dalam udara. Contoh ini hanya mau menunjukkan bahwa pada proses isokorik (volume selalu konstan), kerja masih bisa dilakukan terhadap sistem (kerja yang tidak melibatkan perubahan volume).
2) Proses Isobaris (tekanan konstan) Isobarik adalah proses perubahan keadaan yang terjadi pada volume konstan. Jika gas melakukan proses termodinamika dengan menjaga tekanan tetap konstan, gas dikatakan melakukan proses isobarik. Karena gas berada dalam tekanan konstan, gas melakukan usaha (W = pV). Kalor di sini dapat dinyatakan sebagai kalor gas pada tekanan konstanQp. Berdasarkan hukum I termodinamika, pada proses isobarik berlaku Proses sebelumnya telah dituliskan bahwa perubahan energi dalam sama dengan kalor yang diserap gas pada volume konstan QV =U Dari sini usaha gas dapat dinyatakan sebagai W = Qp QV Jadi, usaha yang dilakukan oleh gas (W) dapat dinyatakan sebagai selisih energi (kalor) yang diserap gas pada tekanan konstan (Qp) dengan energi (kalor) yang diserap gas pada volume konstan (QV).
Bila tekanan konstan, V/T = konstan, Vi/ Ti = Vf/Tf p
f V
Pada proses ini usaha yang dilakukan W = p V = p (Vf - Vi ) , sehingga U = Q - W U = n cp T - p Penerapan Proses Isobaris Proses isobarik ini dapat dijumpai pada kasus pemanasan air di dalam ketel mesin uap sampai ke titik didihnya dan diuapkan sampai air menjadi uap, kemudian uap tersebut disuperpanaskan (superheated), dengan semua proses berlangsung pada suatu tekanan konstan.. Sistem tersebut adalah H2O di dalam sebuah wadah yang berbentuk selinder. Sebuah pengisap kedap udara yang tak mempunyai gesekan dibebani dengan pasir untuk menghasilkan tekanan yang didinginkan pada H2O dan untuk mempertahankan tekanan tersebut secara otomatis. Kalor dapat dipindahkan dari lingkungan ke sistem dengan menggunakan sebuah pembakar bunsen. Jika proses tersebut terus berlangsung cukup lama, maka air mendidih dan sebagian air tersebut diubah menjadi uap. Sistem tersebut bereskpansi secara kuasi statik tetapi tekanan yang dikerahkan sistem pada pengisap otomatis akan konstan.
3) Proses Isotermis (temperatur konstan) Isotermis adalah perubahan sistem, di mana suhu tetapkonstan: T = 0. Ini biasanya terjadi ketika suatusistem beradadalam kontak dengan reservoir panas luar (mandi panas), danperubahan terjadi perlahan cukup u ntuk memungkinkan sistemuntuk terus-menerus menyesuaikan dengan suhu reservoirmelalui pertukaran panas. dalam proses isotermal,nilai T 0 = tapi Q 0 diri
Bila temperatur konstan, pV = konstan, piVi = pfVf p i
f V Pada proses ini T = 0, maka perubahan tenaga internal U = 0, dan usaha yang dilakukan : W = p dV p = nRT/V, maka W = nRT (1/V) dV W = nRT ln (Vf/Vi)
Penerapan Proses Isotermis Kompresor yang ada pada sistem pendingin dipergunakan sebagai alat untuk memampatkan fluida kerja (refrigent), jadi refrigent yang masuk ke dalam kompresor dialirkan ke condenser yang kemudian dimampatkan di kondenser. Di bagian kondenser ini refrigent yang dimampatkan akan berubah fase dari refrigent fase uap menjadi refrigent fase cair, maka refrigent mengeluarkan kalor yaitu kalor penguapan yang terkandung di dalam refrigent. Adapun besarnya kalor yang dilepaskan oleh kondenser adalah jumlahan dari energi kompresor yang diperlukan dan energi kalor yang diambil evaparator dari substansi yang akan didinginkan.
Pada kondensor tekanan refrigent yang berada dalam pipa-pipa kondenser relatif jauh lebih tinggi dibandingkan dengan tekanan refrigent yang berada pada pipi-pipa evaporator. Setelah refrigent lewat kondenser dan melepaskan kalor penguapan dari fase uap ke fase cair maka refrigent dilewatkan melalui katup ekspansi, pada katup ekspansi ini refrigent tekanannya diturunkan sehingga refrigent berubah kondisi dari fase cair ke fase uap yang kemudian dialirkan ke evaporator, di dalam evaporator ini refrigent akan berubah keadaannya dari fase cair ke fase uap, perubahan fase ini disebabkan karena tekanan refrigent dibuat sedemikian rupa sehingga refrigent setelah melewati katup ekspansi dan melalui evaporator tekanannya menjadi sangat turun. Hal ini secara praktis dapat dilakukan dengan jalan diameter pipa yang ada dievaporator relatif lebih besar jika dibandingkan dengan diameter pipa yang ada pada kondenser. Dengan adanya perubahan kondisi refrigent dari fase cair ke fase uap maka untuk merubahnya dari fase cair ke refrigent fase uap maka proses ini membutuhkan energi yaitu energi penguapan, dalam hal ini energi yang dipergunakan adalah energi yang berada di dalam substansi yang akan didinginkan. Dengan diambilnya energi yang diambil dalam substansi yang akan didinginkan maka enthalpi substansi yang akan didinginkan akan menjadi turun, dengan turunnya enthalpi maka temperatur dari substansi yang akan didinginkan akan menjadi turun. Proses ini akan berubah terus-menerus sampai terjadi pendinginan yang sesuai dengan keinginan. Dengan adanya mesin pendingin listrik ini maka untuk mendinginkan atau menurunkan temperatur suatu substansi dapat dengan mudah dilakukan
4) Proses Adiabatis
Adiabatik adalah tidak ada kalor yang ditambahkan pada sistem atau meninggalkan sistem (Q = 0). Proses adiabatik bisa terjadi pada sistem tertutup yang terisolasi dengan baik. Untuk sistem tertutup yang terisolasi dengan baik, biasanya tidak ada kalor yang dengan seenaknya mengalir ke dalam sistem atau meninggalkan sistem. Proses adiabatik juga bisa terjadi pada sistem tertutup yang tidak terisolasi. Untuk kasus ini, proses harus dilakukan dengan sangat cepat sehingga kalor tidak sempat mengalir menuju sistem atau meninggalkan sistem Pada proses ini tidak ada kalor yang masuk, maupun keluar dari sistem, Q = 0. Pada proses adiabatik berlaku hubungan pV = konstan (buktikan), piV i = pfV f p i
f V Usaha yang dilakukan pada proses adiabatis : W = p dV p = k/V , k = konstan , maka W = (k/V ) dV W = 1/( -1) { pfVf - piVi}
MAKALAH PERUBAHAN KEADAAN GAS
Mata Kuliah Termodinamika I
Nama : Hengky Kurnia Jurusan : Teknik Mesin
Sekolah Tinggi Teknologi (STT) Fatahillah Jl. Griya Serdang Indah No. 229 Cilegon
Anda mungkin juga menyukai
- Siklus Otto Dan Proses DinamikaDokumen13 halamanSiklus Otto Dan Proses Dinamikafrenkyindra100% (1)
- Termodinamika Dan Siklus CarnotDokumen8 halamanTermodinamika Dan Siklus CarnotGama Syahid100% (1)
- Bab Iii Termodinamika SmaDokumen63 halamanBab Iii Termodinamika SmaLuthfiansyah RBelum ada peringkat
- Isokhorik AdalahDokumen2 halamanIsokhorik AdalahArief MunandarBelum ada peringkat
- AdiabatikDokumen9 halamanAdiabatikceritaraBelum ada peringkat
- Term Odin A MikaDokumen25 halamanTerm Odin A MikaDandhy D'Azulgranas Culerz BarcaBelum ada peringkat
- Analisis Energi Untuk Sistem Tertutup-1Dokumen28 halamanAnalisis Energi Untuk Sistem Tertutup-1David MahendraBelum ada peringkat
- Fisika - Usaha LuarDokumen4 halamanFisika - Usaha LuarHarisa Mardiah100% (1)
- TermodinamikaDokumen5 halamanTermodinamikaApri HadyBelum ada peringkat
- Termodinamika (Isotermik, Isokhorik, Isobarik Dan Adiabatik)Dokumen7 halamanTermodinamika (Isotermik, Isokhorik, Isobarik Dan Adiabatik)Resti anaBelum ada peringkat
- TermodinamikaDokumen55 halamanTermodinamikaUlfie Kusuma WardhaniBelum ada peringkat
- TermodinamikaDokumen5 halamanTermodinamikasri astutiBelum ada peringkat
- TERMODINAMIKADokumen20 halamanTERMODINAMIKAAnggera BayuBelum ada peringkat
- Soal Dan FenelesaiantermodinamikaDokumen5 halamanSoal Dan FenelesaiantermodinamikaZhun AkbarBelum ada peringkat
- Termodinamika Untuk SMA Kelas XIDokumen6 halamanTermodinamika Untuk SMA Kelas XISabri SibuaBelum ada peringkat
- Termo GrafikDokumen11 halamanTermo GrafikHana RiaBelum ada peringkat
- TermodinamikaDokumen22 halamanTermodinamikaEga FirmansyahBelum ada peringkat
- TermodinamikaDokumen33 halamanTermodinamikaLukman HakimBelum ada peringkat
- Hukum 1 TermodinamikaDokumen22 halamanHukum 1 TermodinamikaEka WiranathaBelum ada peringkat
- Perbedaan Isotermis Isobaris Isokhoris AdiabatisDokumen13 halamanPerbedaan Isotermis Isobaris Isokhoris AdiabatisFrend Die Frend100% (1)
- Termodina MikaDokumen5 halamanTermodina MikaDeviBelum ada peringkat
- Proses IsotermikDokumen3 halamanProses IsotermikNaztasya Claudia0% (1)
- TUGAS-KIMIA-FISIK Kelompok 5 Analis KimiaDokumen16 halamanTUGAS-KIMIA-FISIK Kelompok 5 Analis KimiaVickiBelum ada peringkat
- Proses-Proses Termodinamika: DjukarnaDokumen9 halamanProses-Proses Termodinamika: DjukarnaMuh Fadli AdriyawanBelum ada peringkat
- Tugas TermoDokumen7 halamanTugas TermoRaymond SilalahiBelum ada peringkat
- Hukum TermodinamikaDokumen10 halamanHukum Termodinamikaakun warnetBelum ada peringkat
- TERMODINAMIKADokumen10 halamanTERMODINAMIKAsofia nourilmanisaBelum ada peringkat
- Tugas 1 - Ahmad Bagas Setiawan - 02311940000049Dokumen41 halamanTugas 1 - Ahmad Bagas Setiawan - 02311940000049Ahmad Bagas SetiawanBelum ada peringkat
- Tugas Kimia Fisika Bu AuliaDokumen8 halamanTugas Kimia Fisika Bu AuliaMuhammad HarisBelum ada peringkat
- Grafik Perubahan Keadaan Gas Idea1Dokumen10 halamanGrafik Perubahan Keadaan Gas Idea1angelBelum ada peringkat
- Makalah TermodinamikaDokumen34 halamanMakalah TermodinamikaNanang SyahputraBelum ada peringkat
- Hukum Pertama TermodinamikaDokumen7 halamanHukum Pertama TermodinamikaAmriani AnrahBelum ada peringkat
- Fixx Proses Thermodinamika ShelinapDokumen11 halamanFixx Proses Thermodinamika ShelinapDhevBelum ada peringkat
- 1.1 Latar Belakang: Bab I PendahuluanDokumen14 halaman1.1 Latar Belakang: Bab I PendahuluanAfrina Dearny DamanikBelum ada peringkat
- Tugas TermoDokumen7 halamanTugas TermoSiti widayanaBelum ada peringkat
- TermodinamikaDokumen35 halamanTermodinamikaHelloIts ValenBelum ada peringkat
- Grafik Perubahan Keadaan Gas IdealDokumen10 halamanGrafik Perubahan Keadaan Gas IdealM Anggradya Iqbal100% (1)
- Cara Kerja Mesin Panas, Mesin Dingin, Serta Energi Bebas Helmholtz & GibbsDokumen13 halamanCara Kerja Mesin Panas, Mesin Dingin, Serta Energi Bebas Helmholtz & GibbsElok Sweety'zBelum ada peringkat
- PROSESDokumen11 halamanPROSESBUDI SAPUTRABelum ada peringkat
- Entropi 1Dokumen53 halamanEntropi 1PrillyyyyBelum ada peringkat
- Makalah Kelompok Usaha Dalam Termodinamika.Dokumen9 halamanMakalah Kelompok Usaha Dalam Termodinamika.elenia aminiBelum ada peringkat
- RumusDokumen9 halamanRumusNovitha YogidansyahBelum ada peringkat
- Rangkuman Materi - Kelompok 9 - Kimia FisikaDokumen10 halamanRangkuman Materi - Kelompok 9 - Kimia FisikaELSA OKTAVIANI SOPYANBelum ada peringkat
- Angga Hermawansyah - 21338021 Tugas M6 ThermodinamikaDokumen14 halamanAngga Hermawansyah - 21338021 Tugas M6 Thermodinamikaangga hermawansyahBelum ada peringkat
- Termodinamika MineralDokumen4 halamanTermodinamika MineralRia Dwi IzahyantiBelum ada peringkat
- Proses PolytropicDokumen10 halamanProses PolytropicFadhlul FajriBelum ada peringkat
- Proses IsotermikDokumen2 halamanProses IsotermikEG. A 2015Belum ada peringkat
- TermodinamikaDokumen15 halamanTermodinamikaDhikaa SyakirellBelum ada peringkat
- Analisis Energi Untuk Sistem TertutupDokumen25 halamanAnalisis Energi Untuk Sistem Tertutupagus susantoBelum ada peringkat
- Grafik Perubahan Keadaan Gas IdealDokumen10 halamanGrafik Perubahan Keadaan Gas IdealamijuniaBelum ada peringkat
- Materi 4 Neraca Energi Pada Sistem TertutupDokumen16 halamanMateri 4 Neraca Energi Pada Sistem TertutupVindo MolindraBelum ada peringkat
- Konversi Energi Tugas Temu2Dokumen3 halamanKonversi Energi Tugas Temu2MarisImanBelum ada peringkat
- Bab 9 Termodinamika BaruDokumen27 halamanBab 9 Termodinamika BaruCop RobotBelum ada peringkat
- Termodinamika DasarDokumen17 halamanTermodinamika DasarPangeran CintaBelum ada peringkat
- Proses Adibiatik Reversibel Dan Proses Adibiatik IreversibelDokumen8 halamanProses Adibiatik Reversibel Dan Proses Adibiatik IreversibelSAVAGE KIDZBelum ada peringkat
- Makalah KalorDokumen36 halamanMakalah Kalornanang wahdiatBelum ada peringkat
- Pencemaran TanahDokumen3 halamanPencemaran TanahBlackstarsBelum ada peringkat
- Konversi EnergiDokumen11 halamanKonversi EnergiHengky KurniaBelum ada peringkat
- Kep Ka Bapedal Tahun 1995 Nomor 01 Tatacara Penyimpanan LBDokumen15 halamanKep Ka Bapedal Tahun 1995 Nomor 01 Tatacara Penyimpanan LBHengky KurniaBelum ada peringkat
- Fisika IntiDokumen18 halamanFisika IntiQoe IooNkBelum ada peringkat
- Karakteristik GeneratorDokumen4 halamanKarakteristik GeneratorHengky KurniaBelum ada peringkat
- LaporanDokumen15 halamanLaporanHengky KurniaBelum ada peringkat
- Pengaruh Las TerhadapDokumen17 halamanPengaruh Las TerhadapHengky KurniaBelum ada peringkat
- Contoh Daftar PustakaDokumen2 halamanContoh Daftar PustakaHengky KurniaBelum ada peringkat
- Berita Acara Ketua RTDokumen11 halamanBerita Acara Ketua RTHengky KurniaBelum ada peringkat
- Analisa Pembahasan Pengaruh LasDokumen15 halamanAnalisa Pembahasan Pengaruh LasHengky KurniaBelum ada peringkat
- Zona IkhlasDokumen38 halamanZona IkhlasIrma Rahmanisa20% (5)
- Pengaruh Las TerhadapDokumen17 halamanPengaruh Las TerhadapHengky KurniaBelum ada peringkat
- Analisis TermalDokumen19 halamanAnalisis TermalFajar AriantoBelum ada peringkat
- Menggerinda Pahat Dan Alat PotongDokumen38 halamanMenggerinda Pahat Dan Alat PotongDeny SetiawanBelum ada peringkat
- Kep Ka Bapedal Tahun 1995 Nomor 01 Tatacara Penyimpanan LBDokumen15 halamanKep Ka Bapedal Tahun 1995 Nomor 01 Tatacara Penyimpanan LBHengky KurniaBelum ada peringkat
- SOP-2 Ternak Lele (Penyempurnaan SOP-1)Dokumen10 halamanSOP-2 Ternak Lele (Penyempurnaan SOP-1)Sugiharto Hadi Wibowo PhlBelum ada peringkat
- TermodinamikaDokumen27 halamanTermodinamikaluphieimoBelum ada peringkat
- Dasar Kalkulus VektorDokumen49 halamanDasar Kalkulus VektorHengky Kurnia50% (2)
- Belajar KalkulusDokumen107 halamanBelajar KalkulusHilman Adriyanto100% (1)
- Teori Mesin Parut KelapaDokumen8 halamanTeori Mesin Parut KelapaHizora CorpBelum ada peringkat
- Power Point Gilingan Daging NewDokumen9 halamanPower Point Gilingan Daging NewHengky KurniaBelum ada peringkat
- UlirDokumen18 halamanUlirHengky Kurnia100% (1)
- Makalah Pencemaran TanahDokumen7 halamanMakalah Pencemaran TanahHengky KurniaBelum ada peringkat
- Surat Lamaran KerjaDokumen1 halamanSurat Lamaran KerjaHengky KurniaBelum ada peringkat
- Termodinamika Entropi Dan HK KeduaDokumen25 halamanTermodinamika Entropi Dan HK Keduaapi-27091270100% (4)
- Belajar KalkulusDokumen107 halamanBelajar KalkulusHilman Adriyanto100% (1)
- Distribusi Frekuensi (Compatibility Mode)Dokumen11 halamanDistribusi Frekuensi (Compatibility Mode)Hengky KurniaBelum ada peringkat
- Diktat Getaran MekanikDokumen33 halamanDiktat Getaran Mekanikismaildandi100% (2)
- Profil Perubahan Tekanan Gas Terhadap Suhu Pada Volume Tetap (Dodi Krisdianto Agus Purwanto, Sumarna) PDFDokumen6 halamanProfil Perubahan Tekanan Gas Terhadap Suhu Pada Volume Tetap (Dodi Krisdianto Agus Purwanto, Sumarna) PDFHacked ManBelum ada peringkat