TERMOKIMIA
Diunggah oleh
Nailil Amali0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
15 tayangan2 halamantermokimia
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Initermokimia
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
15 tayangan2 halamanTERMOKIMIA
Diunggah oleh
Nailil Amalitermokimia
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
TERMOKIMIA
A. Sistem, Lingkungan dan Alam Semesta
Sistem adalah bagian dari alam semesta yang sedang menjadi pusat perhatian. Bagian lain dari alam semesta
yang berinteraksi dengan sistem kita sebut lingkungan.
Azas Kekekalan Energi
“Energi tidak dapat diciptakan atau dimusnahkan, tetapi energi dapat mengalami perubahan dari bentuk energi
tertentu menjadi energi lainnya“.
Setiap zat mempunyai energi kinetic dan energi potensial. Jumlah energi kinetic dan energi potensial dari suatu zat
disebut dengan energi dalam ( U ). Energi dalam tidak dapat diukur. Yang dapat diukur adalah perubahan energi
dalam ( ΔU). Perubahan energi dalam sama dengan jumlah kalor (q) dan kerja (w). Kalor (q) yang dimiliki oleh zat
pada tekanan tetap disebutu juga dengan entalpi ( H).
Perubahan entalpi ( ΔH) terjadi selama proses penambahan atau pelepasan kalor. Besarnya perubahan entalpi
adalah selisih jumlah entalpi hasil reaksi dengan jumlah entalpi pereaksi.
Δ H = H produk – H reaktan
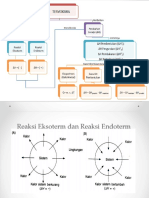
B. Reaksi Eksoterm dan Endoterm
Reaksi Eksoterm
Pada reaksi eksoterm terjadi perpindahan kalor dari sistem ke lingkungan atau pada reaksi tersebut dikeluarkan
panas. Pada reaksi eksoterm harga ΔH = negatif ( – )
Contoh :
C(s) + O2(g) CO2(g) + 393.5 kJ ; ΔH = -393.5 kJ
Reaksi endoterm
Pada reaksi terjadi perpindahan kalor dari lingkungan ke sistem atau pada reaksi tersebut dibutuhkan panas.
Pada reaksi endoterm harga ΔH = positif ( + )
Contoh :
CaCO3(s) → CaO(s) + CO2(g)- 178.5 kJ ; ΔH = +178.5 kJ
C. Perhitungan Perubahan Entalpi
Entalpi Pembentukan Standar (ΔHf)
Perubahan entalpi reaksi ditentukan berdasarkan selisih dari perubahan entalpi pembentukan produk dan
perubahan entalpi pembentukan pereaksi.
ΔH = ΣΔHf (Produk) – ΣΔHf (Pereaksi)
Contoh :
Tentukan perubahan entalpi standar untuk reaksi pembakaran 1 mol etana menurut reaksi
C2H6(g) + 7/2 O2(g) à 2 CO2(g) + 3 H2O(g)
Bila diketahui :
Δ Hf CO2(g) = – 394 kJ/mol ΔHf C2H6(g) = – 85 kJ/mol
Δ Hf H2O(g) = – 286 kJ/mol ΔHf O2(g) = 0 kJ/mol
Jawab :
ΔH = ΣΔHf (Produk) – ΣΔHf (Pereaksi)
= ( 2x Δ Hf CO2(g) + 3x Δ Hf H2O(g) ) – (ΔHf C2H6(g) + 7/2 ΔHf O2(g) )
= ( 2x ( – 394) + 3x ( – 286)) –(( – 85) + 0))
= ( – 788 – 958 ) + 85
= – 1561 kJ/ mol
Entalpi Penguraian ( Δ Hd, dari kata decompotition atau peruraian).
ΔHd yaitu ΔH dari penguraian 1 mol persenyawaan langsung menjadi unsur-unsurnya (= Kebalikan dari
ΔH pembentukan).
Contoh : H2O(l) H2(g) + 1/2 O2(g) ; ΔH = +285.85 kJ
Entalpi Pembakaran Standar ( ΔHc ).
Subskrip c berasal dari kata combustion atau pembakaran. ΔHc yaitu ΔH untuk membakar 1 mol persenyawaan
dengan O2 dari udara yang diukur pada 298 K dan tekanan 1 atm.
Contoh: CH4(g) + 2O2(g) à CO2(g) + 2H2O(l) ; ΔHc = -802 kJ.
Perhitungan Entalpi Reaksi Berdasarkan Energi Ikatan
Reaksi kimia pada dasarnya terjadi karena adanya pemutusan dan pembentukan kembali ikatan – ikatan kimia
dalam suatu zat. Zat-zat pereaksi dapat bereaksi antara satu dengan lainnya setelah zat tersebut mengalami
pemutusan ikatan-ikatannya. Sedangkan pada zat hasil ( produk) terjadi pembentukan ikatan kembali.
ΔH = Σ Eikatan yang putus – Σ E ikatan yang terbentuk
Anda mungkin juga menyukai
- 18 Termokimia1Dokumen47 halaman18 Termokimia1najmahanifah253Belum ada peringkat
- Reaksi EksotermDokumen11 halamanReaksi EksotermYudy ArmantoBelum ada peringkat
- Kimia Kelas Xi SMTR 2Dokumen13 halamanKimia Kelas Xi SMTR 2Muhammad SuaibBelum ada peringkat
- Materi Termokimia MicroDokumen10 halamanMateri Termokimia MicroSitiNurAzizah A.TBelum ada peringkat
- Reaksi EksotermDokumen4 halamanReaksi Eksotermmuhammad ghaziBelum ada peringkat
- 3 TermokimiaDokumen9 halaman3 TermokimiaIvan ApriBelum ada peringkat
- Handout TermokimiaDokumen7 halamanHandout TermokimiaA'Yu P. LarasatiBelum ada peringkat
- Termokimia 1Dokumen21 halamanTermokimia 1Desi wulandariBelum ada peringkat
- BAB II TermokimiaDokumen4 halamanBAB II TermokimiaTri FaturrBelum ada peringkat
- Termokimia PDFDokumen42 halamanTermokimia PDFstrygwyrgtBelum ada peringkat
- Termokimia PPTXDokumen24 halamanTermokimia PPTXpipitBelum ada peringkat
- TermoDokumen20 halamanTermoIren BungaBelum ada peringkat
- TermokimiaDokumen23 halamanTermokimiariscaherlina81Belum ada peringkat
- Bahan Ajar TermokimiaDokumen32 halamanBahan Ajar Termokimiacecile ljBelum ada peringkat
- Termokimia ZoomDokumen11 halamanTermokimia ZoomZakwan AlthofBelum ada peringkat
- Bahan Ajar TermoDokumen7 halamanBahan Ajar TermoLucsy ThelyanaBelum ada peringkat
- Termokimia TGTDokumen18 halamanTermokimia TGTSyafira TiaradipaBelum ada peringkat
- Bab 5 TermokimiaDokumen5 halamanBab 5 TermokimiaHafidz SayyidBelum ada peringkat
- TermokimiaDokumen41 halamanTermokimiaCininta AdmiraBelum ada peringkat
- TERMOKIMIADokumen10 halamanTERMOKIMIAendahBelum ada peringkat
- Pengantar Termodinamika 1-1Dokumen13 halamanPengantar Termodinamika 1-1AgusBelum ada peringkat
- MATERI Kim XI TermokimiaDokumen10 halamanMATERI Kim XI Termokimiasatyajulian4Belum ada peringkat
- Term Okimi ADokumen5 halamanTerm Okimi AWiwied Rizky Puspita RahayuBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIARahayu LestariBelum ada peringkat
- TERMOKIMIADokumen27 halamanTERMOKIMIARyan KOntjo BrothersBelum ada peringkat
- Soal Kimdas 2Dokumen11 halamanSoal Kimdas 2Rachma Rumie RianthiBelum ada peringkat
- 14 TermokimiaDokumen23 halaman14 TermokimiaAdamDio ZaidanDhuhaBelum ada peringkat
- Bahan Ajar Termokimia - PPLDokumen21 halamanBahan Ajar Termokimia - PPLSonia hadjaweoBelum ada peringkat
- TermokimiaDokumen30 halamanTermokimiaLailatul LuthfiyatiBelum ada peringkat
- KD 4, TermokimiaDokumen5 halamanKD 4, TermokimiaAprya NingsihBelum ada peringkat
- TermokimiaDokumen25 halamanTermokimiaidzni desrifaniBelum ada peringkat
- Materi TermokimiaDokumen32 halamanMateri Termokimianurhikmah_88Belum ada peringkat
- TERMOKIMIADokumen37 halamanTERMOKIMIATM-21-084 RIFQI TUBAGUS HILMIBelum ada peringkat
- Termokimia 2Dokumen9 halamanTermokimia 2fathirskw01Belum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Bab 2 TermokimiaDokumen17 halamanBab 2 TermokimiamaawsBelum ada peringkat
- THERMOKIMIADokumen4 halamanTHERMOKIMIAnaufal29Belum ada peringkat
- Offiwiz - File KIMIA 11Dokumen29 halamanOffiwiz - File KIMIA 11Dea SalsabilaBelum ada peringkat
- TermokimiaDokumen17 halamanTermokimiaYosep Kevin DamanikBelum ada peringkat
- TERMOKIMIADokumen17 halamanTERMOKIMIASyafiqa50% (2)
- Term Odin A MikaDokumen73 halamanTerm Odin A MikaFadhiil faridhzaBelum ada peringkat
- TERMOKIMIA MateriDokumen29 halamanTERMOKIMIA MateriZaisith Asputri FellyBelum ada peringkat
- Term Okimi ADokumen24 halamanTerm Okimi ASyaiful AnamBelum ada peringkat
- Termokimia 2Dokumen28 halamanTermokimia 2Ayu Tri AstutiBelum ada peringkat
- Bab 5 TermokimiaDokumen23 halamanBab 5 TermokimiaMalik LamendoBelum ada peringkat
- Bab 5-TermokimiaDokumen23 halamanBab 5-TermokimiaDeliaBelum ada peringkat
- Tugas Resume Kimia Fisika TermokimiaDokumen10 halamanTugas Resume Kimia Fisika TermokimiaTiara DwiscaBelum ada peringkat
- TermokimiaDokumen13 halamanTermokimiaai nurlelaBelum ada peringkat
- Modul TermokimiaDokumen24 halamanModul TermokimiaRahmat Ma'dikaBelum ada peringkat
- Termokimia XI Mia Gasal 1920Dokumen9 halamanTermokimia XI Mia Gasal 1920SiswatiBelum ada peringkat
- Termokimia SMADokumen23 halamanTermokimia SMAWahid ArdaniBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIAikke febri yenikaBelum ada peringkat
- LKPD tERMOKIMIADokumen11 halamanLKPD tERMOKIMIAKrisostomus AnsaBelum ada peringkat
- TERMOKIMIADokumen59 halamanTERMOKIMIAerna ferikaBelum ada peringkat
- MODUL ThermokimiaDokumen12 halamanMODUL ThermokimiaIra Irani PuspitasariBelum ada peringkat
- Termokimia PPTXDokumen23 halamanTermokimia PPTXEfrin SitumorangBelum ada peringkat
- Materi 2 Kimia Kls Xi Mipa 12 Bab2 Termokimia 1628734578Dokumen28 halamanMateri 2 Kimia Kls Xi Mipa 12 Bab2 Termokimia 1628734578Sintiya LemantiBelum ada peringkat
- Termokimia PPTDokumen23 halamanTermokimia PPTIPANG GamingBelum ada peringkat
- Materi Kimia Umum 2Dokumen53 halamanMateri Kimia Umum 2Agung Pratama Hitarijat100% (3)
- 01surat Keterangan Pindah OutDokumen2 halaman01surat Keterangan Pindah OutNailil AmaliBelum ada peringkat
- VISI MISI SAIPUL RIZAL, S.PDDokumen2 halamanVISI MISI SAIPUL RIZAL, S.PDNailil AmaliBelum ada peringkat
- Rekomendasi: Lalu Junaidi, S.PDDokumen2 halamanRekomendasi: Lalu Junaidi, S.PDNailil AmaliBelum ada peringkat
- 25 Pembahasan Soal Vektor Fisika SMADokumen10 halaman25 Pembahasan Soal Vektor Fisika SMANailil AmaliBelum ada peringkat
- Surat Pernyataan Orang Tua PDFDokumen1 halamanSurat Pernyataan Orang Tua PDFsmk elfatahBelum ada peringkat
- Alat Optik SmaDokumen8 halamanAlat Optik SmaNailil AmaliBelum ada peringkat
- Proposal Jalan GangDokumen3 halamanProposal Jalan GangNailil AmaliBelum ada peringkat
- JADWAL PEMBAGIAN REKENING BOS MTsDokumen1 halamanJADWAL PEMBAGIAN REKENING BOS MTsNailil AmaliBelum ada peringkat
- Nilai BIO 10 IPA 1Dokumen12 halamanNilai BIO 10 IPA 1Nailil AmaliBelum ada peringkat
- Form Pantauan BLK KomunitasDokumen9 halamanForm Pantauan BLK KomunitasNailil AmaliBelum ada peringkat
- MA Yaqin 1 - SURAT MITRADokumen1 halamanMA Yaqin 1 - SURAT MITRANailil AmaliBelum ada peringkat
- Berita Acara Pendirian KoperasiDokumen1 halamanBerita Acara Pendirian KoperasiNailil AmaliBelum ada peringkat
- Nilai Akhir PJK 10 IPA 1Dokumen2 halamanNilai Akhir PJK 10 IPA 1Nailil AmaliBelum ada peringkat
- COVER SOALlDokumen1 halamanCOVER SOALlNailil AmaliBelum ada peringkat
- Penfantar Lapor BulanDokumen4 halamanPenfantar Lapor BulanNailil AmaliBelum ada peringkat
- Surat Sdi Yaqin 1 Ujung BetokDokumen1 halamanSurat Sdi Yaqin 1 Ujung BetokNailil AmaliBelum ada peringkat
- SURAT REKOMENDASI DewanDokumen1 halamanSURAT REKOMENDASI DewanNailil AmaliBelum ada peringkat
- Format Penilaian SemesterDokumen6 halamanFormat Penilaian SemesterNailil AmaliBelum ada peringkat
- PROPOSAL KubeDokumen8 halamanPROPOSAL KubeNailil AmaliBelum ada peringkat
- Formulir Pendaftaran Himpunan Pengusaha OnlineDokumen1 halamanFormulir Pendaftaran Himpunan Pengusaha OnlineNailil AmaliBelum ada peringkat
- DAFTAR HADIR Rapat Ketua JamaahDokumen7 halamanDAFTAR HADIR Rapat Ketua JamaahNailil AmaliBelum ada peringkat
- Surat KuasaDokumen2 halamanSurat KuasaNailil AmaliBelum ada peringkat
- FISIKA X (Kunci)Dokumen3 halamanFISIKA X (Kunci)akrom anulBelum ada peringkat
- STRUKTUR OkDokumen1 halamanSTRUKTUR OkNailil AmaliBelum ada peringkat
- Akte Kelahiran AbidDokumen2 halamanAkte Kelahiran AbidNailil AmaliBelum ada peringkat
- Sertifikat Prodi Fisika PDFDokumen1 halamanSertifikat Prodi Fisika PDFNailil AmaliBelum ada peringkat
- Sertifikat Prodi Fisika PDFDokumen1 halamanSertifikat Prodi Fisika PDFNailil AmaliBelum ada peringkat
- Kelompok Tani Ternak ContohDokumen13 halamanKelompok Tani Ternak ContohNailil AmaliBelum ada peringkat
- FISIKA XI (Kunci)Dokumen3 halamanFISIKA XI (Kunci)Nailil AmaliBelum ada peringkat