KIMIA
Diunggah oleh
teguhoktoviyantoHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
KIMIA
Diunggah oleh
teguhoktoviyantoHak Cipta:
Format Tersedia
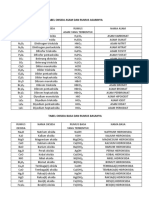
16. Bilangan oksidasi X pada senyawa HX; HXO; HXO2; HXO3 berturut-turut adalah ….
A. -1; +1; +2; +3
B. +1; 0; +3; +5-
C. -1; +1; +3; +5
D. +1; -2; +2; +3
E. +1; +2; +2; +3
17. Perhatikan persamaan kimia berikut !
1) IO3 - IO4 –
2) Ca Ca2+ + 2e-
3) Zn2+ + 2e- Zn-
4) NO3- NO
Persamaan kimia oksidasi terdapat pada nomor ……
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
18. Bilangan oksidasi atom Cl yang terbesar terdapat dalam …..
A. NaCl
B. KClO
C. Cl2O
D. Ca(ClO4)2
E. Cl2O3
19. Dalam senyawa atau ion berikut, nitrogen berikut yang mempunyai bilangan oksidasi -3
adalah….
A. NO
B. N
C. N
D. NH3
E. N2H4
20. Reaksi dibawah ini yang mengalami perubahaan bilangan oksidasi sebanyak 6 satuan
adalah
A. NO3- (aq) NO (g)
3-
B. SbO4 (aq) SbO3 3- (aq)
2-
C. SO4 (aq) SO2 (g)
D. S2O32- (aq) S4O62- (aq)
E. ClO3 – (aq) Cl- (aq)
Pembahasan
16. HX
biloks H + biloks X = 0
+1 + b.o X = 0
b.o X = -1
HXO
b.o H + b.o X + b.o O = 0
+1 + b.o X + (-2) =0
b.o X = +1
HXO2
b.o H + b.o X + 2.b.o O = 0
+1 +X +b.o X – 4 =0
b.o X = +3
HXO3
b.o H + b.o X +3.b.o O = 0
+1 +b.o X – 6 = 0
b.o X = +5
17. IO3- biloks I = +5 dan biloks O = -2 menjadi IO4- dengan biloks I = +7 dan O = -2
terjadi oksidasi di unsur I .
Ca Ca2+ + 2e- adalah suatu bentuk serah terima electron pada reaksi
oksidasi.
18. Bilangan oksidasi Cl terbesar adalah:
NaCl = biloks Cl adalah -1
KClO = biloks Cl adalah +1
Cl2O = biloks Cl adalah +2
Ca(ClO4)2 = biloks Cl adalah + 7
Cl2O3 = biloks Cl adalah +3
jadi biloks Cl yang paling besar terdapat pada senyawa Ca(ClO4)2
19. Bilangan oksidasi Nitrogen (N) = -3 adalah :
NO = biloks N adalah +2
N = biloks N adalah +3
N = biloks N adalah +5
NH3 = biloks N adalah -3
N2H4 = biloks N adalah -2
jadi biloks N yang -3 terdapat pada senyawa NH3
20. ClO3 – (aq) Cl- (aq)
biloks Cl = +5 biloks Cl = -1
biloks O = -2
terjadi perubahan antara unsur Cl sebanyak 6 satuan dari biloks +5menjadi biloks-1
( reaksi reduksi ).
Anda mungkin juga menyukai
- Pembahasan Soal OSK Kimia Tahun 2014Dokumen7 halamanPembahasan Soal OSK Kimia Tahun 2014Ummul KhairatBelum ada peringkat
- SOAL BiloksDokumen43 halamanSOAL BiloksAnton Timur100% (2)
- Oal Dan Pembahasan Reaksi RedoksDokumen13 halamanOal Dan Pembahasan Reaksi RedoksYossie Indriana100% (1)
- Latihan UTBK Asam Basa, Buffer, HidrolisisDokumen4 halamanLatihan UTBK Asam Basa, Buffer, HidrolisisHadad Al AkbarBelum ada peringkat
- OSP Kimia 2017Dokumen15 halamanOSP Kimia 2017Ria KastrianiBelum ada peringkat
- Soal Dan Pembahasan Redoks & ElektrokimiaDokumen8 halamanSoal Dan Pembahasan Redoks & Elektrokimiasteffanie malauholloBelum ada peringkat
- Kimia UnsurDokumen12 halamanKimia UnsurvividwifitrianiBelum ada peringkat
- Pembahasan Soal OSN 2020Dokumen9 halamanPembahasan Soal OSN 2020Ai NayaBelum ada peringkat
- Soal Golongan Unsur UtamaDokumen5 halamanSoal Golongan Unsur UtamaYeti FebrinaBelum ada peringkat
- Contoh Soal Lar ElektroDokumen7 halamanContoh Soal Lar ElektroAnonymous UcLtUWR100% (1)
- Sifat Koligatif Larutan (Tipe B Dan A)Dokumen12 halamanSifat Koligatif Larutan (Tipe B Dan A)alika shania100% (1)
- SOAL RedoksDokumen9 halamanSOAL Redoksnesa nozariBelum ada peringkat
- Uas Gasal KLS XDokumen6 halamanUas Gasal KLS XAgung ErdiyantoBelum ada peringkat
- Soal Ulangan Redoks Dan Sel VoltaDokumen3 halamanSoal Ulangan Redoks Dan Sel VoltaMA NurussaadahBelum ada peringkat
- Soal Kimia Alkali TanahDokumen1 halamanSoal Kimia Alkali Tanahjoko prayitnoBelum ada peringkat
- Rumus Kimia, Tata Nama Senyawa, PersamaanDokumen29 halamanRumus Kimia, Tata Nama Senyawa, PersamaanSamuel EnoBelum ada peringkat
- Ikatan KimiaDokumen13 halamanIkatan KimiahendrynordanBelum ada peringkat
- LKS Reaksi Eksoterm-EndotermDokumen1 halamanLKS Reaksi Eksoterm-EndotermSemy LewedaluBelum ada peringkat
- Pembahasan Un Kimia 2019Dokumen28 halamanPembahasan Un Kimia 2019esterBelum ada peringkat
- Paket 3Dokumen11 halamanPaket 3Adi MakayasaBelum ada peringkat
- Soal Alkali TanahDokumen5 halamanSoal Alkali TanahAnnisa SharfinaBelum ada peringkat
- 2Dokumen1 halaman2Nurul AminiBelum ada peringkat
- Mengidentifikasi CerpenDokumen9 halamanMengidentifikasi CerpenFivenella GBelum ada peringkat
- Tabel Oksida Asam Dan Rumus AsamnyaDokumen2 halamanTabel Oksida Asam Dan Rumus AsamnyaYohanes Alvin100% (3)
- Contoh Soal UnDokumen4 halamanContoh Soal UnAndi Azis RusdiBelum ada peringkat
- Tata Nama KimiaDokumen3 halamanTata Nama KimiaStephanus Abednego50% (2)
- Tata Nama SenyawaDokumen11 halamanTata Nama Senyawaweni astuti ningsihBelum ada peringkat
- 01 Persamaan Persamaan LingkaranDokumen9 halaman01 Persamaan Persamaan LingkaranBilly RamliBelum ada peringkat
- Kesetimbangan KimiaDokumen3 halamanKesetimbangan Kimiaparamitha efendi100% (2)
- Soal Un Kimia 2018 Type ADokumen18 halamanSoal Un Kimia 2018 Type AHer Lan SuherlanBelum ada peringkat
- KIMIA KELAS XII Penyetaraan RedoksDokumen4 halamanKIMIA KELAS XII Penyetaraan RedokshadiBelum ada peringkat
- Ebook UN SMA IPA PDFDokumen388 halamanEbook UN SMA IPA PDFErisaBelum ada peringkat
- Faraday Kls 12Dokumen5 halamanFaraday Kls 12Sri WahyuniBelum ada peringkat
- Alkali TanahDokumen9 halamanAlkali Tanahhafidhrahadiyan2100% (1)
- Soal KimiaDokumen11 halamanSoal KimiaAlifa Maylarisa A.100% (1)
- Tryput UTBK 14 Saintek KimiaDokumen20 halamanTryput UTBK 14 Saintek KimiaFendi RohmawanBelum ada peringkat
- Soal Latihan UTBK IIIDokumen1 halamanSoal Latihan UTBK IIIraja albiBelum ada peringkat
- Pembahasan Un Kimia 2017Dokumen27 halamanPembahasan Un Kimia 2017Anonymous pGHBTkMEBBelum ada peringkat
- Kelas XII - RPP - Kimia - SMA - 3 - Michael Purba Dan Eti SDokumen60 halamanKelas XII - RPP - Kimia - SMA - 3 - Michael Purba Dan Eti SkayanwarBelum ada peringkat
- Pemuaian Rahma 12 Ipa 1Dokumen17 halamanPemuaian Rahma 12 Ipa 1Rahma siti zulianti sBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Laporan Praktikum Kimia ElektrolisisDokumen4 halamanLaporan Praktikum Kimia ElektrolisisDestya UciuciBelum ada peringkat
- Soal Dan Jawaban Osn Kimia TK Kab Kota Tahun 2012 Seri CDokumen14 halamanSoal Dan Jawaban Osn Kimia TK Kab Kota Tahun 2012 Seri CHanami AsriBelum ada peringkat
- Kimia 12 5 Senyawa Benzena Dan TurunannyaDokumen7 halamanKimia 12 5 Senyawa Benzena Dan TurunannyaWildana67% (3)
- HBR Tidak Dapat Dibuatdengan Cara Mereaksikan NaBr Dengan H2So4 Karena HBR Bersifat Reduktor Yang Sangat KuatDokumen2 halamanHBR Tidak Dapat Dibuatdengan Cara Mereaksikan NaBr Dengan H2So4 Karena HBR Bersifat Reduktor Yang Sangat KuatHayati NufusBelum ada peringkat
- RedDokumen3 halamanRedblacknaitBelum ada peringkat
- Tugas Portofolio KimiaDokumen15 halamanTugas Portofolio KimiaKayla ArthaniaBelum ada peringkat
- Soal Soal Kesetimbangan KimiaDokumen10 halamanSoal Soal Kesetimbangan KimiaRiyandiBelum ada peringkat
- Soal Respirasi ManusiaDokumen5 halamanSoal Respirasi ManusiaNurul AnnisaBelum ada peringkat
- 9 - LingkaranDokumen7 halaman9 - LingkaranEnang Herdiana YusupBelum ada peringkat
- Jawaban Dan PembahasanDokumen9 halamanJawaban Dan PembahasanUlfahBelum ada peringkat
- Konsep Reaksi Redoks Dan Biloks (Review Materi Kelas 10)Dokumen40 halamanKonsep Reaksi Redoks Dan Biloks (Review Materi Kelas 10)BuyungPranajayaBelum ada peringkat
- Pilihan Ganda RedoksDokumen4 halamanPilihan Ganda RedoksWahyudi PrasetiantoBelum ada peringkat
- 40 Soal Kimia Semester 2Dokumen11 halaman40 Soal Kimia Semester 2Panwas CiwaruBelum ada peringkat
- Soal Pretest PTK RedoksDokumen4 halamanSoal Pretest PTK RedoksMuh. IrwansyahBelum ada peringkat
- Cara Menentukan Bilangan OksidasiDokumen6 halamanCara Menentukan Bilangan OksidasiAnton Timur50% (2)
- Soal Kimia - Reaksi Redoks & Penamaan Senyawa Berdasarkan BiloksDokumen14 halamanSoal Kimia - Reaksi Redoks & Penamaan Senyawa Berdasarkan BiloksAnnisa ZakiyaBelum ada peringkat
- ELEKTROKIMIADokumen2 halamanELEKTROKIMIAAra NomuBelum ada peringkat
- Cara Menentukan Bilangan OksidasiDokumen6 halamanCara Menentukan Bilangan OksidasiFriska WijayaBelum ada peringkat
- Pembahasan: Soal No. 1Dokumen8 halamanPembahasan: Soal No. 1Ryan PurnamanBelum ada peringkat