Elektrolit Dan Non Elektronik
Elektrolit Dan Non Elektronik
Diunggah oleh
sall maaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Elektrolit Dan Non Elektronik
Elektrolit Dan Non Elektronik
Diunggah oleh
sall maaHak Cipta:
Format Tersedia
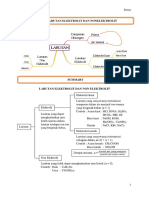
ELEKTROLIT DAN NON ELEKTROLIT
1. ELEKTROLIT DAN NON ELEKTROLIT
ELEKTROLIT DAN NON ELEKTROLIT
Laruran yg dapat menghantarkan arus
Laruran yg TIDAK dapat
listrik
menghantarkan arus listrik
ELEKTROLIT KUAT ELEKTROLIT LEMAH
TIDAK TERIONISASI
Sangat KUAT menghantarkan LEMAH menghantarkan arus Nyala Lampu : mati
arus listrik listrik Gelembung : tidak ada
CO(NH2)2 CO(NH2)2
IONISASI SEMPURNA IONISASI TIDAK SEMPURNA
Nyala Lampu : Terang Nyala Lampu : redup
Gelembung : Banyak Gelembung : sedikit
-
NaCl Na+ + Cl- CH3COOH CH3COO + H+
1. Elektrolit Kuat (α=1): Asam kuat (H+) , Basa Kuat (OH-) dan Garam (Kecuali garam merkuri)
-Asam Kuat : HCl, HBr, HI, HClO3, HClO4, HNO3
-Basa Kuat : Basa dari golongan IA dan IIA kecuali Be(OH)2 dan Mg(OH)2
-Garam : NaCl, K2SO4, CaCl2, AlCl3
2. Elektrolit Lemah (0<α<1) : Asam Lemah, Basa Lemah dan Garam yang sukar larut
-Asam Lemah : HNO2, H3PO3, H3PO4, H2SO3, HCN, H2CO3, HF
-Basa Lemah: Ba(OH)2, Mg(OH)2, dan beberapa basa dari logam transisi
-Garam yang sukar larut : AgCl,BaSO4, BaCrO4, CaCO3
3. Larutan Non Elektrolit (α=0): Senyawa organic molecular yang larut
Glukosa ( C6H12O6), Sukrosa (C12H22O11), Urea (CO(NH2)2), Etanol (C2H5OH), Gliserin (C3H5(OH)3 , dan
etilen glikol (C2H4(OH)2)
Mol zat terionisasi
Derajat Ionisasi (α) = Mol zat mula−mula
Contoh : HCl
HCl(aq) H+(aq) + Cl-(aq)
Katode (-) : 2H+ (aq) + 2e H2(g)
Anode (+) : 2Cl- (aq) Cl2(g) + 2e
Reaksi Total : 2 H+(aq) + 2Cl-(aq) 2H2(g) + Cl2(g)
Gram
Mol = Mr
ELEKTROLIT (menurut sifatnya) senyawa ion
Senyawa kovalen polar
NON ELEKTROLIT Senyawa kovalen non polar
Soal
1. Sebanyak 8,2 gram CH3COONa dilarutkan dalam air. Jika diketahui derajat
ionisasinya sebesar 50% maka berapa mol zat yang terionisasi?
2. Sebanyak 107 gram Fe(OH)3 dilarutkan ke dalam air, jika diketahui derajat
ionisasinya 40% maka jumlah ion negative yang dihasilkan sebesar?
Anda mungkin juga menyukai
- Larutan Elektrolit SmandaDokumen42 halamanLarutan Elektrolit SmandaIndriyati IndriyatiBelum ada peringkat
- Larutan ElektrolitDokumen26 halamanLarutan ElektrolitAmiraBelum ada peringkat
- LARUTANELEKTROLITDokumen27 halamanLARUTANELEKTROLITAmanda WulansariBelum ada peringkat
- Larutan Elektrolit 1Dokumen47 halamanLarutan Elektrolit 1andryBelum ada peringkat
- Larutan ElektrolitDokumen47 halamanLarutan ElektrolitSmkTamansiswaBoja50% (2)
- PERTEMUAN KE DUA KuDokumen47 halamanPERTEMUAN KE DUA KuanggelBelum ada peringkat
- La Rutan Elek Trol ItDokumen48 halamanLa Rutan Elek Trol ItaisharafarahmaBelum ada peringkat
- LARUTANELEKTROLIT1Dokumen50 halamanLARUTANELEKTROLIT1dini nur ihwaniBelum ada peringkat
- Larutan Elektrolit 2020Dokumen12 halamanLarutan Elektrolit 2020ROFIAH FAYA AZZAHRABelum ada peringkat
- Larutan ElektrolitDokumen3 halamanLarutan ElektrolitmugipangestuBelum ada peringkat
- Larutan ElektrolitDokumen33 halamanLarutan ElektrolitNur Nuy KhairiyahBelum ada peringkat
- ElektrolitDokumen21 halamanElektrolitYeskiel LinduBelum ada peringkat
- Pend. PancasilaDokumen127 halamanPend. PancasilaYus MayaBelum ada peringkat
- Daya Hantar5Dokumen13 halamanDaya Hantar5Silvinia IdrBelum ada peringkat
- Larutan Elektrolit Dan Nonelektrolit TsDokumen3 halamanLarutan Elektrolit Dan Nonelektrolit TsTsaniaBelum ada peringkat
- Larutan Elektrolit Dan Non ElektrolitDokumen36 halamanLarutan Elektrolit Dan Non ElektrolitCsukia KuhakuBelum ada peringkat
- Larutan Elektrolit Dan Non Elektrolit 2122Dokumen20 halamanLarutan Elektrolit Dan Non Elektrolit 2122rizky raizinBelum ada peringkat
- ElektrolitDokumen24 halamanElektrolitRahmi MurdaniBelum ada peringkat
- Makalah Hantaran Listrik klp.2Dokumen14 halamanMakalah Hantaran Listrik klp.2Nur AzisahBelum ada peringkat
- Elektrolit Dan Nonelektrolit X Sma 2022Dokumen9 halamanElektrolit Dan Nonelektrolit X Sma 2022stephanus andrewBelum ada peringkat
- Larutan Elektrolit Dan NonelektrolitDokumen6 halamanLarutan Elektrolit Dan NonelektrolitAnak AmbisBelum ada peringkat
- Bagaimana Cara Membedakan Larutan Elektrolit Dan Non ElektrolitDokumen3 halamanBagaimana Cara Membedakan Larutan Elektrolit Dan Non ElektrolitOctavienaBelum ada peringkat
- Larutan Elektrolit Dan Non ElektrolitDokumen21 halamanLarutan Elektrolit Dan Non ElektrolitValenciaBelum ada peringkat
- ElektrolitDokumen3 halamanElektrolitolivia panjaitanBelum ada peringkat
- Larutan Elektrolit Dan Larutan Non-ElektrolitDokumen18 halamanLarutan Elektrolit Dan Larutan Non-ElektrolitshintaBelum ada peringkat
- Lart Elektrolit (TABEL LARUTAN)Dokumen17 halamanLart Elektrolit (TABEL LARUTAN)Khotimah Nurul AiniBelum ada peringkat
- Larutan Elektrolit PPT Klompok5Dokumen20 halamanLarutan Elektrolit PPT Klompok5Agus SanzdingerBelum ada peringkat
- Tugas KIMIADokumen10 halamanTugas KIMIABrancen tvBelum ada peringkat
- Larutan ElektrolitDokumen2 halamanLarutan ElektrolitMa'ruf NurwantaraBelum ada peringkat
- Larutan Elektrolit Dan NonelektrolitDokumen3 halamanLarutan Elektrolit Dan NonelektrolitchemalBelum ada peringkat
- Larutan ElektrolitDokumen5 halamanLarutan ElektrolitYuda Tiansa BaronBelum ada peringkat
- Larutan-Elektrolit (Pertemuan 7)Dokumen20 halamanLarutan-Elektrolit (Pertemuan 7)Henrik Boma AndiBelum ada peringkat
- LARUTAN ELEKTROLIT-peerteachingDokumen25 halamanLARUTAN ELEKTROLIT-peerteachingAjizah Tri LestariBelum ada peringkat
- Lirik Lagu Mars Musi RawasDokumen27 halamanLirik Lagu Mars Musi RawasRisaBelum ada peringkat
- Bab 4 - Larutan Elektrolit Dan Larutan Non-ElektrolitDokumen14 halamanBab 4 - Larutan Elektrolit Dan Larutan Non-ElektrolitYu IndraBelum ada peringkat
- Bab VII Larutan Elektrolit Dan NonelektrolitDokumen6 halamanBab VII Larutan Elektrolit Dan NonelektrolitRiri TamiBelum ada peringkat
- Sifat Hantaran Listrik Larutan Non Elektrolit Dan ElektrolitDokumen3 halamanSifat Hantaran Listrik Larutan Non Elektrolit Dan ElektrolitCahyoWahyudiBelum ada peringkat
- Elektrolit Dan Non ElektrolitDokumen9 halamanElektrolit Dan Non ElektrolitlinggaBelum ada peringkat
- Larutan ElektrolitDokumen2 halamanLarutan ElektrolitNurul SukronBelum ada peringkat
- Tugas 6 PPT Bahan Ajar Pert.9Dokumen19 halamanTugas 6 PPT Bahan Ajar Pert.9Tatik YuliaBelum ada peringkat
- Larutan Elektrolit & NonelektrolitDokumen15 halamanLarutan Elektrolit & NonelektrolitRisnaBelum ada peringkat
- Kimia 29-12-21Dokumen27 halamanKimia 29-12-21hana amabrwatiBelum ada peringkat
- Modul X - Larutan Elektrolit Dan NonelektrolitDokumen2 halamanModul X - Larutan Elektrolit Dan NonelektrolitGhost HunterBelum ada peringkat
- Bab 4 - Larutan Elektrolit, Non-Elektrolit, Dan Reaksi Redoks (R)Dokumen29 halamanBab 4 - Larutan Elektrolit, Non-Elektrolit, Dan Reaksi Redoks (R)Edi SaputraBelum ada peringkat
- Pptelektrolit1 161126024330Dokumen21 halamanPptelektrolit1 161126024330RistantiBelum ada peringkat
- Larutan Elektrolit Dan Non ElektrolitDokumen11 halamanLarutan Elektrolit Dan Non ElektrolitSri ZandrotoBelum ada peringkat
- Lrtel Kim3 6 PDFDokumen2 halamanLrtel Kim3 6 PDFeta momayBelum ada peringkat
- Daya Hantar Listrik Larutan - 1Dokumen20 halamanDaya Hantar Listrik Larutan - 1davekurniawan777Belum ada peringkat
- Larutan Elektrolit Dan Ikatan KimiaDokumen12 halamanLarutan Elektrolit Dan Ikatan Kimiaazure_kidBelum ada peringkat
- Laporan Praktikum KimiaDokumen11 halamanLaporan Praktikum KimiaEti RohayatiBelum ada peringkat
- Daya Hantar Listrik Larutan ElektrolitDokumen17 halamanDaya Hantar Listrik Larutan ElektrolitFira BlbBelum ada peringkat
- 1-Larutan Elektrolit Dan Non ElektrolitDokumen14 halaman1-Larutan Elektrolit Dan Non ElektrolitAgus TridjokoBelum ada peringkat
- Larutan ElektronikDokumen2 halamanLarutan ElektronikNeng raniBelum ada peringkat
- Larutan Elektrolit Dan Non ElektrolitDokumen7 halamanLarutan Elektrolit Dan Non ElektrolitAyuk PebriyaniBelum ada peringkat
- Bab 6 - Larutan Elektrolit Dan Non ElektrolitDokumen13 halamanBab 6 - Larutan Elektrolit Dan Non ElektrolitOsalshabillaBelum ada peringkat
- Larutan Elektrolit Dan Non Elektrolit 2Dokumen9 halamanLarutan Elektrolit Dan Non Elektrolit 2Sitti Hajar SalsabillahBelum ada peringkat
- Larutan Elektrolit Dan NonelektrolitDokumen8 halamanLarutan Elektrolit Dan NonelektrolitmalinaBelum ada peringkat
- Sel ElektrolisisDokumen21 halamanSel ElektrolisisDzikri SaprudinBelum ada peringkat
- Materi Kimia X Seri 15Dokumen4 halamanMateri Kimia X Seri 15Mwoya ige mwoyaBelum ada peringkat
- Tata Nama Senyawa KimiaDokumen2 halamanTata Nama Senyawa Kimiasall maaBelum ada peringkat
- Insiden Hotel YamatoDokumen4 halamanInsiden Hotel Yamatosall maa0% (1)
- TTS SelDokumen4 halamanTTS Selsall maaBelum ada peringkat
- BAHASA JAWA Kelompok 3Dokumen10 halamanBAHASA JAWA Kelompok 3sall maaBelum ada peringkat