Soal Seleksi Kimia ONMIPA2017-Kimia-FMIPA-ITB
Diunggah oleh
triaoktavia456Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Soal Seleksi Kimia ONMIPA2017-Kimia-FMIPA-ITB
Diunggah oleh
triaoktavia456Hak Cipta:
Format Tersedia
Nama: NIM:
Fakultas/Program Studi:
Instruksi
• Pastikan bahwa nama,NIM dan Fakultas/Program Studi Anda sudah tertulis pada
setiap halaman lembar jawaban.
• Anda mempunyai waktu 2 jam (120 menit) untuk mengerjakan soal. Mulailah
ketika aba-aba MULAI diberikan.
• Soal tes ini terdiri atas 9 soal uraian dengan total nilai 208 poin.
• Semua hasil harus ditulis dalam kotak yang disediakan. Penulisan hasil di luar
kotak tidak akan dinilai! Gunakan halaman kosong di balik kertas untuk coret-
coretan.
• Tuliskan uraian perhitungan yang relevan bila perlu. Jika Anda tidak menguraikan
perhitungan dan hanya memberikan hasil akhir yang benar saja untuk perhitungan
yang rumit, maka Anda tidak akan mendapatkan nilai.
• Gunakan angka penting yang sesuai dalam merepresentasikan hasil perhitungan
Anda. Jangan lupa tuliskan satuan yang bersesuaian, jika ada. Jika Anda tidak
menuliskan satuan padahal itu penting, maka Anda tidak akan mendapatkan nilai.
• Jika ada reaksi pada fasa gas, maka perlakukan semuanya sebagai gas ideal.
• Anda harus segera berhenti bekerja bila aba-aba BERHENTI diberikan. Bila tidak
mengindahkan, berkas Anda tidak akan dinilai.
• Berkas soal dan lembar jawaban tes ini terdiri atas 29 halaman.
Kimia-FMIPA-ITB-Feb 2017 Hal 1 / 29
Nama: NIM:
Fakultas/Program Studi:
Tetapan dan Rumus
R = 8,314 J/mol.K F = 96485 A·s/mol
NA = 6,022·1023 mol-1 c = 2,9979·108 m/s
h = 6,62·10-34 J.s (Tetapan Planck) 1 eV = 1,6022·10-19 J
k = 1,312. 103 kJ/mol (Tetapan Bohr)
log x = 2.3026 ⋅ ln x c = c 0A − k ⋅ t ∆H = ∆U + p∆V = ∆U + ∆nRT
Q
p ⋅ V = n⋅R ⋅ T ln c = ln c 0A − k ⋅ t ∆G = ∆Gθ + RT ln Q = RT ln
1 1 K
A = ε ⋅c ⋅d = 0 + k ⋅t ∆Gθ = −RT ln K
cA cA
M⋅I ⋅ t ⋅ η T2
m= k ( T2 ) E A 1 1 S( T2 ) = S( T1) + n.C.ln
z ⋅F ln = − T1
4 k ( T1) R T1 T2
∆T = ∆O H( T2 ) = H( T1) + n.C.(T2 − T1 )
9 R⋅T
∆E = ∆E θ − ⋅ ln Q K P ( T2 ) ∆ HR 1 1
∆ O = 10Dq z ⋅F ln = −
K P ( T1) R T1 T2
∆Gθ = −z.F.∆E θ z1E1θ +z2 E 2θ v ⋅ [S] v
Eθ = + v 0 = MAX WZ = MAX
z1+z2 K M + [S] [E]0
µ eff = n(n + 2) B.M.
T= A = log
Deret Spektrokimia:
I-<Br-<S2-<SCN-<Cl-<F-<OH-<H2O <NH3<en<CN-<CO
Mn2+<Ni2+<Co2+<Fe2+<Fe3+<Cr3+<Pt4+
Pada perhitungan tetapan kesetimbangan, semua konsentrasi dianggap sebagai
konsentrasi standar, yaitu 1 M. Anggap semua gas bersifat ideal dalam semua soal
yang berhubungan dengan gas. Tekanan: 1 atm = 101325 Pa = 760 mmHg; 1 bar =
100 kPa.
Kimia-FMIPA-ITB-Feb 2017 Hal 2 / 29
Nama: NIM:
Fakultas/Program Studi:
Tabel Periodik dengan massa atom relatif
1 18
1 2
H He
1.008 2 13 14 15 16 17 4.003
3 4 5 6 7 8 9 10
Li Be B C N O F Ne
6.94 9.01 10.81 12.01 14.01 16.00 19.00 20.18
11 12 13 14 15 16 17 18
Na Mg Al Si P S Cl Ar
22.99 24.30 3 4 5 6 7 8 9 10 11 12 26.98 28.09 30.97 32.06 35.45 39.95
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
39.10 40.08 44.96 47.87 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.38 69.72 72.64 74.92 78.96 79.90 83.80
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
85.47 87.62 88.91 91.22 92.91 95.96 - 101.07 102.91 106.42 107.87 112.41 114.82 118.71 121.76 127.60 126.90 131.29
55 56 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
Cs Ba 57-71 Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
132.91 137.33 178.49 180.95 183.84 186.21 190.23 192.22 195.08 196.97 200.59 204.38 207.2 208.98 - - -
87 88 104 105 106 107 108 109 110 111
Fr Ra 89-103 Rf Db Sg Bh Hs Mt Ds Rg
- - - - - - - - - -
57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
138.91 140.12 140.91 144.24 - 150.36 151.96 157.25 158.93 162.50 164.93 167.26 168.93 173.05 174.97
89 90 91 92 93 94 95 96 97 98 99 100 101 102 103
Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
- 232.04 231.04 238.03 - - - - - - - - - - -
Kimia-FMIPA-ITB-Feb 2017 Hal 3 / 29
Nama: NIM:
Fakultas/Program Studi:
Pola geseran kimia dalam spektrum 1H-NMR dan 13C-NMR
Data
Kodon untuk valin adalah GUU, GUC, GUA, GUG
Kimia-FMIPA-ITB-Feb 2017 Hal 4 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 1 (18 poin)
Proses terbentuknya ikatan kimia dapat dibayangkan melalui diagram di bawah ini.
Jika afinitas elektron pertama atom Cl adalah −349 kJ/mol, entalpi hidrasi ion Cl− adalah
−364 kJ/mol, dan diketahui nilai entalpi untuk proses
Cl2(g) + 2e → 2Cl−(aq)
adalah -1182.6 kJ/mol.
a. Tentukan nilai C. (4)
b. Di antara Cl2(g) dengan Cl-(aq), ada yang memiliki nilai entropi molar standar 56,60
atau 223,081 J/K.mol. Tunjukkan spesi dengan nilai entropi molar standar yang tepat.
Jelaskan. (4)
Kimia-FMIPA-ITB-Feb 2017 Hal 5 / 29
Nama: NIM:
Fakultas/Program Studi:
c. Tentukan nilai potensial reduksi standar untuk reaksi Cl2(g) + 2e → 2Cl−(aq).(3)
d. Yang kita kenal secara umum adalah diagram energi untuk pembentukan ikatan
senyawa kovalen, namun itu bukan berarti tidak ada diagram energi yang serupa
untuk senyawa ionik. Diagram energi yang kita lihat adalah resultan dari elemen tarik-
menarik dan elemen tolak menolak. Gambarkan sketsa elemen tarik-menarik dan
elemen tolak-menolak di bagian jawaban. (3)
e. Buat sketsa diagram energi terhadap jarak antar atom minimum, ro untuk dua
senyawa BeF2 dan BeO pada grafik yang sama. Jelaskan mengapa demikian. (4)
Gambar tidak perlu menggunakan skala, namun Anda harus menunjukkan
perbedaan antara kedua senyawa tersebut.
E(r) = Etarik + Etolak = dan E(ro) = dengan ro = rkation + ranion.
Kimia-FMIPA-ITB-Feb 2017 Hal 6 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 2 (24 poin)
Dalam bidang kimia anorganik, seringkali kita dihadapkan dengan “kristal”. Kristal adalah
sistem yang teratur dan berulang tak hingga, dan unit yang berulang disebut sebagai unit
sel. Untuk menganalisis kristal, biasanya kita menggunakan difraksi sinar X. Difraksi sinar
X menggunakan prinsip penghamburan sinar X oleh atom-atom pada kristal.
a. Jika pembuatan sinar X menggunakan konversi energi listrik dari sebuah elektron
dalam potensial listrik sebesar 8 kV menjadi energi gelombang elektromagnetik
sepenuhnya, berapa nilai panjang gelombang sinar X yang diperoleh? (3)
b. Difraksi sinar X mengikuti hukum Bragg, yaitu nλ = 2dsinθ. d adalah interplanar
spacing dan hubungannya dengan panjang sisi unit sel yang berbentuk kubus (a)
adalah :
dengan h, k, l, adalah Indeks Miller yang merupakan bilangan bulat positif (0,1,2,3..). Jika
hukum Bragg terpenuhi pada nilai h,k,l yang tepat, maka akan dihasilkan puncak-puncak
difraksi pada difraktogram. Ada yang menarik dalam nilai h,k,l untuk setiap jenis unit sel
yang menghasilkan puncak difraksi.
Unit sel kubus sederhana = nilai h,k,l berapapun akan menghasilkan puncak difraksi.
Unit sel kubus berpusat badan = nilai h+k+l harus positif untuk menghasilkan puncak
difraksi.
Unit sel kubus berpusat muka = nilai h,k,l harus ganjil semua atau genap semua untuk
menghasilkan puncak difraksi.
Jika kita memiliki 3 sampel A, B, dan C dengan data 2θ (o) yang memberikan puncak
difraksi di bawah ini.
A B C
42,2 28,8 42,8
49,2 41,0 73,2
72,0 50,8 89,0
87,3 59,6 115,0
Kimia-FMIPA-ITB-Feb 2017 Hal 7 / 29
Nama: NIM:
Fakultas/Program Studi:
Tentukan masing-masing jenis struktur unit sel apakah sampel A, B, dan C. (9)
c. Yang menjadi perbedaan utama untuk unit sel kubus sederhana, kubus berpusat
badan, dan kubus berpusat muka selain strukturnya adalah nilai persen pengepakan
atau rasio dari volume atom yang mengisi unit sel terhadap volume unit sel. Dengan
asumsi atom berbentuk bola dan unit sel berbentuk kubus, berapa nilai persen
pengepakan untuk setiap jenis unit sel tersebut? (4)
Kimia-FMIPA-ITB-Feb 2017 Hal 8 / 29
Nama: NIM:
Fakultas/Program Studi:
d. Selain itu, difraksi sinar X dapat menjadi data awal kita untuk menentukan berbagai
sifat kristal lainnya. Diketahui dengan menggunakan panjang gelombang sama
dengan jawaban (a), terdapat puncak difraksi pada sudut 2θ(o) : 40, 58, 73, 86,8, 92,6,
100,4, 108,4, dan 114,7 untuk sebuah material berstruktur kubik. Tentukan berat
material jika kita ingin membuat plat bervolume 100 mL. (5)
e. Jelaskan apakah kita dapat menggunakan data difraksi sinar X untuk mengetahui
suatu material dalam kondisi tertekan (pressed). Jika ya, mengapa? (3)
Kimia-FMIPA-ITB-Feb 2017 Hal 9 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 3 (21 poin)
Kromatografi adalah metode yang banyak digunakan untuk memisahkan campuran dalam
senyawa. Kromatografi gas (GC) dan kromatografi cair kinerja tinggi (HPLC) merupakan
contoh kromatografi yang banyak berkembang saat ini. GC umumnya digunakan pada
senyawa yang mudah diuapkan, sedangkan HPLC pada senyawa yang memiliki titik didih
cukup tinggi. Pemisahan yang terjadi diakibatkan oleh perbedaan interaksi antara
senyawa-senyawa di dalam sampel dengan fasa diam dan fasa gerak pada sistem
kromatografi. Fasa diam pada GC umumnya bersifat polar dengan fasa gerak non polar,
sedangkan HPLC sebaliknya. Berikut adalah data kromatogram.
a. Kromatogram tersebut merupakan hasil dari GC ataukah HPLC (pilih salah satu).
Berikan alasan anda. (3)
b. Urutkan kepolaran dari ke empat senyawa di atas. Berikan alasan singkat. (4)
Kimia-FMIPA-ITB-Feb 2017 Hal 10 / 29
Nama: NIM:
Fakultas/Program Studi:
c. Berikut adalah istilah yang umum pada kromatografi. Berikan penjelasan singkat
terhadap masing-masing istilah. Jika ada rumus anda dipersilahkan untuk menuliskan
rumusnya juga. (14)
(i) Waktu mati/dead time
(ii) Selektivitas
(iii) Waktu retensi
(iv) Resolusi
(v) Tailing dan fronting
Kimia-FMIPA-ITB-Feb 2017 Hal 11 / 29
Nama: NIM:
Fakultas/Program Studi:
(vi) Pelat teoritis
(vii) Gradien temperatur
Kimia-FMIPA-ITB-Feb 2017 Hal 12 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 4 (29 poin)
Suatu sampel batuan yang diketahui mengandung perak, dianalisis kadar peraknya
dengan teknik titrasi potensiometri, AAS dan voltametri. Preparasi sampel dilakukan
dengan menggerus halus 3,05 gram sampel batuan dan dicampurkan dengan 15 mL aqua
regia sambil dipanaskan pada 80oC selama 1 jam. Larutan yang tersisa disaring dan
wadah reaksi dibilas 3x. Larutan hasil penyaringan kemudian ditepatkan menjadi 100 mL
(larutan A). Sebanyak 10 mL larutan ini dipipet dan diencerkan hingga 50 mL (larutan B).
Sebanyak 10 mL larutan B kemudian diencerkan hingga 250 mL (larutan C). Sebanyak 10
mL larutan A diencerkan hingga 100 mL (larutan D).
a. Titrasi dilakukan dengan memipet 25 mL larutan A untuk dititrasi dengan larutan NaCN
0,01 M. Untuk mencapai titik ekivalen, dibutuhkan 24,3 mL larutan NaCN. Selain
menggunakan titrasi potensiometri, titrasi juga dapat dilakukan dengan menggunakan
indikator rhodanin. Rhodanin pada kondisi bebas memiliki warna kuning sedangkan
dalam bentuk kompleks berwarna pink.
(i) Tuliskan reaksi yang terjadi saat titrasi, tergolong reaksi apakah ini? (3)
(ii) Tentukan kadar perak dalam sampel (%w) berdasarkan metode ini. (6)
Kimia-FMIPA-ITB-Feb 2017 Hal 13 / 29
Nama: NIM:
Fakultas/Program Studi:
(iii) Jika digunakan indikator rhodanin, perubahan warna apakah yang akan teramati? (2)
(iv) Gambarkan sketsa kurva titrasi potensiometri di atas. Lengkapi juga dengan legenda
yang sesuai. (2)
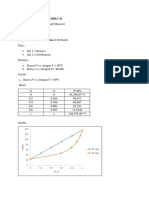
b. Pengukuran dengan AAS dilakukan menggunakan larutan C. Pengukuran standar
perak dan sampel memberikan absorbansi sebagai berikut
[ppm] standar Absorbansi
2 0,156
4 0,314
6 0,459
8 0,600
10 0,743
sampel 0,346
(i) Gambarkan skesta hubungan antara serapan atom perak terhadap panjang gelombang
pengukuran pada AAS. Lengkapi dengan legenda yang sesuai. (2)
Kimia-FMIPA-ITB-Feb 2017 Hal 14 / 29
Nama: NIM:
Fakultas/Program Studi:
(ii) Tentukan kadar perak dalam sampel (%w) berdasarkan metode ini. (6)
c. Pengukuran voltametri menggunakan prinsip penambahan standar dan menggunakan
larutan D. Pada percobaan ini digunakan metode differential pulse voltammetry dan
elektroda karbon termodifikasi N-(2-aminoetil)-4,4’-bipiridin. Sebanyak 10 mL sampel
diukur dan memberikan arus puncak 17,5 mA. Sampel kemudian ditambahkan dengan
0,5 mL standar perak 10 mikroM dan diukur kembali memberikan arus puncak 36,2 mA.
(i) Gambarkan sketsa voltamogram siklik untuk ion Ag(I). Berikan juga legenda yang
sesuai. (2)
Kimia-FMIPA-ITB-Feb 2017 Hal 15 / 29
Nama: NIM:
Fakultas/Program Studi:
(ii) Tentukan kadar perak dalam sampel (%w) berdasarkan metode ini. (6)
Kimia-FMIPA-ITB-Feb 2017 Hal 16 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 5 (21 poin)
Minyak bumi merupakan campuran hidrokarbon rantai pendek maupun panjang, lurus
maupun bercabang, aromatik maupun alifatik.
a. Salah satu klasifikasi minyak mentah adalah berdasarkan API gravity.
API gravity = (141,5/specific gravity)-131,5
Jenis minyak API Gravity
mentah
Light >31,1
Medium 22,3-31,1
Heavy <22,3
Extra Heavy <10,0
Specific gravity merupakan perbandingan kerapatan minyak terhadap suatu cairan
acuan (air). Suatu sampel minyak mentah diuji kerapatannya di laboratorium
menggunakan piknometer. Hasil yang didapat adalah sebagai berikut.
Data Hasil Pengukuran
Massa piknometer kosong 15,043 g
Massa piknometer berisi air 39,984 g
Massa piknometer berisi minyak 38,882 g
Massa jenis air (27°C) 0,996 g/mL
Suhu Ruangan 27°C
Tentukan jenis sampel minyak tersebut berdasarkan nilai API gravity-nya. (3)
b. Pemisahan dan pemurnian minyak bumi dapar dilakukan melalui proses destilasi
bertingkat. Diagram suhu-komposisi diperlukan untuk memahami proses tersebut.
Berikut adalah data suhu-komposisi campuran hidrokarbon A dan B pada tekanan
1,0 atm, dengan symbol x untuk fraksi mol dalam fasa cair dan y untuk fraksi mol
dalam fasa gas saat setimbang.
Kimia-FMIPA-ITB-Feb 2017 Hal 17 / 29
Nama: NIM:
Fakultas/Program Studi:
Suhu 125 130 135 140 145 150
(°C)
xA 0,91 0,65 0,45 0,30 0,18 0,098
yA 0,99 0,91 0,77 0,61 0,45 0,25
Titik didih hidrokarbon A dan B adalah 124°C dan 155°C.
(i) Gambarkan diagram suhu-komposisi campuran tersebut. (4)
(ii) Tentukan komposisi uap saat setimbang ketika komposisi xA 0,50 dan xB
0,33. (3)
Kimia-FMIPA-ITB-Feb 2017 Hal 18 / 29
Nama: NIM:
Fakultas/Program Studi:
c. Bensin merupakan salah satu hasil destilasi minyak bumi dengan komponen utama
adalah heptana. Energi dapat dihasilkan dari reaksi pembakaran heptana dalam
atmosfer oksigen yang menghasilkan gas karbondioksida dan uap air.
(i) Hitung energi yang dihasilkan dari reaksi pembakaran sempurna 10,0 L
heptana (asumsi efisiensi 100%) dengan menggunakan data berikut. (5)
Data Nilai Data Nilai
ΔHv heptana 36,1 kJ/mol ΔHv H2O 40,65 kJ/mol
Eikatan C-H 412 kJ/mol ΔHatomisasi C 716,7 kJ/mol
Eikatan C-C 348 kJ/mol Eikatan O=O 497 kJ/mol
Eikatan C=O 743 kJ/mol Eikatan O-H 463 kJ/mol
Eikatan H-H 436 kJ/mol ρheptana 0,684 g/mL
(ii) Berdasarkan poin (i), prediksikan apakah reaksi tersebut berlangsung secara
spontan atau tidak. Jelaskan. (3)
Kimia-FMIPA-ITB-Feb 2017 Hal 19 / 29
Nama: NIM:
Fakultas/Program Studi:
d. Hidrokarbon paling sederhana yang dikenal adalah metana (CH4). Senyawa ini
berwujud gas pada suhu ruang dan mempunyai geometri tetrahedral dengan sudut
H-C-H sebesar 109,5°. Berdasarkan teori ikatan valensi (Valence Bond Theory),
orbital 1s hidrogen yang berisi 1 elektron akan bertumpangsuh dengan 2 orbital 2p
karbon yang masing-masing berisi satu buah elektron. Ikatan yang dihasilkan akan
mempunyai sudut sebesar 90° dan senyawa yang terbentuk adalah CH2. Hal ini
bertentangan dengan fakta bahwa tidak ditemukan senyawa CH2. Jelaskan apa
yang terjadi dalam proses terbentuknya ikatan tersebut. (3)
Kimia-FMIPA-ITB-Feb 2017 Hal 20 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 6 (29 poin)
Oksigen merupakan senyawa yang dibutuhkan makhluk hidup untuk proses pernafasan.
a. Data berikut didapat melalui eksperimen gas oksigen pada suhu 273.15 K.
P (atm) 0,7500 0,5000 0,2500
Vm (L.mol-1) 29,8649 44,8090 89,6384
Jika gas oksigen diasumsikan gas ideal, tentukan nilai tetapan gas R dan massa molar
gas oksigen. (4)
b. Suatu wadah 3,0 L diisi dengan 24 gram gas oksigen, 48 gram gas nitrogen, dan 56
gram gas karbondioksida. Jika diasumsikan gas-gas tersebut tidak bereaksi dan suhunya
tetap 298,15 K, tentukan tekanan total gas tersebut. (4)
Kimia-FMIPA-ITB-Feb 2017 Hal 21 / 29
Nama: NIM:
Fakultas/Program Studi:
c. Tentukan massa jenis gas oksigen pada poin (b). (3)
d. Sejumlah gas oksigen dengan tekanan 250 bar dimasukkan ke dalam sebuah silinder.
Tentukan volume molar gas oksigen pada suhu 298,15 K jika mengikuti (i) persamaan gas
ideal, (ii) persamaan van der Waals (a = 1,364 dm6 atm mol-2, b = 3,19×10-2 dm3 mol-1). (4)
e. Tentukan kerja (dalam kJ) ekspansi reversibel isotermal 1,0 mol gas oksigen pada
298,15 K dari 1,0 m3 ke 4,0 m3 jika gas tersebut mengikuti gas ideal. Apakah sistem
melakukan atau menerima kerja? Jelaskan. (5)
Kimia-FMIPA-ITB-Feb 2017 Hal 22 / 29
Nama: NIM:
Fakultas/Program Studi:
Gas oksigen dapat dihasilkan juga dari reaksi dekomposisi hidrogen peroksida sebagai
berikut:
I−
2H2O2(aq) → 2H2O(l) + O2(g)
Selama reaksi berlangsung terdeteksi adanya spesi IO− dan hukum laju berdasarkan
eksperimen untuk reaksi tersebut adalah r=k[H2O2][I−].
f. Usulkan mekanisme dekomposisi H2O2 yang memenuhi syarat-syarat tersebut.
Tahap manakah yang menjadi tahap penentu laju? Jelaskan. (4)
g. Apa fungsi I− pada reaksi di atas? Jelaskan. (2)
h. Jika diketahui reaksi dekomposisi H2O2 adalah reaksi eksoterm, gambarkan sketsa
antara energi dan koordinat reaksi untuk mekanisme yang Anda usulkan pada soal
(a). Tunjukkan pula letak keadaan transisi dan intermediate pada sketsa tersebut.
(3)
Kimia-FMIPA-ITB-Feb 2017 Hal 23 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 7 (20 poin)
Artemisinin merupakan obat anti malaria yang ditemukan oleh Tu Youyou pada tahun 1970-an
yang merupakan ekstrak dari tanaman Artemesia annua. Di bawah ini merupakan jalur
sintesis Artemisinin. Berkat jasanya, Tu Youyou meraih hadiah nobel kedokteran pada tahun 2015.
a. Sarankan mekanisme reaksi sintesis senyawa 4 menjadi 7, senyawa 7 menjadi 5b, dan
5b menjadi 9. (15)
Kimia-FMIPA-ITB-Feb 2017 Hal 24 / 29
Nama: NIM:
Fakultas/Program Studi:
13
b. Berikut merupakan data CNMR dari senyawa 7. Tentukan posisi atom-atom karbon
yang bersesuaian dengan sinyal-sinyal NMR tersebut untuk geseran kimia (δ) 212,6
ppm, 128,9 ppm, 126,4 ppm, dan 57,2 ppm. Jelaskan. (5)
Kimia-FMIPA-ITB-Feb 2017 Hal 25 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 8 (26 poin)
Komponen utama dari minyak bumi adalah hidrokarbon jenuh dan sikloalkana. Komponen
lain dalam jumlah kecil merupakan aromatik hidrokarbon, tiol, sulfida, thiophenes dan
amina. Dari minyak mentah, untuk pertama kalinya asam monoprotik A diidentifikasi, yang
digunakan untuk melapisi kayu, emulsifikasi minyak sebagai aditif untuk bahan bakar dan
ekstraktan pelarut karet. Satu mol asam A membentuk satu mol senyawa B jika A
direaksikan dengan Pd/C. Senyawa B juga merupakan asam monoprotik. Diketahui
bahwa netralisasi 1 g A membutuhkan 8,33 ml KOH 0,500 M. Reaksi B yang dipanaskan
dengan larutan KMnO4 dalam suasana asam membentuk senyawa C dan D. Senyawa C
memiliki dua jenis atom hidrogen dan tiga jenis atom karbon. Kerangka karbon senyawa D
tidak bercabang. Netralisasi 1 g D yang membutuhkan 17,24 mL larutan KOH 0,500 M.
Senyawa C juga bisa terbentuk jika B mengalami termolisis lalu kemudian dioksidasi
dengan KMnO4.
a. Tentukan struktur A - D. (10)
b. Tuliskan persamaan setara reaksi oksidasi B dengan KMnO4. (3)
Kimia-FMIPA-ITB-Feb 2017 Hal 26 / 29
Nama: NIM:
Fakultas/Program Studi:
Pemanasan asam naftenat dengan amina E (C 40,0%, H 13,3%, N 46,7%) menghasilkan
produk industri penting. Jika A dan E dipanaskan dengan perbandingan 1: 1 pada 150-180
°C, dihasilkan senyawa F yang digunakan sebagai aditif untuk aspal jalan. Jika reaksi
yang sama dilakukan pada 190-220°C, dihasilkan senyawa G yang bisa digunakan
sebagai inhibitor korosi.
c. Gambarkan struktur E, F, G. Diketahui bahwa pembentukan F dan G disertai
dengan hilangnya berat masing-masing 6,0 dan 12,0%. (8)
E bereaksi dengan formaldehida berlebih dalam fase cair memberikan senyawa L.
Senyawa mengandung 3 jenis atom karbon. Jika reaksi dilakukan dalam fase gas,
diperoleh senyawa N yang merupakan dimer dari M dan memiliki dua jenis atom hidrogen,
dua jenis atom karbon dan satu jenis atom nitrogen.
d. Gambarkan struktur L dan N, mengingat bahwa senyawa ini tidak mengandung
ikatan rangkap. (5)
Kimia-FMIPA-ITB-Feb 2017 Hal 27 / 29
Nama: NIM:
Fakultas/Program Studi:
Soal 9 (20 poin)
Sickle cell anemia (SCA) adalah penyakit kelainan sel darah merah yang diturunkan
secara genetik. Terdapat kelainan pada hemoglobin penderita SCA yaitu berbentuk
seperti bulan sabit pada kondisi kekurangan oksigen.
a. Jika diketahui urutan pada template strand gen pengkode β-globin yang normal
adalah 5’-…….AGACTTCTCCTCAGGAGTCAGGTGCACCAT....-3’. Tuliskan
urutan nukleotida pada mRNA yang dihasilkan dari tahap transkripsi gen tersebut.
(2)
b. Pada penderita SCA, asam amino ketujuh berubah menjadi valin yang diakibatkan
oleh mutasi satu buah nukelotida pada gen pengkode β-globin. Tuliskan urutan
nukleotida pada template strand untuk gen pengkode β-globin penderita SCA. (2)
c. Perubahan asam amino tersebut menyebabkan hemoglobin penderita SCA
mengalami agregat dan berbentuk bulan sabit. Jenis interaksi apakah yang dapat
menyebabkan terbentuknya agregat. (2)
d. tRNA untuk valin diketahui memiliki urutan antikodon IAC. Tentukan jumlah ikatan
hidrogen yang dapat terbentuk antara antikodon tRNAval dengan kodon valin dari
mRNA penderita SCA. (2)
Valin adalah salah satu asam amino esensial. Diketahui senyawa A merupakan salah satu
prekursor biosintesis valin.
e. Pembakaran sempurna 5,28 g senyawa A dengan oksigen berlebih menghasilkan
8,80 g CO2 dan 2,88 g H2O. Tentukan rumus empiris senyawa A. (3)
Kimia-FMIPA-ITB-Feb 2017 Hal 28 / 29
Nama: NIM:
Fakultas/Program Studi:
f. Senyawa A merupakan asam monoprotik dengan pKa = 3,45. 5,39 g senyawa A
dilarutkan dalam 200 mL air menghasilkan pH larutan sebesar 2,07. Tentukan
rumus molekul senyawa A. (3)
g. Gambarkan 3 struktur yang mungkin untuk senyawa A (3)
h. Tentukan struktur senyawa A, jika diketahui reaksi biosintesis valin dari senyawa A
melibatkan 3 tahap reaksi yaitu reaksi reduksi, dehidrasi dan transaminasi (3)
☺ Selamat Bekerja ☺
Kimia-FMIPA-ITB-Feb 2017 Hal 29 / 29
Anda mungkin juga menyukai
- Kunci Jawaban Ujian 2 Kidas 1A 2018 v2Dokumen6 halamanKunci Jawaban Ujian 2 Kidas 1A 2018 v2Salsabillah Aulia HamdayantiBelum ada peringkat
- Solusi UAS KimiaDokumen8 halamanSolusi UAS Kimia20. Moh. Aqid Satria U.Belum ada peringkat
- Contoh Soal - Perpindahan KalorDokumen11 halamanContoh Soal - Perpindahan KalormitaBelum ada peringkat
- Tugas Kinetika Kimia (Kelompok 1)Dokumen5 halamanTugas Kinetika Kimia (Kelompok 1)kampus merdeka21Belum ada peringkat
- Prak. MKE 2 FIXDokumen34 halamanPrak. MKE 2 FIXdian ramadhanBelum ada peringkat
- Printout Tugas TermoDokumen4 halamanPrintout Tugas Termontahapa99Belum ada peringkat
- Penyelesaian Soal HidrologiDokumen7 halamanPenyelesaian Soal Hidrologiwidi gamingBelum ada peringkat
- Pembahasan TODokumen4 halamanPembahasan TOAna Yusriana AzzahraBelum ada peringkat
- Dinamika PopulasiDokumen3 halamanDinamika PopulasiMirawati SanusiBelum ada peringkat
- Dinamika PopulasiDokumen3 halamanDinamika PopulasiMirawati SanusiBelum ada peringkat
- Uas 2022Dokumen8 halamanUas 202220. Moh. Aqid Satria U.Belum ada peringkat
- Contoh SoalDokumen19 halamanContoh SoalDoni PurbayaBelum ada peringkat
- Termodinamika LiwangDokumen9 halamanTermodinamika LiwangLiwang Ulama UtamaBelum ada peringkat
- Ariful Ramadhan - 1907111671 - UTS TRK I Nomor 4Dokumen2 halamanAriful Ramadhan - 1907111671 - UTS TRK I Nomor 4Ariful RamadhanBelum ada peringkat
- 3 FaktorDokumen35 halaman3 Faktornurdin11Belum ada peringkat
- Kelompok 2 - Tugas TRK I Latihan Soal (Revisi)Dokumen7 halamanKelompok 2 - Tugas TRK I Latihan Soal (Revisi)TegarRochmad OddyPramantoBelum ada peringkat
- Presentation 1Dokumen18 halamanPresentation 1Diantri WahyuniBelum ada peringkat
- 1 - 12 - Soal Uts FisikaDokumen9 halaman1 - 12 - Soal Uts FisikaChandra Aris KusumaBelum ada peringkat
- Contoh Soal PetersenDokumen5 halamanContoh Soal PetersenIndah AdeliaBelum ada peringkat
- Latihan SoalDokumen37 halamanLatihan SoalIlham H. FahryBelum ada peringkat
- NamaDokumen11 halamanNamaHandika PrakosoBelum ada peringkat
- TUGAS 1 TERMODINAMIKA TEKNIK KIMIA - Daryanto Eka Putra - 4518044035Dokumen7 halamanTUGAS 1 TERMODINAMIKA TEKNIK KIMIA - Daryanto Eka Putra - 4518044035Daryanto Eka PutraBelum ada peringkat
- Salma Azzahra L - 21010119130138 - Tugas3 Response SpectrumDokumen25 halamanSalma Azzahra L - 21010119130138 - Tugas3 Response SpectrumSalma AzzahraBelum ada peringkat
- Nurul Izzah Tugas 5Dokumen2 halamanNurul Izzah Tugas 5Hj Hajjerah TombongBelum ada peringkat
- Moh Afrizal Ulul Albab - 22001082096 (UAS STATISTIK)Dokumen7 halamanMoh Afrizal Ulul Albab - 22001082096 (UAS STATISTIK)M Afrizal Ulul AlbabBelum ada peringkat
- Latihan 1 StatistikaDokumen9 halamanLatihan 1 Statistikashiva noviar auliaBelum ada peringkat
- Basic Atomic & Electron ConfigDokumen6 halamanBasic Atomic & Electron Configkecut gamingBelum ada peringkat
- Jawaban Soal KImfisDokumen49 halamanJawaban Soal KImfisRahmin KimBelum ada peringkat
- Melanie - F250121056 - TugasRekprosDokumen3 halamanMelanie - F250121056 - TugasRekprosmelanieBelum ada peringkat
- T1 - Nurul - Simple Random SamplingDokumen6 halamanT1 - Nurul - Simple Random SamplingNurul HafizaBelum ada peringkat
- Contoh Soal KimfissDokumen5 halamanContoh Soal KimfissMuhammad khairi ramadhan 021Belum ada peringkat
- Laporan PolarimeterDokumen13 halamanLaporan PolarimeterIlfianaBelum ada peringkat
- Soal KSN 2021 - Sesi2Dokumen12 halamanSoal KSN 2021 - Sesi2Carelin Anggun MarnesyaBelum ada peringkat
- Kertas 2 Pep Percubaan SPM SBP 2007Dokumen16 halamanKertas 2 Pep Percubaan SPM SBP 2007Shairah FauziBelum ada peringkat
- 20-66 Nurakhmal Fahmi (Orde Reaksi Metode Integral)Dokumen3 halaman20-66 Nurakhmal Fahmi (Orde Reaksi Metode Integral)66Nurakhmal FahmiBelum ada peringkat
- Pemodelan Juanli M. Taroreh - f44120090Dokumen4 halamanPemodelan Juanli M. Taroreh - f44120090Juanli m. TarorehBelum ada peringkat
- Pertemuan-14.2 - Stationing & VolumeDokumen18 halamanPertemuan-14.2 - Stationing & VolumeulfarahmiBelum ada peringkat
- Tabel Percobaan 2Dokumen6 halamanTabel Percobaan 2ADAM WILLIAM FERNANTA ,Belum ada peringkat
- KOL - Pertemuan 8 - Tugas (Kam, 09-17-20)Dokumen2 halamanKOL - Pertemuan 8 - Tugas (Kam, 09-17-20)Delia IlfaniBelum ada peringkat
- PolarimeterDokumen18 halamanPolarimeterAhmad Iqbal HafikhiBelum ada peringkat
- Tugas Besar: Program Studi D3 Teknik Kimia Jurusan Teknik Kimia Politeknik Negeri Bandung 2020Dokumen12 halamanTugas Besar: Program Studi D3 Teknik Kimia Jurusan Teknik Kimia Politeknik Negeri Bandung 2020PutriBelum ada peringkat
- Uas Termodinamika Teknik II 20182 Alhafid Azhimullah 201712062Dokumen6 halamanUas Termodinamika Teknik II 20182 Alhafid Azhimullah 201712062Gandhi SatriaBelum ada peringkat
- ContohDokumen43 halamanContohMuchamad Agiel RamadhanBelum ada peringkat
- Studi Kasus Integral TrapezoidalDokumen2 halamanStudi Kasus Integral TrapezoidalFebrico Bethran 2107134655Belum ada peringkat
- Tugas 2 Komputasi Fisika KhalidDokumen2 halamanTugas 2 Komputasi Fisika KhalidKhalid BagusBelum ada peringkat
- Modul 1 - Notasi Asimptotik (Minggu 5)Dokumen13 halamanModul 1 - Notasi Asimptotik (Minggu 5)Rendy DermawanBelum ada peringkat
- Sistem PeriodikDokumen25 halamanSistem PeriodikMuhamad Fiqri FebriantoBelum ada peringkat
- Efektivitas SiripDokumen4 halamanEfektivitas SiripGriffin NainggolanBelum ada peringkat
- UAS KimiaDokumen7 halamanUAS KimiaMariyatul QibtiyyahBelum ada peringkat
- Buat EdoDokumen2 halamanBuat Edorubenpintar07Belum ada peringkat
- Perhitungan ACC FinishDokumen51 halamanPerhitungan ACC FinishFelicia SamanthaBelum ada peringkat
- Pers C Pers Log Pers LNDokumen23 halamanPers C Pers Log Pers LNtamba tambaBelum ada peringkat
- StatikaDokumen24 halamanStatikananaBelum ada peringkat
- Uji Kalibrasi Termometer Digital: Max MinDokumen15 halamanUji Kalibrasi Termometer Digital: Max MinNovita DRBelum ada peringkat
- TUGAS - SOAL 10 - 19410052 - Muhamad Rafiyudin HDokumen4 halamanTUGAS - SOAL 10 - 19410052 - Muhamad Rafiyudin HArdianSaputra Maulana ThelarkdeferseBelum ada peringkat
- Jawaban Essay04Dokumen9 halamanJawaban Essay04Yusa FakhriBelum ada peringkat
- Luh Putu Rimas Putri Wahyuni 15 (No 1-2)Dokumen7 halamanLuh Putu Rimas Putri Wahyuni 15 (No 1-2)Putri WahyuniBelum ada peringkat
- Annisa RezkyDokumen22 halamanAnnisa RezkyJannah Abaya67% (3)
- Pembahasan Soal Simak UI Fisika 2010 Kode 504Dokumen2 halamanPembahasan Soal Simak UI Fisika 2010 Kode 504Arif_SyHoly_Ra_17190% (1)
- BAB 9 momentum dan impulsDokumen4 halamanBAB 9 momentum dan impulstriaoktavia456Belum ada peringkat
- Soal TO OSP Kimia 2023Dokumen11 halamanSoal TO OSP Kimia 2023triaoktavia456Belum ada peringkat
- SOAL - Tahap3 - ONMIPA-Kimia Anorganik 2018Dokumen8 halamanSOAL - Tahap3 - ONMIPA-Kimia Anorganik 2018triaoktavia456Belum ada peringkat
- SOAL - Tahap3 - ONMIPA-Kimia Fisik 2018Dokumen7 halamanSOAL - Tahap3 - ONMIPA-Kimia Fisik 2018triaoktavia456Belum ada peringkat
- Soal 2019 ITBDokumen21 halamanSoal 2019 ITBtriaoktavia456Belum ada peringkat
- Sejarah - Demokrasi TerpimpinDokumen2 halamanSejarah - Demokrasi Terpimpintriaoktavia456Belum ada peringkat
- Sejarah - Pergerakan NasionalDokumen2 halamanSejarah - Pergerakan Nasionaltriaoktavia456Belum ada peringkat
- Biologi - Sistem EkskresiDokumen3 halamanBiologi - Sistem Ekskresitriaoktavia456Belum ada peringkat
- Ekonomi - Pelaku EkonomiDokumen2 halamanEkonomi - Pelaku Ekonomitriaoktavia456Belum ada peringkat
- B. Indo - PidatoDokumen1 halamanB. Indo - Pidatotriaoktavia456Belum ada peringkat
- Surat Lamaran KerjaDokumen5 halamanSurat Lamaran Kerjatriaoktavia456Belum ada peringkat