0% menganggap dokumen ini bermanfaat (0 suara)
151 tayangan13 halamanTermokimia
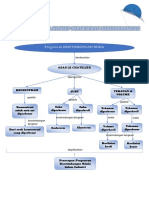
Termokimia membahas perubahan panas suatu reaksi kimia. Metode kalorimetri digunakan untuk menentukan perubahan entalpi reaksi dengan mengukur perubahan suhu saat reaksi kimia berlangsung antara larutan asam dan basa seperti HCl, HNO3 dan NaOH menggunakan kalorimeter.
Diunggah oleh
WULAN NURHIDAYATIHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online di Scribd
0% menganggap dokumen ini bermanfaat (0 suara)
151 tayangan13 halamanTermokimia
Termokimia membahas perubahan panas suatu reaksi kimia. Metode kalorimetri digunakan untuk menentukan perubahan entalpi reaksi dengan mengukur perubahan suhu saat reaksi kimia berlangsung antara larutan asam dan basa seperti HCl, HNO3 dan NaOH menggunakan kalorimeter.
Diunggah oleh
WULAN NURHIDAYATIHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online di Scribd