Preparat Darah Apus
Diunggah oleh
Max AndrewHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Preparat Darah Apus
Diunggah oleh
Max AndrewHak Cipta:
Format Tersedia
Preparat Darah Apus
BAB II
A. Alat :
a. Obyek glass.
b. Spreader / penggeser.
c. Pipet darah.
d. Pengaduk.
e. Gelas ukur.
f. Bak pengecatan.
g. Bak pengeringan.
h. Timer atau Jam.
B. Bahan :
a. Larutan Giemsa.
b. Methanol ( 90 % ) untuk fiksasi.
c. Darah vena atau kapiler.
C. Cara Kerja
a. Menyiapkan Obyek Glass yang bersih dan kering.
b. Meletakkan 1 tetes darah ( tidak melebihi 2 mm ) disisi kanan obyek
glass.
c. Sentuh tetesan darah dengan spreader.
d. Usahakan darah melebar dan merata pada ujung spreader.
e. Dorong spreader ke arah kiri dengan sudut 45
0
keringkan.
f. Kriteria Preparat yang baik :
1) Lebar dan panjangnya tidak memenuhi seluruh kaca benda
sehingga masih ada tempat untuk pemberian label.
2) Penebalannya tampak berangsur-angsur menipis dari kepala ke
arah ekor.
3) Ujung atau ekornya tidak berbentuk bendera robek.
4) Tidak berlubang-lubang karena lemak yang masih ada di atas
kaca benda.
5) Tidak terputus-putus karena gerakan gesekan yang ragu-ragu.
6) Tidak terlalu tebal (karena sudut penggeseran yang sangat
kecil) atau tidak terlalu tipis (karena sudut penggeserannya
sangat besar).
7) Pewarnaan yang baik (Budiwiyono, 2005)
g. Fiksasi preparat dengan menggunakan larutan Methanol 90% selama
2-10 menit.
h. Apabila preparat sudah mengering, genangi dengan larutan Giemsa
selama 20 menit.
i. Bilas dengan aquades/air yang mengalir dan keringkan.
BAB III
Hasil Preparat Darah Apus tidak masuk kedalam praktikum PK 1
BAB IV
Sediaan apus darah tepi dapat digunakan untuk berbagai macam
pemeriksaan, misalnya untuk mengevaluasi morfologi sel darah, memperkirakan
jumlah sel darah dan juga pemeriksaan identifikasi parasit. Untuk membuat
sediaan hapus darah tepi dibutuhkan teknik dan kemampuan. Karena kita harus
hati-hati dalam membuatnya.
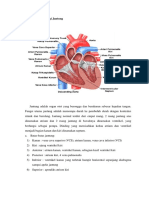
Darah adalah suatu suspensi sel dan fragmen sitoplasma yang dapat
dianggap sebagai jaringan pengikat dalam arti luas, karena pada dasarnya darah
terdiri atas unsur-unsur sel dan substansi interseluler yang berbentuk plasma.
Fungsi utama dari darah adalah mengangkut oksigen yang diperlukan oleh sel-sel
diseluruh tubuh. Darah manusia bisa dijadikan suatu preparat untuk diamati,
prosedur yang paling sering dilakukan dalam pembuatan preparat atau jaringan
sediaan histology atau irisan jaringan yang dapat dipelajari dengan bantuan
mikroskop cahaya. Di bawah mikroskop cahaya, jaringan diamati melalui berkas
cahaya yang menembus jaringan. Karena jaringan dan organ biasanya terlalu tebal
untuk ditembus cahaya, jaringan tersebut harus diiris menjadi lembaran-lembaran
tipis yang translusendan kemudian diletakkan diatas kaca objek sebelum jaringan
tersebut diperiksa (Anthony L, 2012).
Sediaan jaringan mikroskop yang ideal harus dibuat sedemikian rupa
sehingga jaringan pada sediaan tersebut tetap memiliki struktur dan komposisi
molekul yang sama seperti di tubuh. Namun pada prakteknya hal ini jarang dapat
dilakukan dan hampir selalu terdapat artefak, distorsi, dan hilangnya komponen-
komponen akibat proses persiapannya. Prosedur atau tahapan-tahapan yang
dilakukan dalam pembuatan sediaan atau preparat jaringan, yaitu :
1. Fiksasi
Jika sediaan yang permanen dikehendaki, jaringan harus difiksasi. Untuk
menghindari penceraan jaringan oleh enzim di dalam sel (autolisis) atau oleh
bakteri dan untuk mempertahankan struktur dan komponen molekul, potongan
organ harus segera diolah dengan tepat, sebelum atau secepat mungkin setelah
organ atau darah yang di ambil dari manusia dan hewan. Pengolahan fiksasi
ini dapat dilakukan secara kimiawi. Pada fiksasi kimiawi, jaringan biasanya
direndam dalam larutan yang menstabilkan atau dalam bahan pengikat yang
disebut bahan fiksasi. Karena bahan fiksasi memerlukan waktu untuk meresap
menjadi fragmen kecil sebelum difiksasi untuk mempermudah penetrasi bahan
fiksasi dan untuk menjamin pengawetan jaringan. Penyuntikan intravaskular
bahan fiksasi dapat dilakukan. Dalam hal ini, bahan fiksasi sampai dijaringan
secara cepat melali pembuluh darah sehingga fiksasi semakin baik (Anthony
L, 2012).
Salah satu bahan fiksasi terbaik untuk pemeriksaan mikroskop cahaya
rutin adalah larutan dapar isotonik dari formaldehid 37%. Proses kimiawi
yang terlibat dalam fiksasi tersebut sangat rumit dan tidak selalu dimengerti
dengan baik. Formaldehida dan glutaraldehida, yaitu bahan fiksasi lain yang
banyak dipakai, diketahui bereaksi dengan gugus amina (NH
2
) protein
jaringan. Pada glutaraldehida, kerja fiksasinya diperkuat karena zat ini
merupakan dialdehida yang dapat membentuk ikatan silang antar protein
(Anthony L, 2012).
Mengingat tingginya resolusi yang dihasilkan oleh mikroskop elektron
diperlukan lebih banyak perhatian dalam proses fiksasi untuk
mempertahankan rincian struktur ultranya. Untuk itu, prosedur fiksasi ganda
dengan menggunakan larutan dapar glutaraldehid, yang diikuti fiksasi kedua
dengan dapar osmium tetroksida, menjadi prosedur baku persiapan pengkajian
struktur yang halus, efek osmium tetroksida adalah mempertahankan dan
memulas lipid dan protein (Wildan, 2006).
2. Pemendaman dan Pemotongan
Jaringan umum nya dipendam dalam medium padat untuk memudahkan
pemotongan. Untuk memperoleh sediaan yang tipis dengan mikrotom,
jaringan harus diinfiltrasi sesudah fiksasi dengan substansi pemendaman yang
memberi sifat padat pada jaringan. Bahan pemendaman meliputi parafin, dan
damar plastik. Parafin digunakan secara rutin untuk mikroskop cahaya, damar
digunakan baik untuk mikroskop cahaya maupun elektron. Proses
pemendaman parafin, atau impregnasi jaringan, biasanya didahului oleh dua
tahap utama yaitu, pengeringan dan penjernihan. Air mula-mula dihilangkan
dari potongan jaringan yang ingin dipendam dengan cara merendamnya
berturut-turut secara bertahap dalam larutan etanol dan air, biasanya dari
etanol 70% sampai 100% (pengeringan). Etanol kemudian digantikan dengan
larutan yang dapat bercampur dengan alkohol dan media pemendaman.
Sewaktu jaringan diinfiltrasi oleh pelarut, jaringan biasanya menjadi jernih
(transparan). Setelah jaringan tersebut dipenuhi (terimpregnasi) dengan
larutan, jaringan dimasukkan dalam parapin cair di dalam oven, pada suhu 52-
60
. Panas akan menguapkan pelarut dalam jaringan dan celah jaringan yang
ditinggalkan akan diisi dengan parafin. Setelah dikeluarkan dari oven,
potongan jaringan dengan parafin didalamnya akan menjadi keras. Jaringan
yang akan dipendam dalam damar plastik juga menjadi kering dalam etanol
dan bergantung pada jenis damar yang dipakai dan kemudian diinfiltrasi
dengan larutan plastik (Anthony L, 2012).
Cara lain untuk menyediakan sediaan jaringan adalah pemaparan jaringan
dengan pembekuan cepat. Pada proses ini, jaringan difiksasi melalui
pembekuan dan sekaligus menjadi keras dan siap untuk dipotong. Pembekuan
jaringan juga efektif untuk studi histokimiawi enzim yang sangat sensitif atau
molekul kecil, karena pembekuan tidak seperti fiksasi dan tidak
menginaktifkan sebagian besar enzim (Victor p, 2005).
3. Pemulasan
Agar dapat di lihat dibawah mikroskop, sediaan harus di pulas atau
diwarnai karena kebanyakan jaringan tidak berwarna. Oleh sebab itu sejumlah
metode pemulasan jaringan telah dirancang agar berbagai unsur jaringan jelas
terlihat dan dapat dibedakan satu dengan yang lain. Pewarna memulas
berbagai unsur jaringan kurang lebih secara selektif. Kebanyakan pewarna ini
bersifat sebagai senyawa asam atau basa dan cenderung membantuk ikatan
elektrostatik (garam) dengan radikal yang dapat terionisasi di jaringan.
Komponen jaringan dengan muatan negatif (anionik) lebih mudah dipulas
dengan pewarna basa dan disebut basofilik, komponen kationik, seperti
protein dengan banyak gugus amino yang terionisasi, memiliki afinitas untuk
pewarna asam dan disebut asidofilik (Victor p, 2005).
Dari semua pewarna, kombinasi hematoksilin dan eosin (H & E) paling
banyak dipakai. Hematoksilin memulas DNA inti sel dan struktur asam
lainnya di sel menjadi biru. Sebaliknya, eosin memulas sitoplasma dan
kolagen menjadi merah muda. Banyak pewarna lain, seperti trikrom, dipakai
pada prosedur histology lainnya (Anthony L, 2012).
Pada banyak prosedur, struktur tertentu seperti inti sel menjadi terlabel,
tetapi bagian sel lain sering tidak nampak. Dalam hal ini pulasan balik
digunakan untuk memberikan informasi tambahan, pemulasan balik biasanya
adalah pewarna tunggal yang diberikan pada suatu sediaan dengan metode lain
untuk mempermudah pengenalan inti atau struktur lain (Victor p, 2005).
Lama keseluruhan prosedur mulai dari saat fiksasi sampai pengamatan
jaringan dibawah mikroskop cahaya dapat memerlukan waktu yang cukup
lama bergantung pada pembuatan jaringan tersebut. Kemudian sediaan yang
telah dibuat diletakkan pada kaca objek dengan media prekat (Anthony L,
2012).
DAFTAR PUSTAKA
Budiwiyono, Imam, 2005. Prinsip Pemeriksaan Preparat Apus Darah tepi.
Dalam: Imam BW
Eroschenko, Victor P, 2005. Atlas Histologi. Edisi 9. Jakarta. Buku Kedokteran
EGC
Mescher, Anthony L, 2012. Histologi Dasar JUNQUIERA. Jakarta. Buku
Kedokteran EGC
Yatim, Wildan, 2006. Histologi Dasar. Bandung. Pustaka Setia
Anda mungkin juga menyukai
- Manajemen NyeriDokumen7 halamanManajemen NyeriMax AndrewBelum ada peringkat
- KARDIOMIOPATI VENTRIKEL KANAN ARITMOGENIKDokumen81 halamanKARDIOMIOPATI VENTRIKEL KANAN ARITMOGENIKMax AndrewBelum ada peringkat
- WFFDokumen1 halamanWFFMax AndrewBelum ada peringkat
- 1Dokumen1 halaman1Max AndrewBelum ada peringkat
- Judul SysrevkuDokumen1 halamanJudul SysrevkuMax AndrewBelum ada peringkat
- HgkplomndgholpDokumen6 halamanHgkplomndgholpMax AndrewBelum ada peringkat
- Anatomi Dan Fisiologi JantungDokumen3 halamanAnatomi Dan Fisiologi JantungWilly H. B.Belum ada peringkat
- Konsumsi Ikan Dan Kacang-KacanganDokumen1 halamanKonsumsi Ikan Dan Kacang-KacanganMax AndrewBelum ada peringkat
- 6 JR 6Dokumen2 halaman6 JR 6Max AndrewBelum ada peringkat
- 6 WerwDokumen2 halaman6 WerwMax AndrewBelum ada peringkat
- EgwsgDokumen1 halamanEgwsgMax AndrewBelum ada peringkat
- 5Dokumen2 halaman5Max AndrewBelum ada peringkat
- FgsrgrgeprgkeprgokephkehlDokumen25 halamanFgsrgrgeprgkeprgokephkehlMax AndrewBelum ada peringkat
- 34235Dokumen2 halaman34235Max AndrewBelum ada peringkat
- Portofolio Muhammad Mahdi Alattas - TIA Suspek SNHDokumen23 halamanPortofolio Muhammad Mahdi Alattas - TIA Suspek SNHMax AndrewBelum ada peringkat
- Struktur Dan Fungsi Akar Pada Tanaman Dikotil DanDokumen3 halamanStruktur Dan Fungsi Akar Pada Tanaman Dikotil DanMax AndrewBelum ada peringkat
- Portofolio Muhammad Mahdi Alattas - CKBDokumen31 halamanPortofolio Muhammad Mahdi Alattas - CKBMax AndrewBelum ada peringkat
- Terjemahan Surat Bhs PrancisDokumen1 halamanTerjemahan Surat Bhs PrancisMax AndrewBelum ada peringkat
- Portofolio Muhammad Mahdi Alattas - CKBDokumen31 halamanPortofolio Muhammad Mahdi Alattas - CKBMax AndrewBelum ada peringkat
- Awsfegetwet 45Dokumen7 halamanAwsfegetwet 45Max AndrewBelum ada peringkat
- AwdawfawfDokumen12 halamanAwdawfawfMax AndrewBelum ada peringkat
- HshjsDokumen8 halamanHshjsAmalia An NidhaBelum ada peringkat
- AsdasdadaDokumen20 halamanAsdasdadaMax AndrewBelum ada peringkat
- FGFSFFHDokumen26 halamanFGFSFFHMax AndrewBelum ada peringkat
- AfagaegDokumen5 halamanAfagaegMax AndrewBelum ada peringkat
- Anatomi PBL 1 NSSDokumen16 halamanAnatomi PBL 1 NSSMax AndrewBelum ada peringkat
- AsdawdawfaegfrDokumen17 halamanAsdawdawfaegfrMax AndrewBelum ada peringkat
- SadasdfwafDokumen56 halamanSadasdfwafMax AndrewBelum ada peringkat
- Faktor Angiogenik JurnalDokumen3 halamanFaktor Angiogenik JurnalMax AndrewBelum ada peringkat
- DK1 Kelompok 5Dokumen13 halamanDK1 Kelompok 5Bayu Orlando ArdanaBelum ada peringkat