Experiment of Balmer Series FINAL
Diunggah oleh
Sathya NarayanaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Experiment of Balmer Series FINAL
Diunggah oleh
Sathya NarayanaHak Cipta:
Format Tersedia
MODUL PRAKTIKUM FISIKA MODERN
DERET BALMER
A.
TUJUAN PERCOBAAN
1. Mempelajari spektrum pancaran energi atom gas hidrogen
2. Menentukan nilai HHHdan H, serta panjang gelombang tiap
pancaran energi (menjelaskan perbedaan spektrum dari dua isotop atom
hidrogen)
3. Menentukan nilai tetapan Rydberg
4. Mempelajari sifat difraksi gelombang pada kisi (celah sempit)
B.
TEORI DASAR
Percobaan yang dilakukan oleh Johann Balmer (1885) melalui
pengamatan spektrum pancaran atom gas Hidrogen (H) menunjukan bahwa
energi atom tersebut adalah diskrit. Spektrum yang dipancarkan atom gas
hidrogen terurai menjadi beberapa spektrum garis berwarna cahaya tampak
seperti merah, hijau-biru dan ungu. Intensitas dan kedudukaan garis
spektrum yang teramati menunjukan karakteristik atom tersebut. Kedudukan
garis spektrum tersebut menyatakan suatu orde tertentu penguraian dan
berkaitan dengan panjang gelombangnya yang dinyatakan dengan
hubungan:
(
(1)
Dengan R adalah tetapan Rydberg (= 1.096776 . 107 m-1) dan n adalah
bilangan bulat (= 3, 4, 5, ...).
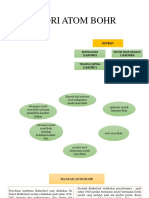
Dari teori atom Bohr, diketahui bahwa peristiwa pancaran atom gas
hidrogen merupakan hasil dari peristiwa eksitasi dan de-eksitasi
(transisi/perpindahan) elektron dari dari satu kulit atom ke kulit lainnya,
seperti yang ditunjukan pada Gambar 1.
Gambar 1 Model transisi elektron atom gas hidrogen menurut
model atom Bohr [5].
I-1
MODUL PRAKTIKUM FISIKA MODERN
DERET BALMER
Spektrum yang dipancarkan oleh transisi elektron dari kulit 3 ke 2,
dari kulit ke 4 ke 2 dan dari kulit ke 5 ke 2 dari atom hidrogen
dilambangkan masing-masing dengan H , H , H . Spektrum yang teramati
membentuk suatu deret seperti yang diilustrasikan oleh Gambar 2.
Gambar 2. Spektrum garis pancaran energi atom Hidrogen [1]
Secara percobaan spektrum garis yang teramati muncul dari peristiwa
difraksi dan interferensi setelah pancaran energi atom tersebut melewati
suatu celah sempit (kisi). Peristiwa difraksi oleh suatu kisi dinyatakan
dengan persamaan Bragg sbb:
(2)
dengan adalah jarak antar celah,
gelombang dan n = 1, 2, 3
C.
adalah sudut difraksi,
adalah panjang
TUGAS PENDAHULUAN
1. Atom hidrogen memiliki satu elektron. Jelaskan mekanisme peristiwa
eksitasi dan de-eksitasi serta bagaimana dan mengapa peristiwa tersebut
terjadi.
2. Spektrum pancaran dari suatu atom merupakan karakteristik atom
tersebut. Jelaskan.
3. Tentukan nilai panjang gelombang yang mungkin terlihat dari percobaan
ini dan perkirakan peristiwa ini terjadi akibat transisi elektron pada atom
hidrogen dari kulit mana ke kulit ke-2.
I-2
MODUL PRAKTIKUM FISIKA MODERN
DERET BALMER
4. Turunkan rumusan deret balmer berdasarkan teori atom Bohr.
5. Turunkan pola intensitas difraksi pancaran energi atom gas hidrogen
dengan menggunakan tetapan kisi yang berbeda. Jelaskan.
D.
PERALATAN DAN LANGKAH PERCOBAAN
Gambar 3 Susunan peralatan percobaan deret Balmer [4]
Peralatan yang diperlukan pada percobaan ini adalah
1.
2.
3.
4.
5.
6.
7.
Lampu hidrogen Balmer
Sumber tegangan
Kisi dengan tetapan 100 mm-1, 300 mm-1 dan 600 mm-1
Lensa pemokus cembung f = 50 mm dan f = 100 mm
Diafragma
Pemegang lensa, difragma dan kisi
Spektrometer
Langkah-langkah percobaan adalah sebagai berikut:
1. Periksa susunan peralatan percobaan deret Balmer seperti Gambar (3).
2. Saat mempersiapkan lampu Balmer, pastikan bahwa sumber tegangan
pada keadaan terputus (off).
3. Letakan kisi 100 mm-1 pada pemegang kisi diantara layar dan lensa f =
100 mm.
4. Nyalakan sumber tegangan sehingga lampu Balmer menyala.
5. Amati pola intensitas spektrum menggunakan spektrometer.
6. Kalibrasi kedudukan titik nol sehingga spektrometer mengangkap warna
merah pusat tepat pada titik nol
I-3
MODUL PRAKTIKUM FISIKA MODERN
DERET BALMER
7. Geser kedudukan spektrometer ke kiri atau ke kanan sehingga
teramatinya spektrum garis yang pertama yang masing-masing terdiri
dari warna-warna merah, hijau-biru dan ungu.
8. Geser lagi spektrometer untuk mendapatkan spektrum orde ke dua, tiga
dan seterusnya.
9. Catat sudut kedudukan spektrometer untuk masing-masing warna pada
setiap orde yang teramati.
10. Ulangi percobaan untuk kisi 300 mm-1 dan 600 mm-1.
E.
TUGAS AKHIR
1. Untuk tiap-tiap orde, hitung panjang gelombang untuk tiap garis yang
teramati. Bandingkan dengan nilai literatur. Jelaskan.
2. Hitung nilai tetapan Rydberg untuk setiap panjang gelombang yang
teramati. Badingkan dengan nilai tetapan R yang diperoleh dari grafik
persamaan:
).
a. Plot your values of as a function of . To a certain extent, the
role of this part of the analysis is to allow you to verify your
identification of the integer n, corresponding to the spectral lines you
observed. Determine a preliminary value of the Rydberg constant by
measuring the slope of your line.
b. Use the method of least squares to fit your data to a straight line.
Regard as the independent variable and as the dependent
variable. Determine the Rydberg constant.
c. Compare the values you obtain for wavelengths of the hydrogen lines
7
-1
and for R with the accepted values (R = 1.0971 x 10 m ).
3. Jelaskan perbedaan jumlah orde yang dapat teramati dengan perubahan
tetapan kisi.
4. Uraikan secara matematis perbedaan lebar garis spektrum masingmasing warna yang termati.
F.
DAFTAR PUSTAKA
1. Raymond A. Serway, Clement J. Moses and Curt A Moyer. (2005).
Modern physics, 3 rd edition, Belmont: Thomson learning, Inc.
2. Arthur Beiser. (1995). Concept of modern physics, 5th edition, New
York: McGraw Hill.
3. Tipler, P.A. (1992) Modern physics, New York: Worth publisher Inc.
4. Leybold instruction sheet: 451 13/14/41, Balmer lamp.
5. Leybold physics leaflet: P6.2.1.1. Atomic and nuclear physics: Atomic
shell Balmer series of hydrogen.
I-4
Anda mungkin juga menyukai
- Jurnal Spektrum AtomDokumen10 halamanJurnal Spektrum AtomFriska Wilfianda100% (3)
- FM4 Shofiyatul Mahmudah 18030224018Dokumen13 halamanFM4 Shofiyatul Mahmudah 18030224018Shellen SyaldhaBelum ada peringkat
- FM4 - Shofiyatul Mahmudah - 18030224018Dokumen13 halamanFM4 - Shofiyatul Mahmudah - 18030224018Shellen SyaldhaBelum ada peringkat
- Makalah Model Atom BohrDokumen16 halamanMakalah Model Atom BohrRifky Indra PrasetiaBelum ada peringkat
- PERCOBAAN BALMER Laprak AwalDokumen11 halamanPERCOBAAN BALMER Laprak AwalLuthfia KhofifaBelum ada peringkat
- Percobaan Spektroskopi Atom (Panduan-Tugas-Data)Dokumen5 halamanPercobaan Spektroskopi Atom (Panduan-Tugas-Data)Fadli SaputroBelum ada peringkat
- Spektrum Garis Berbagai Jenis AtomDokumen8 halamanSpektrum Garis Berbagai Jenis AtomFitri RamadhaniBelum ada peringkat
- Laporan Atom SpectraDokumen11 halamanLaporan Atom SpectraNurhadyatiBelum ada peringkat
- Fatona Tulmulia (Spektrum Atom Hidrogen)Dokumen8 halamanFatona Tulmulia (Spektrum Atom Hidrogen)Nia WatiBelum ada peringkat
- Kuliah 4Dokumen68 halamanKuliah 4Shofa MarwahhBelum ada peringkat
- Praktikum Spektrum AtomDokumen13 halamanPraktikum Spektrum AtomDoni BaruBelum ada peringkat
- Jurnal Unit 4 FixDokumen12 halamanJurnal Unit 4 FixshadiqBelum ada peringkat
- Muhammad Nuruzzaman Asshidiq - A1C315011..Dokumen4 halamanMuhammad Nuruzzaman Asshidiq - A1C315011..atik sofiahBelum ada peringkat
- Latihan Soal KD 2Dokumen1 halamanLatihan Soal KD 2Umi KhasanahBelum ada peringkat
- Eksperimen Fisika Modern - Kel 3-Spektrum AtomDokumen12 halamanEksperimen Fisika Modern - Kel 3-Spektrum AtomNadaBelum ada peringkat
- Modul Praktikum Fisika Modern - 2014 Esmar PDFDokumen27 halamanModul Praktikum Fisika Modern - 2014 Esmar PDFjulia jasminBelum ada peringkat
- Fisika AtomDokumen22 halamanFisika AtomSitti Raodah NurulJannah100% (1)
- Deret Balmer Pada Spektrum HidrogenDokumen5 halamanDeret Balmer Pada Spektrum HidrogenressamuhrifahBelum ada peringkat
- Spektroskopi Atom HidrogenDokumen4 halamanSpektroskopi Atom HidrogenM Sidik Augi Rahmat100% (1)
- Soal Ujian I SikDokumen6 halamanSoal Ujian I SikAldyan FaturohmanBelum ada peringkat
- Makalah Balmer RevisiDokumen19 halamanMakalah Balmer RevisiSundus MirrotinBelum ada peringkat
- Penuntun Praktikum Fisika LanjutDokumen17 halamanPenuntun Praktikum Fisika Lanjuthelena mogiBelum ada peringkat
- SpektrometerDokumen17 halamanSpektrometerNur HalizahBelum ada peringkat
- Dasar-Dasar Teori Kuantum KlasikDokumen6 halamanDasar-Dasar Teori Kuantum KlasikmeikrismahariyantoBelum ada peringkat
- 5.deutron - Spektrum Atom BohrDokumen15 halaman5.deutron - Spektrum Atom BohrNur FauziyahBelum ada peringkat
- Bab 1 Spektrum HidrogenDokumen19 halamanBab 1 Spektrum HidrogenMega AgustinaBelum ada peringkat
- Pendahuluan Spektrum Garis AtomDokumen3 halamanPendahuluan Spektrum Garis Atomanon_459893309Belum ada peringkat
- Dasar2 Teori Kuantum KlasikDokumen2 halamanDasar2 Teori Kuantum KlasikmuhammadnazarsyahidaBelum ada peringkat
- Menentukan Konstanta RydbergDokumen19 halamanMenentukan Konstanta RydbergMade LA PakpahanBelum ada peringkat
- Materi Kuliah STRUKTUR ATOMDokumen41 halamanMateri Kuliah STRUKTUR ATOMarya-mrunBelum ada peringkat
- Bab 3 Quantum OptikDokumen34 halamanBab 3 Quantum OptikSitiNurKhotimahBelum ada peringkat
- PENDAHULUAN BalmerDokumen16 halamanPENDAHULUAN BalmerKarinBelum ada peringkat
- Paper Deret Balmer - AlbertDokumen4 halamanPaper Deret Balmer - AlbertAlbertAgungYohanesHutapeaBelum ada peringkat
- Deret BalmerDokumen10 halamanDeret BalmerPak DeeBelum ada peringkat
- Konstanta RydbergDokumen14 halamanKonstanta RydbergM Syafrizal SahputraBelum ada peringkat
- Praktikum 7 (Deret Balmer)Dokumen11 halamanPraktikum 7 (Deret Balmer)Elza Anisa Suwandi IIBelum ada peringkat
- Deret BalmerDokumen7 halamanDeret BalmerGerry AnandaBelum ada peringkat
- Fisika Atom Materi 3Dokumen9 halamanFisika Atom Materi 3akuhayuBelum ada peringkat
- Deret Balmer SiskaDokumen13 halamanDeret Balmer Siskasiju5Belum ada peringkat
- Deret Balmer Pada Spektrum HidrogenDokumen4 halamanDeret Balmer Pada Spektrum HidrogenArcida GautamaBelum ada peringkat
- Modul 1 (Spektrum Atom)Dokumen10 halamanModul 1 (Spektrum Atom)sonya_rahayuBelum ada peringkat
- Spektrum Garis FG C Punya Mila FixDokumen5 halamanSpektrum Garis FG C Punya Mila FixAvishena PranandaBelum ada peringkat
- Bagian Riska - Spektrum Atom HidrogenDokumen11 halamanBagian Riska - Spektrum Atom HidrogenRiskaBelum ada peringkat
- ID Karakterisasi Gaas Dengan PhotoluminesceDokumen16 halamanID Karakterisasi Gaas Dengan Photoluminescetara amalyaBelum ada peringkat
- Fadli Handoyo - 1306620012 - Laporan Akhir (Percobaan Deret Balmer)Dokumen50 halamanFadli Handoyo - 1306620012 - Laporan Akhir (Percobaan Deret Balmer)fadli handoyoBelum ada peringkat
- Struktur AtomDokumen35 halamanStruktur AtomIra WariadiBelum ada peringkat
- Difraksi ElektronDokumen4 halamanDifraksi ElektronYuni Anggiya NasutionBelum ada peringkat
- Tugas 2 Sem 1 2014 2015Dokumen5 halamanTugas 2 Sem 1 2014 2015small butterflyBelum ada peringkat
- Deret Balmer Pada Spektrum Hidrogen PDFDokumen3 halamanDeret Balmer Pada Spektrum Hidrogen PDFRidWhanMaulanaPoetra-UchihaNamikazeBelum ada peringkat