BAB II (-O-)
Diunggah oleh
Joe DavisDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
BAB II (-O-)
Diunggah oleh
Joe DavisHak Cipta:
Format Tersedia
6
BAB II
TINJAUAN PUSTAKA
2.1
Fisiologi Klinis Hati
2.1.1
Anatomi Hati
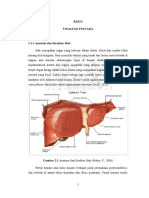
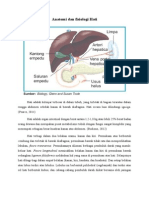
Hati adalah organ terbesar dalam tubuh manusia, beratnya sekitar 1,6 kg
pada pria dan 1,4 kg pada wanita, atau sekitar 2% dari berat badan orang dewasa.
Letaknya di bawah diafragma pada sisi kanan atas perut, bagian anterior dan
posterior dilindungi oleh tulang rusuk. Hati terbagi dalam dua belahan utama,
kanan dan kiri (North-Lewis, 2008). Permukaan hati halus, mengkilat dan
berwarna merah kecoklatan. Pada permukaan atas berbentuk cembung dan
terletak di bawah diafragma, sedangkan permukaan bawah tidak rata dan
memperlihatkan lekukan fisura transversus. Di bawah permukaan ini terdapat
ginjal kanan, gaster, pankreas dan usus (Pearce, 2002). Anatomi hati dapat dilihat
seperti gambar 2.1 di bawah ini.
Gambar 2.1 Anatomi hati (Glenn and Susan Tole, 2008)
Hati terdiri atas dua lobus, yaitu lobus kanan dan kiri. Lobus kanan dibagi
menjadi segmen anterior dan posterior oleh fisura segmentalis kanan yang tidak
terlihat dari luar. Lobus kiri dibagi menjadi segmen medial dan lateral oleh
ligament falsiformis yang terlihat dari luar. Di hepar, ligament falsiformis
melintasi diafragma sampai ke dinding abdomen bagian depan. Permukaan hati
dilapisi oleh peritoneum viseralis, kecuali daerah kecil pada permukaan posterior
yang melekat langsung pada diafragma. Beberapa ligament yang berada dalam
peritoneum membantu menyokong hati. Di bawah peritoneum terdapat jaringan
ikat padat yang disebut sebagai kapsula Glisson, yang melapisi seluruh organ.
Bagian paling tebal kapsula ini terdapat pada portal hepatis yang membentuk
rangka untuk cabang vena portal, arteri hepatika dan saluran empedu. Portal
hepatis adalah fisura pada hati tempat masuknya vena portal dan arteri hepatika
serta tempat keluarnya duktus hepatika (Lindseth, 2005).
2.1.2
Struktur Mikroskopik Hati
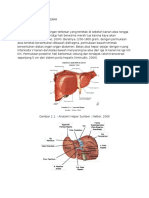
Setiap lobus hati terbagi menjadi struktur-struktur yang disebut sebagai
lobulus, yang merupakan unit mikroskopik dan fungsional. Setiap lobulus
merupakan badan heksagonal yang terdiri atas lempengan-lempengan sel hati
(hepatosit) yang berbentuk kubus, tersusun radial mengelilingi vena sentralis yang
mengalirkan darah dari lobulus. Pada setiap sisi lobulus terdapat cabang vena
portal, arteri hepatika dan kanalikuli empedu (Baradero et al, 2005).
Di antara hepatosit terdapat kapiler-kapiler yang disebut sebagai sinusoid,
yang merupakan cabang vena portal dan arteri hepatika. Tidak seperti kapiler lain,
sinusoid dibatasi oleh sel fagositik atau sel kupffer. Sel kupffer merupakan sistem
monosit-makrofag, dan fungsi utamanya adalah menelan eritrosit, leukosit yang
telah mati, mikroorganisme dan benda asing yang masuk ke dalam hati bersama
darah. Sejumlah 50% dari semua makrofag dalam hati adalah sel kupffer,
sehingga hati merupakan salah satu organ penting dalam pertahanan melawan
invasi bakteri dan agen toksik (Lindseth, 2005).
Sel-sel hati menghasilkan empedu kemudian dialirkan melalui kanalikuli.
Kanalikuli merupakan saluran-saluran halus yang nantinya bergabung menjadi
saluran besar, yaitu duktus hepatikus kiri dan kanan. Duktus hepatikus kiri dan
kanan bergabung menjadi duktus hepatikus komunis. Duktus hepatikus komunis
bergabung kemudian menjadi duktus sistikus. Melalui duktus sistikus ini, empedu
masuk ke dalam vesika felea. Empedu juga keluar dari vesika felea melalui duktus
sistikus kemudian ke duktus koledukus (common bile duct). Duktus koledukus ini
bermuara ke dalam duodenum. Empedu yang terdapat pada duodenum akan
membantu dalam pencernaan dan absorpsi lemak (Baradero et al, 2005).
Struktur yang mengandung vena porta, arteri hepatika dan kanalikuli
empedu disebut juga sebagai triad porta, seperti yang terlihat pada gambar 2.2
berikut ini;
Gambar 2.2 Histologi Hati (Gartner, P. Leslie and James L. Hiatt, 2007)
Di dalam sinusoidal hati terdapat sel stellanta yang berguna untuk
menyimpan retinoid, yang merupakan derivat vitamin A. Melalui proses inflamsi
yang khas dan kompleks, sel stellanta bertransformasi menjadi miofibroblast yang
mampu mensekresi kolagen ke ruang sinusoidal dan mengatur tekanan portal
dengan cara berkontraksi ataupun relaksasi. Sel stellanta dapat juga terlibat dalam
proses fibrosis pada hati (Tsao, 2003).
2.1.3
Sirkulasi Hati
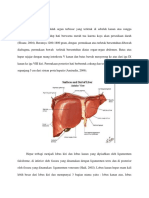
Arteri hepatika, yang keluar dari aorta memberikan seperlima darahnya
kepada hati, darah ini mempunyai kejenuhan oksigen 95% sampai 100%. Vena
portal yang terbentuk dari vena linealis dan vena mesentrika superior,
mengantarkan empat perlima darahnya ke hati, darah ini mempunyai kejenuhan
oksigen hanya 70% sebab beberapa oksigen telah diambil oleh limpa dan usus.
Darah vena portal ini membawa ke hati zat makanan yang telah diabsorpsi oleh
mukosa usus halus (Pearce, 2002). Vena portal bersifat unik karena terletak di
antara dua kapiler, yang satu terletak dalam hati dan yang lainnya dalam saluran
cerna. Saat memasuki hati, vena portal bercabang-cabang yang menepel
melingkari lobulus hati. Cabang-cabang ini kemudian mempercabangkan venavena interlobularis yang melintasi lobulus-lobulus. Vena-vena ini kemudian
membentuk sinusoid yang berjalan di antara lempengan hepatosit dan bermuara
dalam vena sentralis. Vena sentralis dari beberapa lobulus bersatu membentuk
vena sublobularis yang selanjutnya menyatu dan membentuk vena hepatika.
Cabang-cabang terhalus arteri hepatika juga mengalirkan darahnya ke dalam
sinusoid, sehingga terjadi campuran darah arteri dari arteri hepatika dan darah
vena dari vena portal (Lindseth, 2005).
Gambar 2.3 Sistem Portal Hepatik (Lindseth, 2005)
Darah dibawa dari lambung, usus, limpa, dan pankreas ke dalam sinusoid
hati. Vena hepatika mengalirkan darah ke vena cava inferior. Tempat anastomosis
yang jelas antara sirkulasi hepatik dan sirkulasi sistemik adalah melalui vena
esofagea (cabang portal) yang beranastomosis dengan vena azigos (cabang
sistemik); vena paraumbilikalis dalam ligamentum teres hepatis berasal dari
cabang kiri vena portal dan berhubungan dengan vena-vena superfisial dinding
anterior abdomen (cabang sistemik) pada daerah umbilikus; vena rektalis superior
10
atau vena hemoroidalis (cabang portal) beranastomosis dengan vena rektalis
media dan inferior (cabang siatemik); cabang-cabang portal yang menuju ke usus,
pankreas dan hati beranastomisis dengan vena diafragmatika, vena renalis, dan
lumbalis (cabang sistemik tidak terlihat). Pada hipertensi portal dan penyakit hati
kronis, darah dapat mengalir balik dalam vena-vena ini dan akan dipirau di sekitar
hati melalui tempat-tempat anastomosis (Lindseth, 2005). Sirkulasi hati dapat
terlihat seperti gambar 2.3 di atas.
Pada hati yang normal volume besar darah mengalir tanpa gangguan, tapi
di berbagai penyakit hati tahanan pembuluh darah akan meningkat dan kecepatan
darah akan terhambat. Sirosis hati akan mengakibatkan sinusoid akan menyempit
dan menjadi terluka karena peningkatan perlawanan terhadap aliran darah
sehingga tekanan pada vena portal naik atau terjadinya hipertensi portal.
Peningkatan tekanan portal akan menyebabkan pembentukan varises dan asites,
yang akhirnya dapat menimbulkan sindrom hepatorenal. Memperlambat aliran
vena portal juga meningkatkan risiko dalam thrombosis vena porta, yang mungkin
menambah parah dalam disfungsi hati (North-Lewis, 2008).
2.1.4
Fungsi hati
Fungsi hati berkaitan erat dengan proses metabolik tubuh, khususnya
mengenai pengaruh atas makanan dan darah. Dalam tabel berikut akan dibahas
tentang fungsi utama hati (Baradero et al, 2005; Lindseth, 2005; North-Lewis,
2008).
Table II.1 Fungsi Utama Hati
Fungsi
Pembentukan dan Ekskresi
Keterangan
Garam empedu penting untuk pencernaan dan absorpsi lemak serta
Empedu
Metabolisme Garam dan Pigmen
vitamin larut lemak di dalam usus
Bilirubin (pigmen empedu utama)
Empedu
metabolisme pemecahan eritrosit yang sudah tua, proses konjugasi
Metabolisme Karbohidrat
berlangsung dalam hati dan diekskresikan ke dalam empedu
Hati berperan penting dalam mempertahankan kadar glukosa darah
Glukogenesis
normal dan menyediakan energi untuk tubuh
Monosakarida dari usus halus diubah menjadi glikogen dan disimpan
Glikogenolisis
dalam hati
Dari depot glikogen ini glukosa dilepaskan secara konstan ke dalam
merupakan
hasil
akhir
darah
Lanjutan Tabel II.1 Fungsi Utama Hati
Glukoneogenesis
Hati juga mampu mensintesa glukosa dari protein
11
Metabolisme, Sintesis dan Penyimpanan Protein
dan lemak
Protein serum yang disintesis oleh hati adalah
albumin, globulin alfa dan beta (gama globulin
tidak). Faktor pembekuan darah yang disintesis oleh
hati adalah fibrinogen (I), protrombin (II) dan faktor
V, VII, IX, dan X. Vitamin K merupakan faktor yang
penting dalam sintesis semua faktor ini, kecuali
Pembentukan Urea
faktor V dan disimpan dalam bentuk asam amino.
Urea dibentuk semata-mata dalam hati dari ammonia
(NH3), kemudian dieksresi dalam urin dan feses. NH 3
dibentuk dari deaminasi asam amino dan kerja
Metabolisme Lemak
bakteri usus terhadap asam amino.
Hidrolisis trigliserida, kolesterol, fosfolipid, dan
lipoprotein (diabsorbsi dari usus) menjadi asam
Sintesis Kolesterol dan Penimbunan Lemak
lemak dan gliserol.
Hati memegang peran
utama
dalam
sintesis
kolesterol, sebagian besar diekskresi dalam empedu
Penimbun Vitamin dan Mineral
sebagai kolesterol atau asam kolat.
Vitamin larut lemak (A,D,E,K) disimpan dalam hati,
Metabolisme Steroid
juga vitamin B12, tembaga serta besi.
Hati menginaktifkan dan mensekresi aldosterone,
glukokortikoid,
Detoksifikasi
estrogen,
progesterone
dan
testosteron.
Hati bertanggung jawab atas biotransformasi zat-zat
berbahaya (misalnya obat) menjadi zat-zat yang tidak
Gudang Darah dan Filtrasi
berbahaya yang kemudian diekskresi melalui ginjal.
Sinusoid hati merupakan sirkulasi darah yang
mengalir kembali dari vena cava (gagal jantung
kanan), kerja fagositik sel kupffer membuang bakteri
dan debris dari darah.
2.2 Tinjauan Sirosis Hati
2.2.1
Definisi
Kata sirosis pertama kali dikemukakan oleh Laennac pada tahun 1826
yang diambil dari bahasa Greek (latin) Kirrhos yang artinya orange atau warna
kuning jingga pada hati (Stragand et al, 2008). Sirosis hati merupakan penyakit
hati menahun yang ditandai dengan proses peradangan, nekrosis sel hati, usaha
regenerasi dan penambahan jaringan ikat difus dengan terbentuknya nodul yang
mengganggu susunan lobulus hati. Nodul-nodul ini dapat berukuran kecil
(mikronodular) atau besar (makronodular) (Tarigan, 2004).
Hati yang sehat mampu meregenerasi sebagian besar selnya sendiri.
Ketika menjadi rusak akibat sirosis stadium akhir, hati tidak bisa lagi secara
12
efektif menggantikan sel yang rusak. Prognosis yang buruk pada sirosis hati
terjadi karena tingginya insiden komplikasi, termasuk dekompensasi fungsi hati
(asites, ikterus, ensefalopati, hipertensi portal dan perdarahan varises), dan
pengembangan kearah hepato cellular carcinoma (Minino et al, 2008; GuangChen et al 2012).
2.2.2
Epidemologi
Sirosis termasuk 10 besar penyebab kematian di dunia barat . Meskipun
terutama disebabkan oleh penyalahgunaan alkohol (Robbins, 2007). Pada tahun
2000 di Amerika Serikat sirosis menjadi penyebab kematian ke-12. Penyakit liver
tersebut terjadi pada 3.6 per 1000 orang dewasa di Amerika Serikat dan membawa
26.000 lebih kematian (Stragand et al, 2008). Data prevalensi sirosis hati di
Indonesia belum ada, hanya laporan-laporan dari beberapa pusat pendidikan saja.
Dari data tahun 2004 di RS Dr. Sardjito Jogyakarta, jumlah pasien sirosis hati
berkisar 4,1% dari pasien yang dirawat di bagian penyakit dalam dalam kurun
waktu 1 tahun. Di medan dalam kurun waktu 4 tahun dari 19.914 pasien yang
dirawat di bagian penyakit dalam, didapatkan 1.128 pasien penyakit hati (5%)
(Nurjanah, 2006). Pada pengamatan secara klinis dijumpai 819 pasien sirosis hati
(72,7%). Perbandingan pria dan wanita 2,2:1. Dari hasil biopsi ternyata kekerapan
sirosis mikronodular dan makronodular hampir sama (1,6:1,3) (Tarigan, 2004).
2.2.3
Etiologi
Pemicu utama yang mengakibatkan sirosis hati adalah peradangan yang
menyebabkan nekrosis dan fibrogenesis. Apapun penyebab kerusakannya,
gambaran akhir umumnya sama, dalam kaitan ini, maka dapat disebutkan hal-hal
yang menjadi penyebab dari sirosis, antara lain
2.2.3.1 Hepatitis A Virus (HAV)
Termasuk dalam klasifikasi virus dengan transmisi secara enterik. Tidak
memiliki selubung dan tahan terhadap cairan empedu. Virus ini ditemukan
didalam
tinja. Berbentuk kubus simetrik dengan diameter 2728 nm, untai
13
tunggal (single stranded), molekul RNA linier: 7,5 termasuk picornavirus,
subklasifikasi hepatovirus. Menginfeksi dan bereplikasi pada primata nonmanusia dan galur sel manusia. Masa inkubasi 15-50 hari, (rata-rata 30 hari).
Tersebar di seluruh dunia dengan endemisitas yang tinggi terdapat di negaranegara berkembang. Virus ini diserap melalui usus kecil dan diangkut oleh aliran
darah portal atau yang lebih sering melalui empedu dan masuk ke feses. Penularan
terjadi melalui makanan atau minuman yang terkontaminasi feses penderita
hepatitis A, misalnya sayuran, buah-buahan yang tidak dikelola atau dimasak
sempurna (DEPKES, 2007)
2.2.3.2 Hepatitis B Virus (HBV)
Infeksi kronis hepatitis virus jenis B dan jenis non A non B, dijelaskan
melalui lima tahap berikut namun belum tentu berurutan dan durasi. Tahap
pertama yaitu tahap toleran imun ditandai dengan HBeAg positif, tingginya
tingkat replikasi virus (HBV DNA serum tinggi) , transaminase normal, minimal
atau tidak ada tanda peradangan hati serta tidak ada atau berkembang dengan
lambat kearah fibrosis. Tahap kedua, tahap pembersihan imun ditandai dengan
HBeAg positif, tetapi tingkat replikasi virus lebih rendah, karena adanya antibodi
yang dinamakan Anti-Hbe. Tahap ketiga, karier HBV tidak aktif atau dalam
keadaan laten (fase kontrol kekebalan tubuh) akibat adanya anti-HBe yang
ditandai dengan tingkat HBV DNA serum sangat rendah (<2 000 IU / ml) atau
tidak terdeteksi dan transaminase normal. Tahap keepat terjadinya substitusi
nukleotida dalam prainti atau daerah inti dari hasil genom HBV dalam varian
HBV yang tidak mampu untuk mengekspresikan HBeAg, atau melakukannya
pada tingkat yang sangat rendah. Fase ini ditandai dengan HBeAg negatif,
fluktuasi transaminase dan kadar HBV DNA, inflammation yang signifikan dan
fibrosis progresif. Rendahnya tingkat hepatitis B immunoglobulin M merangsang
keluarnya antibodi anti-HBc IgM yang dapat dideteksi. Tahap kelima, Infeksi
HBV adalah istilah yang digunakan untuk menggambarkan kasus-kasus di mana
pasien telah membersihkan antigen tetapi memiliki deteksi plasma HBV DNA.
Serologisnya adalah HBsAg negatif, antibodi permukaan hepatitis B (HbsAg)
positif dan anti-HBc positif (Spearman et al, 2013).
14
2.2.3.3 Hepatitis C Virus (HCV)
HCV disebabkan oleh virus RNA untaian tunggal. Pasien yang terinfeksi
membentuk antibodi anti-HCV yang dapat dideteksi dalam serum melalui
immunoassay. HCV menimbulkan lebih dari 90% kasus hepatitis akibat transfusi
produk darah di amerika serikat. Penyakit ini juga terjadi akibat penyalahgunaan
obat, penerima transplant, dan di dalam unit dialisis ginjal. Masa inkubasi
bervariasi antara 2 minggu sampai 6 bulan. HCV mempunyai gambaran klinis
yang hampir sama dengan HBV, kecuali insiden hepatitis kronik yang lebih tinggi
pada hepatitis C, yang terjadi pada 50% pasien yang terinfeksi (Chandrasoma dan
Clive R. Taylor, 2005).
2.2.3.4 Alkohol
Alkohol menjadi salah satu penyebab sirosis hati dengan hipertensi portal
dengan mekanisme sebagai berikut, etanol diabsorbsi dengan baik di usus halus,
kemudian akan dimetabolisme oleh ADH (Gastric Alcohol Dehydrogenase)
membentuk asetaldehid yang merupakan molekul sangat reaktif. Pada akhirnya,
asetaldehid mengalami
dehidrogenasi menjadi asetat aldehida (ALDH).
Asetaldehida memediasi kerusakan hepatosit sehingga oksigen reaktif akan
mengaktifasi sel kuffer. Lalu sitokin diproduksi untuk mengaktivasi sel stellata.
Sel stellata memproduksi kolagen serta matriks ekstraseluler berlebih, kemudian
tumbuh menjadi jaringan ikat, hepatosit akan menyusut sedangkan produksi
kolagen meningkat. Pada akhirnya terjadi perubahan hepatosit dan berkembang
menjadi sirosis hati beserta komplikasinya, salah satu komplikasinya adalah
hipertensi portal (Fauci et al, 2008).
2.2.3.5 Penyumbatan aliran empedu
Pada keadaan ini terjadi sumbatan (obstruksi) total atau parsial dari aliran
empedu dan komponen-komponennya dari mulai sel hati (kanalikulus) sampai ke
duodenum. Jika terjadi obstruktif berkepanjangan dapat menimbulkan kerusakan
15
struktur hati terutama hepatosit yang akan diikuti dengan menurunnya fungsi
sintesis hati khususnya sintesis albumin. Kadar albumin plasma dapat menurun
jika sudah terjadi keadaan kerusakan hati lanjut (sirosis bilier). Hal ini terjadi
karena pada keadaan obstruktif yang lebih lanjut akan terjadi kerusakan hati yaitu
nekrosis hepatoselular, proliferasi sel-sel epitelial duktus biliaris, aktivasi sel-sel
stellanta yang diikuti dengan fibrosis hati (Nuanza, 2013).
2.2.3.6 Infeksi parasit yang kronis yaitu skistosomiasis
Schistosomiasis hati merupakan hasil dari granulomatosa host. Mediasi
sel, ketika timbulnya sistem kekebalan tubuh terhadap telur antigen dari S.
Mansoni, yang berkembang kearah fibrosis irreversibel dan mengakibatkan
hipertensi portal yang parah. Telur tetap dapat hidup di hati selama 3 minggu.
Terutama, telur yang menyebabkan seseorang mengaktivasi sel T helper tipe 1
(Th-1) untuk menanggapi telur antigen. Namun, hal ini biasanya berkembang
untuk mengaktivasi Th-2 yang dominan pada sistem kekebalan tubuh terhadap
antigen telur. Kemudian terjadi rekrutmen eosinofil, pembentukan granuloma dan
fibrogenesis hati (Elbaz and Gamal, 2012).
2.2.4
Klasifikasi Sirosis
Secara mikroskopik sirosis hati umumya dibagi atas tiga bagian yaitu
golongan mikronodular, makronodular dan sirosis biliaris (Bradely et al, 2005).
2.2.4.1 Sirosis Mikronodular
Sirosis Mikronodular disebut juga sebagai sirosis portal ditandai dengan
pita fibrotik tebal teratur yang menghubungkan pembuluh portal dengan vena
hepatika, dan disertai nodul-nodul regeneratif kecil. Hati pada awalnya membesar
dengan tepi rata namun akhirnya mengkerut akibat fibrosis progresif. Seringkali
disebabkan oleh alkohol.
2.2.4.2 Sirosis makronodular
Sirosis makronodular atau disebut juga sirosis pascanekrotik lebih jarang
ditemukan dan ditandai oleh pita fibrosis yang kasar dan tidak teratur dan
hilangnya struktur normal serta nodul regenerative yang besar. Jenis ini diyakini
16
biasanya terjadi setelah hepatitis virus disertai nekrosis yang luas. Hati membesar
dan bentuknya sangat tidak teratur akibat besarnya nodul.
2.2.4.3 Sirosis Biliaris
Sirosis Biliaris lebih jarang ditandai dengan fibrosis di sekitar duktus
intrahepatik yang melebar. Bisa terjadi setelah kolangitis kronis dan obstruksi
bilier atau idiopatik (primer).
2.2.5 Patogenesis
Peningkatan atau perubahan sintesis kolagen dan jaringan penghubung
yang lain atau komponen membran basal dari matriks seluler terlibat dalam
pembentukan fibrosis liver dan patogenesis dari sirosis (Lingappa & Nguyen,
2006). Fibrosis liver sering muncul dalam 3 tahap (i) sebagai respon imun, (ii)
sebagai bagian dari proses penyembuhan luka, (iii) pada respon terhadap agen
fibrinogenesis. Hepatitis B virus (HBV) dan spesies Schistosoma adalah contoh
agen penyebab terjadinya fibrosis dan proses imunologis. Karbon tetraklorida
(CCl4) dan hepatitis A yang menyerang dan membunuh hepatosit secara langsung
adalah contoh agen yang menghasilkan fibrosis sebagai dari bagian penyembuhan
luka. Pada respon imun dan penyembuhan luka, fibrosis dipicu secara tidak
langsung oleh efek sitokinin yang dikeluarkan oleh sel yang mengelami inflamasi.
Beberapa senyawa seperti etanol dan besi dapat menyebabkan fibrosis primer
dengan secara langsung meningkatkan transkripsi gen pembentuk kolagen
sehingga meningkatkan jumlah jaringan penghubung yang disekresikan oleh sel
(Lingappa & Nguyen, 2006).
Sel penyimpan lemak (liposit) bertanggung jawab atas mekanisme dari
peningkatan fibrogenesis dalam system retikuloendotel liver. Sebagai respon
terhadap sitokin, liposit berdiferensiasi dari sel yang tidak aktif, dimana vitamin A
disimpan menjadi miofibroblas yang akan kehilangan kapasittas untuk
menyimpan vitamin A. miofibroblas ini menjadi aktif dalam produksi matriks
ekstraseluler. Sirosis hepatik muncul dalam dua tahap. Tahap pertama ditandai
oleh suatu perubahan dalam komposisi matriks ekstraseluler dari non-crosslinked, non-fibril-forming collagen menjadi kolagen yang lebih rapat dan menuju
17
cross-linked. Pada tahap ini kerusakan liver masih bersifat reversible. Tahap kedua
adalah pembentukan dari kolagen cross-linked subendotel, poliferasi sel-sel
mioepitel, dan distorsi dari struktur liver dengan penempakan regenerasi nodul.
Tahap kedua ini sifatnya irreversible (Lingappa & Nguyen, 2006).
Tahap akhir dari peyakit hati kronis ditandai berdasarkan tiga karakteristik,
yaitu (i) Bridging Fibrous Septa dalam bentuk pita halus atau jaringan parut lebar
yang menggantikan lobulus, (ii) Nodul parenkim yang terbentuk oleh regenerasi
hepatosit, dengan ukuran bervariasi dari yang sangat kecil (kurang dari 3 mm)
hingga sangat besar (beberapa sentimeter), (iii) kerusakan struktur hati secara
keseluruhan, yang ditandai dengan distorsi percabangan pembuluh hepatik dan
gangguan aliran darah portal (Robbins, 2005). Patogenesis hati dapat dilihat pada
gambar 2.4.
Gambar 2.4 Petogenesis Sirosis (Hopkins J, 2014)
2.2.6 Komplikasi Sirosis
Bila penyakit sirosis berlanjut progresif maka gambaran klinis, prognosis
dari pengobatan tergantung pada seberapa besar komplikasi fundamental yang
terjadi. Berikut dua kelainan yang fundamental pada sirosis hati, yaitu kegagalan
fungsi hati dan hipertensi portal.
2.2.6.1 Kegagalan Fungsi Hati
Kegagalan fungsi hati akan ditemukan dikarenakan terjadinya perubahan
pada jaringan parenkim hati menjadi jaringan fibrotik dan penurunan perfusi
jaringan hati sehingga mengakibatkan nekrosis pada hati. Kegagalan fungsi hati
18
akan timbul ensefalopati hepatik, spider nevi, alopepsia pektoralis, eritema
palmaris, atrofi testis, ginekomastia, ikterus, (Tarigan, 2004).
2.2.6.2 Hipertensi portal
Hipertensi portal timbul apabila mekanisme kompensasi tidak serasi lagi
akibat meningkatnya secara patologis, baik aliran darah portal ke hati (forward
hypothesis) maupun tahananya (backward hypothesis). Akibatnya timbul kolateral
porto sistemik secara spontan, sebagai usaha untuk menurunkan tekanan sistem
portal maupun vena portalnya. Komplikasi hipertensi portal dapat menimbulkan
splenomegali, pemekaran pembuluh darah vena esofagus atau kardia, caput
mendusae, hemoroid, vena kolateral pembuluh perut, anemia, leukopenia,
trombositopenia (Tarigan, 2004). Bila penyakit berlanjut maka dari kedua
komplikasi tersebut dapat timbul komplikasi yang lain. Komplikasi sirosis hati
dapat dilihat dari gambar 2.5 berikut.
Gambar 2.5 Macam-macam komplikasi pada sirosis hati
(Robbins et al, 2007)
A. Gastroesophageal Varices Bleeding
Varises gastroesofagus adalah pelebaran pembuluh darah di gaster atau
esofagus yang terjadi semakin besar. Pecahnya varises tersebut akan
menimbulkan perdarahan. Varises terjadi pada hampir 50% pasien dengan
19
sirosis hati. Varises gastroesofagus merupakan akibat langsung hipertensi
portal karena peningkatan tahanan aliran portal dan peningkatan aliran darah
yang masuk ke vena portal. Peningkatan tekanan portal (hipertensi portal)
menyebabkan dilatasi pembuluh darah terutama yang berasal dari vena azigos,
yang kemudian menyebabkan varises. Varises terjadi jika terdapat peningkatan
perbedaan tekanan antara vena portal dan vena hepatika lebih dari 10 mmHg.
Varises akan semakin berkembang akibat peningkatan aliran darah ke tempat
varises dan terjadi ruptur. Menurut Dib et al menuliskan tiga hal yang
membuat risiko perdarahan varises gastroesofagus, yaitu (1) peningkatan
hipertensi portal: kerusakan hati yang ditimbulkan penyakit, asupan makanan,
asupan etanol, irama sirkadian, olahraga fisik dan peningkatan tekanan
intraabdomen; (2) faktor yang melemahkan dinding varises, seperti asam
asetilsalisilat dan obat golongan AINS; (3) infeksi bakteri yang dapat
membuat perdarahan awal dan berulang (Minano and Guadalupe, 2011).
B. Asites
Asites adalah akumulasi cairan di dalam rongga peritoneum. Kata asites
berasal dari bahasa yunani askites dan askos yang berarti kantong atau perut.
Asites adalah salah satu komplikasi penting pada pasien sirosis hati. Dalam
kurun waktu 10 tahun sejak diagnosis ditegakkan, sekitar 50% pasien sirosis
mengalami komplikasi berupa asites. Ada 3 hipotesis yang yang menyebabkan
terjadinya asites, yaitu (Giefer, 2011):
(1) Hipotesis Underfilling, Asites terbentuk karena sekuestrasi cairan yang
tidak memadai pada pembuluh darah splanknik akibat peningkatan
tekanan portal dan penurunan Effective Arterial Blood Volume (EABV).
Hal tersebut mengakibatkan aktivasi sistem renin-angiotensin-aldosteron
dan sistem persarafan simpatis sehingga terjadi retensi air dan garam.
(2) Hipotesis Overflow Berdasarkan hipotesis ini, asites terbentuk karena
ketidakmampuan ginjal dalam mengatasi retensi garam dan air, yang
berakibat tidak adanya penurunan volume. Dasar teori ini adalah kondisi
hipervolemia intravaskular yang umum dijumpai pada pasien dengan
sirosis hati.
20
(3) Hipotesis vasodilatasi arteri perifer, hipotesis ini adalah hipotesis terbaru
yang merupakan gabungan dari kedua hipotesis sebelumnya. Hipertensi
portal menyebabkan vasodilatasi arteri perifer, dan berakibat penurunan
EABV. Sesuai dengan perjalanan alami penyakit, terdapat peningkatan
eksitasi neurohumoral, dan peningkatan retensi natrium oleh ginjal
sehingga volume plasma meningkat. Urutan kejadian antara hipertensi
portal dan retensi natrium ginjal belum jelas. Hipertensi portal juga
menyebabkan peningkatan kadar nitrat oksida Nitrat oksida (NO)
merupakan mediator kimia yang menyebabkan vasodilatasi pembuluh
darah splanknik dan perifer. Kadar NO pada arteri hepatika pasien asites
lebih besar daripada pasien tanpa asites. Peningkatan kadar epinefrin dan
norepinefrin, dan hipoalbuminemia juga berkontribusi dalam pembentukan
asites. Hipoalbuminemia mengakibatkan penurunan tekanan onkotik
plasma sehingga terjadi ekstravasasi cairan plasma ke rongga peritoneum.
Dengan demikian, asites jarang terjadi pada pasien sirosis tanpa hipertensi
portal dan hipoalbuminemia.
C. Spontaneous Bacterial Peritonitis (SBP)
SBP terjadi karena berkembangnya infeksi pada cairan asites,
mikroorganisme patogen pada cairan peritoneum berasal dari saluran cerna.
Pada keadaan sirosis dengan hipertensi portal akan terjadi enteropati sehingga
bakteri yang ada dalam saluran cerna masuk ke dalam cairan asites karena
perforasi exudate dan transudate. Disamping itu cairan asites merupakan
cairan plasma yang mengandung protein sehingga baik untuk media
pertumbuhan bakteri patogen, diantaranya enterobactericeae (E. coli), bakteri
gram negatif, kelompok enterococcus (Dipiro et al, 2008)
Pasien dengan SBP biasanya tidak ada tanda infeksi tetapi beberapa
pasien mungkin menunjukkan tanda-tanda sepsis dan shok, ensefalopati, atau
kerusakan fungsi hati. Angka kematian SBP tanpa pengobatan adalah sebesar
lebih dari 50%, tetapi dapat dikurangi menjadi kurang dari 20% dengan
diagnosis dini dan pengobatan. SBP terlihat pada sekitar 12% dari pasien
yang dirawat di rumah sakit dengan sirosis dan asites. SBP dicirikan oleh
21
adanya sel-sel neutrofil dalam cairan asites (250/l) atau kultur cairan asites
positif (Bendtsen et al, 2012).
D. Sindrom Hepato Renal (SHR)
Sindrom hepatorenal merepresentasikan disfungsi dari ginjal yang
dapat diamati pada pasien yang mengalami sirosis dengan komplikasi asites.
Sindrom ini diakibatkan oleh vasokonstriksi dari arteri ginjal besar dan kecil
sehingga menyebabkan menurunnya perfusi ginjal yang selanjutnya akan
menyebabkan penurunan laju filtrasi glomerulus. Diagnosa sindrom
hepatorenal ditegakkan ketika ditemukan kliren kreatinin kurang dari 40
ml/menit atau saat serum kreatinin lebih dari 1,5 mg/dl, volume urin kurang
dari 500 mL/d dan natrium dalam urin kurang dari 10 mEq/L (Kopacova,
2012).
E. Hepatik Ensefalopati (HE)
Ensepalopati hepatikum merupakan suatu kelainan neuropsikiatri
yang bersifat reversibel dan umumnya didapat pada pasien dengan sirosis hati
setelah mengeksklusi kelainan neurologis dan metabolik. Derajat keparahan
dari kelainan ini terdiri dari derajat 0 (subklinis) dengan fungsi kognitif yang
masih bagus sampai ke derajat 4 dimana pasien sudah jatuh ke keadaan koma.
Patogenesis terjadinya ensefalopati hepatik diduga oleh karena adanya
gangguan metabolisme energi pada otak dan peningkatan permeabelitas
sawar darah otak. Peningkayan permeabelitas sawar darah otak ini akan
memudahkan masuknya neurotoxin ke dalam otak. Neurotoxin tersebut
diantaranya, asam lemak rantai pendek, mercaptans, neurotransmitter palsu
(tyramine, octopamine, dan beta- phenylethanolamine), amonia, dan gammaaminobutyric acid (GABA). Kelainan laboratoris pada pasien dengan
ensefalopati hepatik adalah berupa peningkatan kadar amonia serum (Saskara
dan Suryadarma, 2012).
F. Karsinoma Hepatoseluler (KHS)
22
KHS adalah salah satu jenis keganasan hati primer yang paling sering
ditemukan dan banyak menyebabkan kematian. Dari seluruh keganasan hati,
80-90% adalah KHS. Beberapa faktor patogenesis karsinoma hepatoseluler
telah didefinisikan baru-baru ini. Hampir semua tumor di hati berada dalam
konteks kejadian cedera kronik (chronic injury) dari sel hati, peradangan dan
meningkatnya kecepatan perubahan hepatosit. Respons regeneratif yang
terjadi dan adanya fibrosis menyebabkan timbulnya sirosis, yang kemudian
diikuti oleh mutasi pada hepatosit dan berkembang menjadi karsinoma
hepatoseluler. HBV atau HCV mungkin ikut terlibat di dalam berbagai
tahapan proses onkogenik ini. Misalnya, infeksi persisten dengan virus
menimbulkan inflamasi, meningkatkan perubahan sel, dan menyebabkan
sirosis. Sirosis selalu didahului oleh beberapa perubahan patologis yang
reversibel, termasuk steatosis dan inflamasi, baru kemudian timbul suatu
fibrosis yang ireversibel dan regenerasi nodul (Siregar, 2005).
2.2.7 Prognosis Sirosis
Prognosis sirosis sangat bervariasi dan dipengaruhi oleh sejumlah faktor,
diantaranya etiologi, beratnya kerusakan hati, komplikasi, dan penyakit yang
menyertai. Beberapa tahun terakhir, metode prognostik yang paling umum dipakai
pada pasien dengan sirosis adalah sistem klasifikasi Child-Turcotte-Pugh. Sistem
klasifikasi Child-Turcotte-Pugh dapat dilihat pada tabel 2.2. Sistem klasifikasi
Child- Turcotte-Pugh dapat memprediksi angka kelangsungan hidup pasien
dengan sirosis tahap lanjut. Dimana angka kelangsungan hidup selama setahun
untuk pasien dengan kriteria Child-Pugh A adalah 100%, Child-Pugh B adalah
80%, dan Child-Pugh C adalah 45% (Saskara dan Suryadarma, 2012).
Tabel II.2 Sistem Klasifikasi Child-Turcotte-Pugh
Parameter
Skor
1
Asites
Tidak Ada
Minimal
Sedang-Berat
Ensefalopati
Tidak Ada
Minimal-Sedang
Sedang-Berat
23
Bilirubin (mg/dl)
< 2,0
2-3
>3
Albumin (g/dl)
> 3,5
2,8-3,5
< 2,8
Watktu Protombin/
1-3 atau INR<
4-6 atau INR 1,7-
> 6 atau INR >
INR (detik)
1,7
2,3
2,3
2.2.8 Pemeriksaan Fisik
Pemeriksaan fisik hati dimaksudkan untuk mengetahui secara langsung
tanda-tanda penyakit hati yang terdapat pada anggota tubuh pasien, tanpa bantuan
alat. Pemeriksaan fisik tersebut antara lain (Tarigan, 2004):
2.2.8.1 Pemeriksaan Hati
Perkiraan besar hati, biasanya hati membesar pada awal sirosis, bila hati
mengecil artinya prognosis kurang baik atau adanya hepatitis berat atau nekrosis
hati masif. Besar hati normal selebar telapak tangannya sendiri (7-10 cm). Pada
sirosis hati, konsistensi hati biasanya kenyal atau firm, pinggir hati biasanya
tumpul dan ada sakit tekan pada perabaan hati.
2.2.8.2 Pemeriksaan Limpa
Pembesaran limpa diukur dengan dua cara, yaitu: (1) Schuffner, hati
membesar ke medial dan ke bawah menuju umbilikus (S I-IV) dan dari umbilikus
ke sisi kanan (S V-VIII). Cara (2) Hacket, bila limpa membesar kearah bawah saja
(S V-VII).
2.2.8.3 Perut dan Ekstra abomen
Pada perut dapat menunjukkan asites yang ditandai dengan kondisi perut
membesar dengan pelebaran vena-vena periumbilikalis (caput mendussae) dan
terbentuknya sirkulasi kolateral portal yang luas.
2.2.8.4 Manisfestasi di luar perut
Perhatikan adanya spider nevi pada tubuh bagian atas, bahu, leher, dada,
pinggang, dan tubuh bagian bawah. Perlu diperhatikan adanya eritema palmaris,
ginekomastia, dan atrofi testis pada pria, bisa juga dijumpai hemoroid. Penilaian
keadaan mental dan fungsi neurologi, sedikit kemerosotan intelek dan perubahan
24
kepribadian, adanya flapping tremor pada tangan (asteriksis) atau hingga terjadi
koma.
2.2.9 Pemeriksaan Laboratorium
Pemeriksaan laboratorium merupakan deteksi awal dan langkah untuk
menentukan manajemen terapi penyakit hati. Tes ini sering disebut "tes fungsi
hati", pemeriksaan klinis dan pemeriksaan fisik memainkan peranan penting
untuk menafsirkan fungsi hati. Pemeriksaan fungsi hati dapat dilakukan dengan
pengujian kapasitas hati untuk mengangkut senyawa anion organik dan untuk
memetabolisme obat, tes deteksi cedera pada hepatosit (tes enzim serum) serta tes
kapasitas biosintesis liver.
2.2.9.1 Pengujian Kapasitas Hati untuk Mengangkut Anion Endogen dan
Metabolisme Obat
A. Bilirubin
Peningkatan bilirubin dapat disebabkan karena peningkatan produksi,
berkurangnya ekskresi bilirubin karena obstruksi saluran empedu dan
berkurangnya metabolisme. Peningkatan produksi sebagai akibat obstruktsi
liver diikuti oleh peningkatan enzim liver lainnya (alkaline phosphatase dan
GGT ). Pada mekanik obstruksi pada penyakit hati 50% diantaranya adalah
conjugated bilirubin. Serum bilirubin normal adalah 3 sampai 17 mol/l.
Jaundice dapat terdeteksi jika hasil diatas 40 mol/l. Dibutuhkan cahaya
matahari untuk mendeteksi jaundice minimal. Hiperbilirubinemia bisa
menandakan penyakit hepatobilier atau hemolisis. Dapat dipakai sebagai
petunjuk penyakit hepatobiliari atau hemolisis. Terdapat 3 jenis bilirubin, yaitu
(Thapa dan Anuj, 2007):
1. Bilirubin total diukur sebagai jumlah yang bereaksi setelah penambahan
alkohol dalam 30 menit. Kisaran normal adalah 0,2-0,9 mg/dl
(2-15
mol/L). Hal ini sedikit lebih tinggi 3-4 umol/L pada laki-laki
dibandingkan dengan perempuan.
2. Bilirubin direct merupakan fraksi yang larut dalam air. Hal ini diukur oleh
reaksi dengan diazotisasi asam sulfanilat dalam 1 menit dan ini
25
memberikan hasil conjugated bilirubin. Kisaran normal 0.3mg/dl (5,1
mol/L).
3. Bilirubin indirect, fraksi ini dihitung dengan selisih dari bilirubin total dan
langsung dan merupakan ukuran fraksi unconjugated bilirubin.
B. Bilirubin Urin
Adanya bilirubin dalam urin mengindikasikan penyakit hepatobiliari.
Bilirubin tak terkonjugasi erat kaitannya pada albumin dan tidak disaring oleh
glomerulus, dengan demikian tidak ada dalam urin. Sejumlah bilirubin
terkonjugasi terukur dalam serum hanya ditemukan di penyakit hepatobiliari.
Tes dengan reagen diazo mudah digunakan dan dapat mendeteksi kadar kecil
1-2 mol/L (Thapa dan Anuj, 2007).
C. Urobilinogen
Di dalam usus, bilirubin diubah menjadi urobilinogen yang kemudian
diekskresikan oleh ginjal dalam bentuk urin. Urobilinogen memberikan warna
kuning pada urin, sedangkan urobilinogen dan bilirubin memberi warna
kuning pada tinja atau feses. Peningkatan urobilinogen dalam urin merupakan
indikator yang sensitif adanya disfungsi hepatoseluler baik kompensasi sirosis
atau penyakit hati ganas. Pada awal hepatitis virus urobiliogen muncul dalam
urin. Kadarnya meningkat bila terjadi hemolisis, sedangkan pada ikterus
kolestatik urobilinogen tidak ada dalam urin. Urobilinogen memberikan reaksi
ungu untuk reagen ehrlich aldehid (Thapa dan Anuj, 2007).
2.2.9.2 Tes Deteksi Cedera pada Hepatosit
A. Aminotransferase
Pengujian banyak enzim serum diusulkan sebagai ukuran kerusakan
hepatoseluler. Diantaranya serum glutamate oksaloasetat (SGOT) dan serum
glutamate piruvat (SGPT) transaminase (minotransferase) terbukti paling
praktis. SGOT terdapat pada semua jaringan tubuh, khususnya dalam hati dan
otot rangka. SGPT terutama terdapat dalam hati dan dalam jumlah yang
sedikit dalam ginjal dan otot rangka. Walaupun banyak pemeriksaan
26
menunjukkan bahwa besar dan lamanya peningkatan enzim serum sejajar
dengan luas kerusakan sel hati (yaitu nekrosis atau perubahan permeabilitas
sel). Hubungan kuantitatif yang tepat tidak dapat dibuat pada sebagian besar
keadaan klinik. Serum normal Mengandung kurang dari 5-60 i/L untuk lakilaki dan 5-40 i/L pada perempuan (Isselbacher, 2000).
B. Alkaline Fosfatase
Alkaline fosfatase merupakan enzim hati yang dapat masuk ke saluran
empedu. Meningkatnya kadar alkali fosfatase terjadi apabila ada hambatan
pada saluran empedu. Hambatan saluran empedu dapat disebabkan adanya
batu empedu atau penyempitan pada saluran empedu. Harga normal pada
orang dewasa adalah 17 142 /L sedangkan pada anak usia 0 hingga 12
tahun adalah 145 530 /L (Thapa dan Anuj, 2007).
C. Gamma-glytamyl transpeptidase
Gamma-glytamyl transpeptidase (GGT) adalah enzime yang terdapat
pada hepatosit dan sel epitel biliari. GGT mungkin tinggi pada penyakit hati.
Biasanya lebih menyerupai obstruksi biliari daripada kerusakkan hati. GGT
pada laki-laki adalah sekitar 11 - 50 /L sedangkan GGT pada perempuan
sebesar 7 - 32 /L. Pemeriksaan ini harus dilakukan pada pasien dengan
abnormalitas alkali fosfatase, sebagai identifikasi dari kelainan hepar. GGT
serum adalah indikator sensitif dari penyakit hepatobiliari (Dipiro et al, 2008).
2.2.9.1 Tes Kapasitas Biosintesis Liver
A. Albumin
Albumin merupakan protein plasma terbanyak dalam tubuh manusia.
Kadarnya berkisar antara 3,5-5,5 g/dL dan merupakan 60% dari seluruh protein
plasma. Kadar albumin darah merupakan hasil kecepatan sintesis hati dikurangi
kecepatan degradasi dan distribusi albumin kedalam ruang intra dan ekstra
vaskuler. Sintesa albumin terutama dihati yaitu sebanyak 9-12 g/hari pada
orang dewasa normal dan merupakan 25% dari total protein hati setiap hari.
Katabolisme albumin terjadi di sel hati, dimana sebanyak 15% albumin yang
27
sudah tua usianya akan diurai kembali menjadi berbagai komponen asam
amino yang kemudian siap digunakan untuk berbagai sintesis protein yang
dibutuhkan tubuh. Sisanya sebanyak 40-60% di sel otot dan kulit. Distribusi
albumin terjadi di dalam pembuluh darah maupun di luar pembuluh darah
(cairan intertitial). Pada sirosis hati akan dijumpai rendahnya produksi albumin
(Dipiro et al, 2008).
B. Waktu Protrombin
Protrombin (faktor II), faktor VII, IX dan X merupakan faktor
koagulasi yang dihasilkan oleh hati dimana dalam pembentukannya
memerlukan vitamin K. Vitamin K ini pun dihasilkan di hati. Adapun peranan
vitamin K pada tahap karboksilasi gugus gamma glutamil. Waktu protrombin
pertama kali diperkenalkan oleh Quick tahun 1935 dimana prinsip
pemeriksaan ini, mengukur lamanya waktu yang dibutuhkan dalam detik
untuk
pembentukan
fibrin
dari
plasma
sitrat,
setelah
penambahan
tromboplastin jaringan dan ion kalsium dalam jumlah optimal. Hasil
pemeriksaan waktu protrombin tergantung dari beberapa hal seperti
pengambilan bahan, penanganan bahan pemeriksaan, macam reagen yang
dipakai dan teknik (Dipiro et al, 2008).
2.3
Tinjauan Hipertensi Portal
2.3.1
Definisi
Hati orang dewasa normalnya mendapat perfusi sekitar 1500 ml darah
permenit. Kira-kira dua pertiga aliran darah hati dan setengah suplai oksigen
dilakukan oleh vena portal, sisanya berasal dari arteri hepatika. Dalam keadaan
normal, tekanan dalam vena portal sangat rendah, yaitu 10 mmHg-15 mmHg,
karena resistensi vaskuler dalam sinusoid hati juga rendah. Regenerasi noduler
dan perubahan susunan lobulus hati yang mengalami sirosis, mengakibatkan
peningkatan restensi vaskuler dalam vena portal dan peningkatan tekanan vena
portal (hipertensi portal) disebabkan karena gangguan aliran darah (Isselbacher,
2000).
28
Hipertensi portal ditandai dengan peningkatan tekanan portal atau Portal
Presure Gradient (PPG). PPG yaitu perbedaan tekanan antara vena portal dan
vena cava inferior, yang mewakil perfusi hati dengan darah portal. Peningkatan
tekanan portal menyebabkan kosekuensi lain, seperti splenomegali, pertumbuhan
jaringan kolateral portal sistemik yang dapat berakibat hematemesis dan melena
serta pengembangan keadaan sirkulasi hiperkinetik. Hipertensi portal menjadi
signifikan ketika PPG meningkat diatas 10 mmHg 12 mmHg dan keadaan ini
sifatnya mentap di atas harga normal (Berziggoti et al, 2013). Gambar 2.6 berikut
menjelaskan tentang keadaan hipertensi portal yang menyebabkan splenomegali
dan jaringan kolateral yang membypass aliran vaskuler.
Gambar 2.6 Keadaan Hipertensi Portal (Hopkins J, 2014)
2.3.2
Epidemologi
Pada orang dewasa penyebab hipertensi portal dapat dikatakan selalu
dikaitkan dengan sirosis hati, meskipun beberapa penyebab lain dapat menjadi
penyebab meningkatnya tekanan portal ini. Di Amerika Serikat 85% penyebab
hipertensi portal adalah sirosis hati, dan sebagian besar disebabkan oleh
alkoholisme. Di Cekoslawakia, sirosis hati dilaporkan sebagai penyebab
hipertensi portal hampir pada 90% kasus. Hipertensi portal idiopatik sendiri
banyak dilaporkan di India dan Jepang. Di Indonesia, hipertensi portal non sirotik
pernah dilaporkan beberapa kali, diduga prevalensinya di bawah 5%
(Kusumobroto, 2004).
29
2.3.3
Etiologi
Beberapa faktor dapat menjadi penyebab dari hipertensi portal,
diantaranya penyebab dari presinusoidal, intra hepatik dan kenaikan aliran darah
ke sistem portal (Anonim, 2008).
2.3.3.1 Presinusoidal
1. Sumbatan vena portal ekstra hepatik
a. Trombosis intrinsik akibat:
-
Sepsis neonates
Trombosis akibat kehamilan
Penyakit darah: polisitemia vera, meilofibrosis
Pil anti hamil
b. Trombosis Intrinsik akibat :
-
Tumor pankreas
Penyakit kelenjar ode
Pankreatitis
2. Sumbatan vena portal intra hepatik
Kelainan pada vena portal atau di dalam sinusoid hepar:
-
Penyakit retikuloendotelia
Sarkoidosis, skistosomiasis, fibrosis hati kongenital
Keracunan arsen, kuprum, venilklorida
Keracunan obat-obat seperti 6-mercaptopurine, azathioprine
Akibat transplantasi ginjal
2.3.3.2 Intra Hepatik
1. Sirosis hati, nodul non sirotik, penyakit veno-oklusif
2. Sindrom budd Chairi (sumbatan vena hepatika)
2.3.3.3 Kenaikan aliran darah ke sistem portal
1. Fistula arterio vena
2. Kenaikan darah ke limpa
2.3.4
Klasifikasi Hipertensi Portal
Sherlock membagi hipertensi portal berdasarkan penyebabnya menjadi
dua, yaitu:
30
2.3.4.1 Presinusoidal dimana tekanan intrasplanik meningkat, sedangkan tekanan
vena hepatik masih normal (Anonim, 2008).
2.3.4.2 Intrahepatik dimana terjadi peningkatan tekanan dari vena intrsplanik dan
vena hepatik (Anonim, 2008).
2.3.5
Patofisiologi Hipertensi Portal
Peningkatan resistensi terhadap aliran darah dibagian portal dapat timbul
pada berbagai keadaan, yang dapat dibagi menjadi tiga, yaitu penyebab prahati,
intrahati, dan pasca hati. Penyebab prahati yang utama adalah trombosis oklusif
dan penyempitan vena portal sebelum pembuluh ini bercabang-cabang di dalam
hati. Splenomegali masif juga dapat mengalihkan darah dalam jumlah besar ke
dalam vena lienalis. Penyebab pascahati yang utama adalah gagal jantung kanan
yang parah, perikarditis konstriktiva, dan obstruksi aliran keluar vena hepatika.
Penyebab intrhati yang dominan adalah sirosis yang merupakan penyebab
sebagian besar kasus hipertensi portal. Penyebab intrahati yang paling jarang
adalah skistosomiasis, perlemakan masif, penyakit granulomatosa difus dan
penyakit yang mengenai mikrosirkularis portal, misalnya hiperplasia regeneratif
nodular (Robbins et al, 2007).
Hipertensi portal timbul apabila mekanisme kompensasi tidak serasi lagi
akibat peningkatan resistensi vaskular intrahepatik dan peningkatan aliran darah
melalui sistem portal. Resistensi intrahepatik meningkat melalui 2 cara yaitu
secara mekanik dan dinamik. Secara mekanik resistensi berasal dari fibrosis yang
terjadi pada sirosis, sedangkan secara dinamik berasal dari vasokontriksi vena
portal sebagai efek sekunder dari kontraksi aktif vena portal dan septa
miofibroblas, untuk mengaktifkan sel stelata dan sel-sel otot polos. Tonus
vaskular intra hepatik diatur oleh vasokonstriktor (norepineprin, angiotensin II,
leukotrin dan trombioksan A2) dan diperparah oleh penurunan produksi
vasodilator (seperti nitrat oksida) (Berzigotti et al, 2013).
Akibat dari sirosis timbul kolateral porto-sistemik secara spontan, sebagai
usaha untuk menurunkan tekanan sistem portal. Namun meskipun pintasan portosistemik timbul secara spontan, tekanan portal tetap tinggi, akibat terjadinya
keadaan hiperdinamik sirkulasi splanknik maupun sistemik, yang menyebabkan
31
makin meningkatnya aliran darah vena portal. Timbulnya keadaan sirkulasi yang
hiperdinamik ini dipengaruhi oleh meningkatnya kadar vasodilator endogen dalam
darah (circulating endogenous vasodilator) dan menurunnya kepekaan terhadap
vasokonstriktor (Kusumobroto, 2004). Gambar 2.5 menjelaskan tentang
patofisiologi hipertensi portal.
Hipertensi Portal
Peningkatan Retensi
Vaskuler Hepatik
Perubahan Struktur
Fibrosis Trombosis
Peningkatan Aliran
Portal
Peningkatan Tekanan
Penurunan Produksi
NO dan Vasodilatasi
Endogenus Vasokonstriktor
Gambar 2.7 Patofisiologi Hipertensi Portal (Berzigotti et al, 2013)
2.3.6
Komplikasi Hipertensi Portal
Bila hipertensi portal berlanjut secara progresif maka didapatkan
gambaran klinis diantaranya timbulnya asites, varises esofagus, perdarahan
hemoroid dan splenomegali.
Asites merupakan penimbunan cairan encer intraperitoneal yang
mengandung protein. Faktor utama patogenesis asites adalah peningkatan tekanan
hidrostatik pada kapiler usus (hipertensi portal) dan penurunan tekanan osmotik
koloid akibat hipoalbuminemia. Faktor lain yang berperan adalah retensi natrium
dan air serta peningkatan sintesis dan aliran limfa hepatik (Price et al, 2005).
Saluran kolateral penting yang timbul akibat sirosis dan hipertensi portal
terdapat pada esofagus bagian bawah. Aliran darah melalui saluran ini ke vena
cava menyebabkan dilatasi vena-vena tersebut (varises esofagus). Varises ini
terjadi pada sekitar 70% penderita sirosis lanjut. Perdarahan pada varises ini
sering mengakibatkan kematian (Price et al, 2005).
32
Sirkulasi kolateral juga melibatkan vena supervisial dinding abdomen, dan
timbulnya sirkulasi ini mengakibatkan dilatasi vena-vena sekitar umbilikus (kaput
medusa). Sistem vena rektal membantu dekompensasi tekanan portal sehinga
vena-vena berdilatasi dan dapat menyebabkan berkembangnya hemoroid interna.
Perdarahan dari hemoroid yang pecah biasanya tidak hebat, karena tekanan di
daerah ini tidak setinggi tekanan pada esofagus kerena jarak yang lebih jauh dari
vena portal (Price et al, 2005). Splenomegali pada sirosis dapat dijelaskan
berdasarkan kongesti pasif kronis akibat aliran balik tekanan darah yang lebih
tinggi dari vena lienalis (Price et al, 2005).
2.4 Penatalaksanaan Terapi
Penanggulangan hipertensi portal hanya diarahkan pada usaha-usaha untuk
mengatasi penyulit yang timbul, misalnya perdarahan saluran makan bagian atas
dengan (Anonim, 2008):
2.4.1
Tindakan darurat meliputi
1. Tindakan umum seperti: resusitasi, kumbah lambung dengan air es,
hemostatik, sterilisasi usus, antasida dan cimetidin atau ranitidin,
klisma tinggi atau lavement.
2. Tindakan khusus meliputi
-
Medic intensif : lavas es dan vasopresin intragastrik, hemostatik
vasopresin intravena, tomponade balon, skleroterapi endoskopik,
sklerosis varises transhepatik
2.4.2
Bedah darurat : operasi pintas atau non pintas
Tindakan jangka panjang dapat berupa
1. Secara medik dengan pemberian : penyekat beta, somatostatin atau
analognya, skleroterapi (Transjugulan Intrahepatic Portal Stein
Shunt).
2. Bedah seperti : operasi atau operasi non pintas.
2.5 Terapi non Farmakologi
2.5.1 Balon Tamponade
33
Balon tamponade ada dua macam yaitu LN tube yang mempunyai balon
lambung terutama untuk perdarahan varises kardia dan fundus Sb tube terdiri dari
dua balon pada lambung dan esofagus, terutama untuk perdarahan varises
esofagus. Efektivitas menghentikan perdarahan pada pemasangan pertama
berkisar 55-92%, perdarahan ulang terjadi 24-60% kasus dan angka kematian
antara 20-60% (Kusomobroto, 2004).
2.5.2
Sklerosis Varises Endoskopik (SVE)
Penyuntikan bahan sklerotik langsung pada varises esofagus lewat bantuan
endoskopik sebenarnya sudah diperkenalkan sejak tahun 1939. SVE dikerjakan
atas indikasi pengobatan darurat guna menghentikan perdarahan esofagus, dan
untuk jangka panjang mencegah terjadinya perdarahan berulang. Efektivitas
menghentikan perdarahan antara 84-100%, sedangkan perdarahan berulang sekitar
6,7-43% (Kusomobroto, 2004).
2.5.3
Ligasi Varises Endoskopik (LVE)
LVE ini dikerjakan dengan alat khusus yang dapat dipakai untuk
menghisap permukaan varises kemudian mengikatnya dengan tali karet (rubber
band). Cara ini mirip dengan ligase hemoroid. LVE pertama diperkenalkan
pertama kali pada tahun 1986, sedangkan di RSUD Dr. Sutomo baru dicoba pada
awal tahun 1994. Beberapa laporan menunjukkan hasil yang memuaskan bahkan
dibandingkan dengan STE, cara ini lebih unggul (Kusomobroto, 2004).
2.5.4
Transjugular Intrahepatik Porto-Sistemik Shunt (TIPSS)
TIPSS dilakukan bila setelah skleroterapi tetap terjadi perdarahan atau bila
terjadi perdarahan varises dari lambung. Cara ini lebih efektif untuk mencegah
perdarahan berulang dibandingkan dengan terapi endoskopi. TIPSS dapat
menurunkan tekanan portal secara cepat namun sekitar 60% stent akan tertutup
dalam waktu 3-12 bulan, sehingga prosedur ini merupakan terapi sementara. Salah
satu kerugian TIPSS adalah kemungkinan terjadinya ensefalopati hepatik pada
25% penderita. Kontarindikasi alat ini adalah pembentukan vena potal dan
34
gangguan koagulasi yang tidak dapat dikoreksi (Lopez-Mendez and Misael,
2006).
2.6 Terapi Farmakologi
2.6.1 Obat yang menurunkan tekanan portal
Peningkatan aliran vena portal dan adanya vasodilatasi splanknik dapat
diperbaiki secara farmakologi melalui penggunaan vasokonstriktor splanknikus.
Dalam studi hemodinamik eksperimental dan proof-of-concept, obat ini telah
terbukti dapat menurunkan tekanan portal. Vasokonstriktor efektif yang digunakan
dalam pengobatan kronis hipertensi portal yaitu, nonselektif -adrenergik
(NSBB). Sedangkan vasokonstriktor yang efektif dalam terapi akut varises
perdarahan yaitu, vasopresin dan somatostatin beserta analog sintetik masingmasing (Tripathi and Peter, 2013).
2.6.1.1 Non Selektif -bloker (NSBB)
NSBB adalah obat yang paling banyak dievaluasi dan digunakan dalam
pengobatan kronis hipertensi portal. Mekanisme kerja dengan cara memblokade
kedua reseptor -1 dan -2. Blokade reseptor -1 dapat menurunkan aliran portal
melalui penurunan curah jantung, blokade reseptor -2 menurunkan aliran portal
melalui vasokonstriksi splanknik dengan melawan aktivitas reseptor -adrenergik.
Seperti yang diharapkan, NSBB (propranolol, nadolol) menurunkan HVPG ke
tingkat yang lebih besar penurunan yaitu, pengurangan HVPG mencapai kurang
dari 12 mm Hg atau pengurangan lebih dari 20% dari HVPG awal. dibandingkan
dengan selektif -1 adrenergik bloker (atenolol, metoprolol) dan lebih disukai
dalam pengguanaan terapi. Kurangnya korelasi antara penurunan denyut jantung
pada saat setelah menggunakan propranolol (efek -1) dan penurunan HVPG
adalah bukti lebih lanjut bahwa efek -2 memainkan peran yang lebih penting
(Minano and Guadalupe, 2011).
NSBB paling banyak digunakan adalah propranolol dan nadolol.
Penggunaan NSBB dikaitkan dengan Dosis propranolol yang direkomendasikan
untuk pengobatan hipertensi arteri untuk pasien sehat adalah empat kali sehari.
Pada pasien sirosis, metabolisme obat lebih lambat sehingga dosisnya dua kali
sehari sudah cukup. Dosis awal adalah 20 sampai 40 mg secara oral dua kali
35
sehari dan meningkat secara bertahap sampai maksimal 160 mg dua kali sehari.
Dosis awal yang rendah (20 mg) dicadangkan untuk pasien dengan tekanan arteri
rata-rata rendah. Dalam banyak penelitian RCT, dosis telah disesuaikan untuk
memperoleh penurunan denyut jantung sebesar 25%, namun karena perubahan
dalam denyut jantung tidak memprediksikan penurunan tekanan portal, maka
pedoman baru-baru ini telah merekomendasikan penyesuaian NSBB ke dosis
toleransi tertinggi atau pengukuran detak jantung dari 50 sampai dengan 55
beats/min (Minano and Guadalupe, 2011).
Nadolol memiliki waktu paruh panjang dan dapat digunakan sekali sehari
yang dapat meningkatkan kepatuhan pasien . Dosis awal adalah 20 sampai 40 mg
oral sekali sehari. Dosis maksimumnya 240 mg sekali sehari dengan cara yang
sama seperti yang dijelaskan untuk propranolol . Nadolol mungkin memiliki efek
samping yang lebih sedikit daripada propranolol karena tidak melewati sawar
darah otak, meskipun penelitian lebih lanjut belum dilakukan (Minano and
Guadalupe, 2011).
Efek samping yang paling sering berhubungan dengan NSBB dilaporkan
dalam sirosis ringan, kelelahan, dan sesak napas. Beberapa efek samping
menghilang setelah pengurangan dosis. Dalam uji klinis, efek samping dapat
menyebabkan penghentian NSBB pada sekitar 15% pasien. Dalam sebuah
penelitian yang membandingkan preferensi pasien antara NSBB dan ligasi (terapi
endoskopi), lebih dari setengah pasien menyukai ligasi karena NSBB terkait sisi
efek samping. Selain itu, sampai dengan 15% dari pasien mungkin memiliki
riwayat (sinus bradikardia, insulin-dependent diabetes) atau kontraindikasi mutlak
untuk NSBB, seperti penyakit paru obstruktif, gagal jantung, penyakit katup aorta,
kedua dan ketiga derajat blok jantung atrio ventrikular, dan insufisiensi arteri
perifer (Minano and Guadalupe, 2011).
2.6.1.2 Vasopresin
Vasopresin menyebabkan vasokonstriksi splanknik dan sistemik. Akibat
vasokonstriksi splanknik terjadi penurunan aliran darah portal dan tekanan portal
yang menyebabkan ketegangan pada dinding varises (Soemoharjo dan Stephanus,
2007). Penggunaan infus 0,4 unit vasopressin per menit yang terus menerus
36
melalui vena perifer dapat mengakibatkan penurunan atau penghentian sementara
perdarahan varises. Dosis vasopresin kemudian diturunkan secara perlahan-lahan
dan dihentikan 48 jam setelah perdarahan berhenti. Penurunan curah jantung
sementara, aritmia jantung, dan retensi air dapat mengakibatkan pemakaian
vasopresin membahayakan terhadap penderita dengan penyakit iskemik jantung
(Mendez and Misael, 2006).
2.6.1.3 Somatostatin
Somatostatin dengan dosis 250 mg dimasukkan sebagai IV bolus, yang
diikuti dengan pemberian 250 mg per jam, dapat menghentikan perdarahan. Bila
diberikan infus secara terus-menerus selama 5 hari, ternyata hasilnya sama efektif
dengan skleroterapi darurat untuk menghentikan perdarahan dan mencegah
perdarahan kembali setelah 5 hari. Obat vasoaktif dapat diberikan segera setelah
pasien masuk rumah sakit dan dapat dilanjutkan sampai 5 hari setelah tindakan
endoskopi (skleroterapi atau ligasi), bila resiko perdarahan
kembali besar
(Soemoharjo dan Stephanus, 2007).
2.6.2 Obat yang menurunkan retensi aliran darah
Vasodilator seperti nitrat, prazosin, clonidine, angiotensin receptor blocker
(ARB) dan inhibitor angiotensin-converting enzim (ACEI) telah mengakibatkan
penurunan yang signifikan pada HVPG. Dalam sebuah penelitian, obat diberikan
selama 7 hari atau lebih menghasilkan penurunan HVPG rata-rata adalah sekitar
17%. Namun, obat ini tidak hanya bertindak atas sirkulasi intrahepatik, namun
juga memberikan suatu efek vasodilatasi pada sirkulasi sistemik yang
menyebabkan hipotensi arteri. Dalam beberapa studi, hubungan langsung telah
ditunjukkan antara penurunan tekanan arteri dan penurunan HVPG. Hal ini
menunjukkan bahwa vasodilator menurunkan tekanan portal terutama melalui
penurunan aliran darah portal sebagai refleks vasokonstriksi splanknikus yang
terjadi sebagai respons terhadap arteri hipotensi. Memburuknya vasodilatasi juga
dapat menyebabkan penurunan lebih lanjut dalam volume efektif aliran darah
arteri, dengan gangguan akibat retensi natrium dan vasokonstriksi ginjal (Minano
and Guadalupe, 2011).
37
2.6.3 Obat yang menurunkan tekanan portal dan retensi aliran darah
Penggunaan vasodilator saja saat ini tidak dianjurkan. Namun demikian,
baru-baru ini dalam uji meta analisis, dari data pasien yang menggunakan ARB
dan penghambat angiotensin-converting enzim menunjukkan bahwa, pada pasien
dengan sirosis Child A, obat tersebut dapat mengurangi tekanan portal dengan
efek samping yang minimal. Kombinasi vasodilator intrahepatik dan hasil
vasokonstriktor splanknikus dalam efek mengurangi tekanan portal pertama kali
ditunjukkan dalam sebuah studi hemodinamik. Studi ini dilakukan pada pasien
dengan sirosis dimana dengan penambahan nitrogliserin pada terapi vasopresin
menyebabkan penurunan HVPG lebih cepat. Pengamatan ini menunjukkan bahwa
pengurangan HVPG disebabkan oleh nitrat yang dihasilkan dari penurunan
resistensi intrahepatik. Efek ini juga telah diamati ketika ISMN atau prazosin
dikombinasikan dengan NSBB , dengan pengurangan HVPG sekitar 20% sampai
24% dengan terapi kombinasi, dibandingkan dengan terapi NSBB sendiri (15%).
Tingkat penurunan HVPG dengan NSBB dan ISMN adalah 44%, tingkat yang
jauh lebih tinggi dari yang diamati dengan NSBB saja (37 %). Namun, kombinasi
ini dikaitkan dengan efek samping yang lebih, yaitu retensi cairan atau gejala
hipotensi. Carvedilol adalah nonselektif -blocker dengan aktivitas yang lemah
pada aktivitas adrenergik anti-1 (vasodilator) dan oleh karena itu bertindak
sebagai kombinasi NSBB dan vasodilator. Ketika digunakan dengan dosis 25
sampai 30 mg per hari, telah dikaitkan dengan penurunan yang signifikan dalam
HVPG (16% -19%) (Minano and Guadalupe, 2011).
2.6.4 Sasaran Terapi
Pada table 2.3 berikut akan menjelaskan tentang dosis obat untuk
menurunkan tekanan dan resitensi pembuluh darah portal serta pencegahannya
untuk perdarahan variceal beserta sasaran pengobatan yang dicapai (Minano and
Guadalupe, 2011).
Tabel II.3 Terapi Farmakologi Hipertensi Portal
38
Obat
Propranolol
Dosis
Awal: 20-40 mg dua kali
1.
Sasaran Terapi
Ditingkatkan sampai toleransi
sehari secara oral
maksimum atau HR 50-55 kali
Maksimal: 160 mg dua kali
per menit
sehari secara oral
2.
Dilanjutkan tanpa dihentikan
dan tidak perlu untuk tindak
lanjut EGD
Nadolol
Awal: 20-40 mg satu kali
1.
Ditingkatkan sampai toleransi
sehari
maksimum atau HR 50-55 kali
Maksimal: 240 mg sehari
per menit
2.
Dilanjutkan tanpa dihentikan
dan tidak perlu untuk tindak
lanjut EGD
Somastostatin
Awal: 250 g secara IV
bolus
(bisa
diulang
jika
terjadi perdarahan pada jam
pertama).
Pemeliharaan:
hingga
Isosorbidmononitrat
dilanjutkan
250-500
g/hari
untuk 5 kali dosis terbagi
Awal: 10 mg tiap malam 1.
Hanya digunakan kombinasi
secara oral
dengan NSBB
Maksimal: 20 mg dua kali
2. Meningkat
sehari
sampai
dosis
maksimal toleransi atau Sistolic
Blood Pressure lebih dari 95
Vasopresin
0,5 unit/menit dengan 1.
mm Hg
Harus selalu dugunakan dengan
infus intravena
nitrogiserin untuk menghindari
40 g/menit secara IV
komplikasi iskemik
10 mg dalam 24 jam 2.
Maksimal
secara transdermal
dengan
dan -
Nitrogliserin
durasi
dosis
24
yang
jam
paling
rendah.
3. Jarang digunakan
2.7
Penggunaan Propranolol
Propranolol merupakan golongan -bloker yang pertama kali
digunakan dalam klinik. Mempunyai aktivitas stabilisasi membran. Adanya
39
subtituen cincin naftil yang lebih banyak terletak pada posisi dibanding posisi
menyebabkan kelarutan propranolol dalam lemak tinggi (Siswandono et al, 2000).
Berikut struktur kimia propranolol yang mempengaruhi mekanisme kerjanya.
Gambar 2.8 Struktur Kimia Propranolol (Ashutosh, 2007)
2.7.1 Mekanisme Kerja
Mekanisme kerja propranolol dengan cara memblokade kedua reseptor -1
dan -2. Blokade reseptor -1 dapat menurunkan aliran portal melalui penurunan
curah jantung, blokade reseptor -2 menurunkan aliran portal melalui
vasokonstriksi splanknik dengan melawan aktivitas reseptor -adrenergik.
Pengaruh propranolol pada HVPG adalah dengan pengurangan sampai dengan
31%. Namun, sekitar sepertiga pasien tidak memiliki respon hemodinamik
terhadap propranolol, meskipun studi aliran darah azigos, menunjukkan bahwa
semua pasien memiliki pengurangan aliran porto kollateral. Keberhasilannya
propranolol dalam uji klinis acak (RCT) yaitu, hanya dengan mengurangi tekanan
portal secara sederhana dapat melindungi pasien terhadap perdarahan varises.
Perdarahan varises merupakan suatu komplikasi hipertensi portal paling berat
dengan morbiditas dan mortalitas yang tinggi (Tripathi and Peter, 2013; Minano
and Guadalupe, 2011; Setyoboedi et al, 2006).
2.7.2
Famakodinamik
Mekanisme kerja non selektif -adrenergik bloker (kelas II antiaritmia)
yaitu dengan cara mengeblok secara kompetitif respon -1 dan -2 adrenergik
yang
mengakibatkan penurunan denyut
jantung, kontraktilitas
miokard,
penurunan tekanan darah, dan kebutuhan oksigen miokard. Nonselektif adrenergik blockers (propranolol, nadolol) mengurangi tekanan portal dengan
40
memproduksi vasokonstriksi splanknik (efek -2) sehingga mengurangi aliran
darah portal (Sweetman, 2009).
2.7.3 Farmakokinetik
Propranolol diabsorpsi dengan baik melalui saluran cerna. Pada pemberian
oral efek pengeblokan pada adrenoreseptor selama 1 hingga 2 jam. Lama
kerjanya tergantung pada formulasi sediaan, untuk sediaan immediate realease
mempunyai lama kerja selama 6-12 jam, sedangkan untuk formulasi extended
release mempunyai lama kerja yang cukup lama, yaitu sekitar 24 - 27 jam.
Propranolol terdistribusi luas dalam tubuh, karena sifat kelarutan dalam lemak
tinggi, propranolol mampu melewati plasenta, dan sebagian kecil tersekresi dalam
ASI. Volume distribusinya sekitar 4 L/Kg orang dewasa. Propranolol mempunyai
ikatan protein yang kuat, pada bayi baru lahir sekitar 68% dan pada orang dewasa
90%. Metabolisme utamanya dihati untuk menjadi senyawa yang aktif ataupun
tidak aktif. Bioavailbilitas propranolol sekitar 30,5% sampai 40%. Waktu paruh
eliminasi pada neonatus dan bayi kemungkinan akan terjadi kenaikkan waktu
paruh. Pada anak-anak sekitar 3,9-6,4 jam, pada orang dewasa dengan formulasi
sediaan immediate realease 3-6 jam dan pada sediaan extended realease 8-10 jam.
Propranolol terekskresi dalam urin sekitar 96,5 sampai 99% (Lacy et al, 2009).
2.7.4 Efek Samping
Kardiovaskular: insufisiensi arterial, bradikardia, penyakit jantung
kongestif, hipotensi, gangguan kontraktilitas miokardial, trombosis arteri
mesenterikus (jarang), Raynauds syndrome, perburukan gangguan konduksi A-V;
susunan saraf pusat: amnesia, katatonia, gangguan kognitif, konfusi, depresi,
pusing, emosi labil, fatigue, halusinasi, hipersomnolen, insomnia, letargi, psikosis,
vertigo, mimpi yang jelas; dermatologik: alopesia, eritema multiforme, dermatitis
eksfoliativa, erupsi psoriasiformis, eksaserbasi psoriasis, ruam, Stevens-Johnson
syndrome, nekrolisis epidermal toksik, urtikaria; endokrin & metabolik:
hiperglikemia, hiperkalemia, hipoglikemia (juga menyamarkan tanda-tanda
hipoglikemia, seperti takikardia); gastrointestinal: kram perut, konstipasi, diare,
rasa tidak
nyaman
pada epigastrium,
kolitis
iskemik,
mual,
muntah;
41
genitourinarius: impotensi, Peyronies disease; hematologik: agranulositosis,
purpura nontrombositopenik, purpura trombositopenik; hepatik: peningkatan
enzim hepar; neuromuskular: miopati, miotonia, parestesia, kelemahan otot;
okular: gangguan visual; respiratorius: bronkospasme, dyspnea, laringospasme,
faringitis, gangguan pernapasan, mengi; lain-lain: reaksi anafilaktik/ anafilaktoid,
ekstremitas dingin, reaksi hipersensitivitas, SLE-like syndrome (Tarto S. David,
2003).
2.6.5 Dosis
Terapi profilaksis dimulai dengan penggunaan propranolol 10 mg dua kali
sehari, dan dititrasi dengan penurunan denyut jantung 20% sampai 25%, detak
jantung harus sekitar 55 sampai 60 denyut per menit, atau terjadinya efek samping
yang serius .
Terapi pencegahan perdarahan berulang dapat diberikan propranolol 20
mg tiga kali sehari (atau nadolol, 20 sampai 40 mg sekali sehari) dan dititrasi
secara mingguan untuk mencapai denyut jantung 55 sampai 60 denyut per menit
atau detak jantung 25% lebih rendah dari tingkat denyut jantung awal. Pasien
harus dipantau untuk efek samping gagal jantung, bronkospasme, atau intoleransi
glukosa (Tripathi and Peter, 2013; Minano and Guadalupe, 2011).
2.6.6 Sediaan Obat di Pasaran
Propranolol (Generik) 10 mg dan 40 mg; Blocard (Dupa) 10 mg dan 40
mg; Corbeta (Sanbe Farma) tablet salut selaput 10 mg; Farmadral (Pratapa
Nirmala) tablet salut selaput 10 mg dan 40 mg; Inderal (Astra Zeneca) tablet salut
gula 10 mg, dan 40 mg; Liblok (Holi) 10 mg, 20 mg dan 40 mg; Propadex (Dexa
Medica) 10 mg dan 40 mg (BPOM, 2008).
Anda mungkin juga menyukai
- Cirrhosis HepaticDokumen48 halamanCirrhosis HepaticAndi Nurul IlmiBelum ada peringkat
- Sirosis HatiDokumen33 halamanSirosis Hatisusan lieBelum ada peringkat
- Toksikologi Hasil RevisiDokumen18 halamanToksikologi Hasil RevisiCitra HandayaniBelum ada peringkat
- Laporan Akhir Kimia Klinik SgotDokumen27 halamanLaporan Akhir Kimia Klinik SgotDinda RetnoBelum ada peringkat
- Makalah Hepatitis, Sirosis, Dan KankerDokumen90 halamanMakalah Hepatitis, Sirosis, Dan KankerIdaFajriyahBelum ada peringkat
- Sirosis HepatisDokumen56 halamanSirosis HepatisAnna SidabutarBelum ada peringkat
- Bab 2Dokumen23 halamanBab 2Jefri IrawanBelum ada peringkat
- Referat Sirosis HepatisDokumen34 halamanReferat Sirosis HepatisLivy Leonard Lieswan75% (4)
- Sirosis Hati - Makalah JadiDokumen54 halamanSirosis Hati - Makalah JadiDinny Ria PertiwiBelum ada peringkat
- Bab Ii PDFDokumen32 halamanBab Ii PDFnova rachmanBelum ada peringkat
- AnatomiDokumen5 halamanAnatomiswadowBelum ada peringkat
- 4 Bab II AnfisDokumen20 halaman4 Bab II AnfisClaudius Kevin NapoleonBelum ada peringkat
- Laporan Pendahuluan Sirosis HepatisDokumen21 halamanLaporan Pendahuluan Sirosis HepatisRoma RadiahBelum ada peringkat
- Anatomi Histologi Dan Fisiologi Organ HepatobilierDokumen6 halamanAnatomi Histologi Dan Fisiologi Organ HepatobilierFitrahBelum ada peringkat
- Referat Sirosis HepatisDokumen36 halamanReferat Sirosis HepatisPutri NisrinaBelum ada peringkat
- Referat SIROSIS HEPATIS IPDDokumen22 halamanReferat SIROSIS HEPATIS IPDali akbar mecca100% (1)
- Sasbel SK2 GITDokumen22 halamanSasbel SK2 GITFufuBelum ada peringkat
- Tugas Biokimia Kelas PerbaikanDokumen11 halamanTugas Biokimia Kelas Perbaikansyahrul amiruddinBelum ada peringkat
- Jiptummpp GDL Niniksetya 51056 3 BabiiDokumen45 halamanJiptummpp GDL Niniksetya 51056 3 BabiiFitriaBelum ada peringkat
- Bab 34 Fisiologi Hati Dan AnestesiDokumen26 halamanBab 34 Fisiologi Hati Dan AnestesiKadek Rudita YasaBelum ada peringkat
- LP Sirosis HepatisDokumen28 halamanLP Sirosis HepatisBagas Novan ImandiBelum ada peringkat
- Askep Sistem Metabolik & PankreasDokumen146 halamanAskep Sistem Metabolik & PankreasConnie Fahyuna DaimboaBelum ada peringkat
- MAKALAH HT Penyakit GinjalDokumen25 halamanMAKALAH HT Penyakit GinjalamalBelum ada peringkat
- Makalah PBLDokumen35 halamanMakalah PBLMuhammad Sandy IrwansyahBelum ada peringkat
- DKK 2 B14M4Dokumen28 halamanDKK 2 B14M4aswanfaqihBelum ada peringkat
- Tugas TutorialDokumen23 halamanTugas TutorialDienyBelum ada peringkat
- Marisa Citra Kinasih 22010113130149 Lap Kti Bab 2Dokumen23 halamanMarisa Citra Kinasih 22010113130149 Lap Kti Bab 2Hanik Annur MariaBelum ada peringkat
- Dasar Teori HatiDokumen2 halamanDasar Teori HatiYeyen Annisa0% (1)
- LP Sirosis Hepatis BagasDokumen28 halamanLP Sirosis Hepatis BagasBagas Novan ImandiBelum ada peringkat
- Revisi Abses HeparDokumen45 halamanRevisi Abses HeparAtirah AchmadBelum ada peringkat
- Gambaran Radiologi HepatomaDokumen24 halamanGambaran Radiologi Hepatomamirza_ariandiBelum ada peringkat
- Responsis Sirosis Hepatis CTP B Susp MalignancyDokumen33 halamanResponsis Sirosis Hepatis CTP B Susp MalignancywardatunBelum ada peringkat
- Anatomi Dan Fungsi HeparDokumen3 halamanAnatomi Dan Fungsi HeparSwara Wida ShaktiBelum ada peringkat
- Anatomi HeparDokumen4 halamanAnatomi HeparBagus AnomBelum ada peringkat
- Refrat Hipertensi Portai BLM EditDokumen35 halamanRefrat Hipertensi Portai BLM EditArwindy AlmarBelum ada peringkat
- Ascites Pada Sirosis Hepatis (RSGR Referat)Dokumen28 halamanAscites Pada Sirosis Hepatis (RSGR Referat)Yustinus TeddyBelum ada peringkat
- Anatomi HeparDokumen8 halamanAnatomi HeparFayrus Ummu Yasmine RistumadinBelum ada peringkat
- Referat Hipertensi Portal Dan Koma Hepatikum PD Sirosis HepatisDokumen25 halamanReferat Hipertensi Portal Dan Koma Hepatikum PD Sirosis HepatisBambang HadyBelum ada peringkat
- Sirosis HepatisDokumen31 halamanSirosis HepatisTasdik SyadikinBelum ada peringkat
- Bab 7 DKDokumen99 halamanBab 7 DKmarthagusnadiBelum ada peringkat
- Anatomi Faal Histo Dari HeparDokumen5 halamanAnatomi Faal Histo Dari HeparRahmat ZulkarnainBelum ada peringkat
- Materi Kuliah Patologi Klinik, Abdul Majid ANATOMI DAN FUNGSI HATIDokumen24 halamanMateri Kuliah Patologi Klinik, Abdul Majid ANATOMI DAN FUNGSI HATIValdaBelum ada peringkat
- SH SlesaiDokumen50 halamanSH SlesaiEfa Imama Nur MaulinaBelum ada peringkat
- LP Sirosis HepatisDokumen34 halamanLP Sirosis HepatisRizkainna SafitriBelum ada peringkat
- PAPDI 98-121 HepatobilierDokumen131 halamanPAPDI 98-121 HepatobilierEdward Arthur Iskandar100% (1)
- Pengertian HatiDokumen32 halamanPengertian HatiIndah RumBelum ada peringkat
- Anatomi Dan Fisiologi HatiDokumen6 halamanAnatomi Dan Fisiologi HatiEllaBoendaezGwijogBelum ada peringkat
- Hepatitis FulminanDokumen24 halamanHepatitis FulminanVena50% (2)
- Bab Ii-6Dokumen19 halamanBab Ii-6Arryo P SudharyanaBelum ada peringkat
- Sirosis HepatisDokumen25 halamanSirosis HepatisNurul SakinahBelum ada peringkat
- HeparDokumen4 halamanHeparEkaBelum ada peringkat
- Refrat Hepatitis Alkoholik New 2Dokumen20 halamanRefrat Hepatitis Alkoholik New 2reda_adhyBelum ada peringkat