Refrat Hipertensi Portai BLM Edit
Diunggah oleh
Arwindy AlmarJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Refrat Hipertensi Portai BLM Edit
Diunggah oleh
Arwindy AlmarHak Cipta:
Format Tersedia
1
BAB I PENDAHULUAN Pada sirosis hepatis, perubahan sirkulasi hemodinamik hipertensi portal berkontribusi secara signifikan ke seluruh manifestasi klinik penyakit tersebut. Pada fisiopatologi perubahan vaskuler ini, vasodilatasi splanchnic mesenterika memainkan peran penting dengan mengawali proses hemodinamik. Beberapa penelitian menunjukkan pasien sirosis dan hewan uji memperlihatkan bahwa vasodilatasi spanchnic adalah hasil dari peningkatan penting di vasodilatasi sistemik dan local serta kehadiran dari hiporesponsifitas vascular splanchnic ke vasokonstriktor. Dari beberapa molekul dan factor yang diketahui akan mempengaruhi secara potensial di vasodilasi arterial, nitric oksida diketahui mempunyai peran sangat penting di fisiopatologi perubahan vaskuler ini. Bagaimanapun juga, tidak satupun dari varietas mediator yang sangat banyak ini dapat dideskripsikan sebagai bagian yang semata-mata langsung bertanggungjawab, sejak fenomena yang ditemukan sudah multifactor. Sebagai tambahan, angiogenesis dan proses remodeling vascular juga dapat dilihat mempunyai peran penting. Akhirnya, system syaraf simpatis di dalam pathogenesis sirkulasi hiperdinamik yang berhubungan dengan hipertensi portal, walaupun keaslian dan masa depan dari peranan tersebut belum sepenuhnya dimengerti. Pada bahasan kali ini, kita akan mendiskusikan mekanisme yang berbeda yang diketahui berkontribusi pada fenomena kompleks ini. Hipertensi portal didefinisikan sebagai peningkatan tekana vena porta yang menetap diatas nilai normal yaitu 6 sampai 12 cm H2O. Tanpa memandang penyakit dasarnya, mekanisme primer penyebab hipertensi portal adalah peningkatan resistensi terhadap aliran darah melalui hati. Selain itu biasanya terjadi peningkatan aliran arteria splangnikus. Kombinasi kedua faktor yaitu menurunnya aliran keluar melalui vena hepatika dan meningkatnya aliran masuk bersama sama menghasilkan beban berlebihan pada sistem portal. Pembebanan berlebihan sistem portal inimerangsang timbulnya aliran kolateral guna menghindari obstruksi hepatik (varises). Tekanan
balik pada sistem portal menyebabkan splenomegali dan sebagian bertanggungjawab atas tertimbulnya asites. Asites merupakan penimbunan cairan encer intraperitoneal yang mengandung sedikit protein. Faktor utama patogenesis asites adalahpeningkatan tekanan hidrostatik pada kapiler usus (hipertensi porta) dan penurunan tekanan osmotik koloid akibat hipoalbuminemia. Faktor lain yang berperan adalah retensi natrium dan airserta peningkatan sintesis dan aliran limfe hati.Saluran kolateral penting yang timbul akibat sirosis dan hipertensi portal terdapat pada esofagus bagian bawah. Pirau darah melalui saluran ini ke vena kava menyebabkan dilatasi vena-vena tersebut (varises esofagus). Varises ini terjadi pada sekitar 70% penderita sirosis lanjut. Perdarahan dari varises ini sering menyebabkan kematian.Sirkulasi kolateral juga melibatkan vena superfisial dinding abdomen, dan timbulnya sirkulasi ini menyebabkan dilatasi vena-vena sekitar umbilikus (kaput medusa). Sistem vena rektal membantu dekompensasi tekanan portal sehingga vena-vena berdilatasi dan dapat menyebabkan berkembangnya hemoroid interna. Perdarahan dari hemoroid yang pecah biasanyatidak hebat, karenatekanadi daerah ini tidak setinggi tekanan pada esofagus karena jarak yang lebih jauh dari vena porta.Splenomegali pada sirosis dapat dijelaskan berdasarkan kongesti pasif kronis akibat aliran balik dan tekanan darah yang lebih tinggi pada vena linealis. Tujuan dari penyusunan referat ini adalah mempelajari patofisiologi vasodilatasi pada lien(splanchnic) pada hipertensi portal yang terjadi pada pasien sirosis hepatis. kompetensi seorang ahli penyakit dalam.
BAB II ANATOMI DAN FISIOLOGI HATI
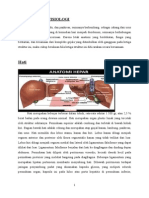
A. Anatomi hati Hati adalah organ intestinal terbesar dengan berat antara 1,2-1,8 kg atau kurang lebih 2,5 % berat badan orang dewasa dan merupakan pusat metabolisme tubuh dengan fungsi sangat kompleks yang menempati sebagian kuadran kanan atas abdomen. Batas atas hati berada sejajar dengan ruang interkostal V kanan dan batas bawah menyerong ke atas dari iga IX kanan ke iga VIII kiri. Permukaan posterior hati berbentuk cekung dan terdapat celah transversal sepanjang 5 cm dari sistim porta hepatis. Omentum minor terdapat mulai dari sistem porta yang mengandung arteria hepatika, vena porta, dan duktus koledokus. Sistem porta terdapat di depan vena kava dan di balik kandung empedu.(11)
Gambar 1.Hati dan sistem bilier (12) Permukaan anterior yang cembung dibagi menjadi dua lobus oleh adanya perlekatan ligamentum falsifarum yaitu lobus kiri dan lobus kanan yang berukuran
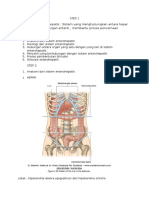
kira-kira 2 kali lobus kiri. Pada daerah diantara ligamentum falsifarum dengan kandung empedu di lobus kanan, kadang-kadang dapat ditemukan lobus kaudatus dan sebuah daerah yang disebut sebagai lobus kuadratus yang biasanya tertutup oleh vena kava inferior dan ligamentum venosum pada permukaan posterior. Hati terbagi menjadi 8 segmen dengan fungsi yang berbeda-beda. Pada dasarnya garis Cantlie yang terdapat mulai dari vena kava sampai kandung empedu telah membagi hati menjadi dua lobus fungsional, dan dengan adanya daerah dengan vaskularisasi lebih sedikit, kadang-kadang dijadikan batas reseksi. Pembagian lebih lanjut menjadi 8 segmen didasarkan pada pedicle pembuluh darah, dan saluran empedu yang dimiliki oleh masing-masing segmen. (13)
Gambar 2. Pembagian hati persegmental (RHV=Vena hepatica dekstra, MHV=Vena Hepatika Media, LHV=Vena Hepatika Sinistra, IVC= Vena Cava Inferior) (13)
Gambar 3. Lobulus hati(13)
Secara mikroskopik didalam hati manusia terdapat 50.000 100.000 lobuli, setiap lobulus berbentuk heksagonal, yang terdiri atas sel hati yang berbentuk kubus yang tersusun radial mengelilingi vena sentralis. Di antara lembaran sel hati terdapat kapiler yang disebut sinusoid yang merupakan cabang vena porta dan arteria hepatika. Sinusoid dibatasi oleh sel fagositik (sel Kupffer) yang merupakan sistem retikuloendotelial dan berfungsi menghancurkan bakteri dan benda asing lain di dalam tubuh.(14) Selain cabang vena porta dan arteria hepatika yang mengelilingi bagian perifer lobulus hati, juga terdapat saluran empedu yang berjalan di antara lembaran sel hati.(15)
Gambar 4. Histologi hati normal(15) Secara histologi hati terdiri atas bermacam-macam sel. Hepatosit meliputi 60 % sel hati, sedangkan sisanya terdiri atas sel-sel epitelial sistem empedu dalam jumlah yang bermakna dan sel-sel non parenkimal yang termasuk di dalamnya endotelium, sel Kupffer, dan sel Stellata yang berbentuk seperti bintang. (13) Hepatosit sendiri dipisahkan oleh sinusoid yang tersusun melingkari eferen vena hepatika dan duktus hepatikus. Saat darah memasuki hati melalui arteria hepatika dan vena porta menuju vena sentralis maka akan didapatkan pengurangan oksigen secara bertahap. Sebagai konsekuensinya akan didapatkan variasi penting kerentanan jaringan terhadap kerusakan asinus. Membran hepatosit berhadapan langsung dengan sinusoid
yang mempunyai banyak mikrofili. Mikrofili juga tampak pada sisi lain sel yang membatasi saluran empedu dan merupakan penunjuk tempat permulaan sekresi empedu. Permukaan lateral hepatosit memiliki sambungan penghubung dan desmosom yang saling bertautan dengan sebelahnya.(15)
Gambar 5. Sinusoid hati(13) Sinusoid hati memiliki lapisan endotelial berpori yang dipisahkan dari hepatosit oleh ruang Disse (ruang perisinusoidal). Sel-sel lain yang terdapat dalam dinding sinusoid adalah sel fagositik Kupffer yang merupakan bagian penting sistem retikuloendotelial dan sel Stellata (juga disebut sel Ito, liposit atau perisit) yang memiliki aktifitas mikrofibroblastik yang dapat membantu pengaturan aliran darah sinusoidal disamping sebagai faktor penting dalam perbaikan kerusakan hati. Peningkatan aktivitas sel Stellata tampaknya menjadi faktor kunci dalam pembentukan fibrosis di hati.(13,15) B. Fisiologi hati Hati mempunyai fungsi yang sangat beragam. Sirkulasi vena porta yang menyuplai 75 % dari suplai asinus memegang peranan penting dalam fisiologi hati, terutama dalam hal metabolisme karbohidrat, protein dan asam lemak. Telah
dibuktikan bahwa zona-zona hepatosit yang memperoleh oksigenasi yang lebih baik yaitu pada zona 1 mempunyai kemampuan glukogenesis dan sintesis glutation lebih baik dibandingkan dengan zona 3.(13)
Gambar 6. Zona Hepatosit (11) Hasil metabolisme monosakarida dari usus halus diubah menjadi glikogen dan disimpan dihati (glikogenesis). Dari depot glikogen ini disuplai glukosa secara konstan kedarah (glikogenolisis) untuk memenuhi kebutuhan tubuh. Sebagian glukosa di metabolisme sebagian besar ke dalam jaringan untuk menghasilkan tenaga dan sisanya diubah menjadi glikogen (yang disimpan didalam otot) atau lemak (yang disimpan di dalam jaringan subkutan).(11) Fungsi metabolisme protein adalah menghasilkan protein plasma berupa albumin (yang diperlukan untuk mempertahankan tekanan osmotik koloid), protrombin, fibrinogen, dan faktor pembekuan lainnya. Fungsi metabolisme lemak adalah menghasilkan bentukan lipoprotein, kolesterol, fosfolipid dan asam asetosalisilat.(13)
Gambar 7. Metabolisme bilirubin(11) Fungsi utama hati adalah pembentukan dan ekskresi empedu. Hati mengekskresikan empedu sebanyak satu liter per hari kedalam usus halus. Unsur utama empedu adalah air (97%), elektrolit, garam empedu. Walaupun bilirubin atau pigmen empedu merupakan hasil akhir metabolisme, dan secara fisiologis tidak mempunyai peran aktif, tapi penting sebagai indikator penyakit hati dan saluran empedu, karena bilirubin dapat memberikan warna pada jaringan dan cairan yang berhubungan dengannya.(13) Dalam regenerasi organ hati, berbeda dengan organ padat lainya, hati orang dewasa tetap mempunyai kemampuan untuk beregenerasi. Ketika kemampuan hepatosit untuk regenerasi sudah terbatas, maka sekelompok sel pluripotensial oval yang berasal dari duktulus-duktulus empedu akan berproliferasi sehingga terbentuk kembali sel-sel hepatosit dan sel-sel bilier yang tetap mempunyai kemampuan untuk beregenerasi.(6) Sampai dapat dikatakan sangatlah memungkinkan untuk melakukan hepatektomi hingga 2/3 dari seluruh hati. Dari segi imunologi, hati merupakan komponen sentral sistem imun, Sel Kupffer, yang meliputi 15 % dari massa hati serta 80% dari total populasi fagosit tubuh, merupakan sel yang sangat penting dalam menanggulangi antigen yang berasal dari luar tubuh dan mempresentasikan antigen tersebut kepada limfosit.(15)
BAB III PATOFISIOLOGI VASODILATASI LIEN PADA HIPERTENSI PORTAL
A. Definisi Hipertensi portal Hipertensi portal didefinisikan sebagai peningkatan patologis dari tekanan vena portal dan hal ini didiagnosa ketika peningkatan tekanan vena hepatic (hepatic venous pressure gradient / HVPG) di atas dari angka normal (1-5 mmHg). HVPG ditaksir dari penelitian hemodinamik hepar melalui kateterisasi vena suprahepatik dan menilai perbedaan tekanan antara vena porta dan vena cava inferior. Sirosis hepatis adalah penyebab paling banyak yang menyebabkan hipertensi portal di Negara barat. Ketika HVPG meningkat hingga 10 mmHg atau lebih, sirosis hipertensi portal menghasilkan beberapa komplikasi antara lain asites, hepatorenal sindrom, ensephalopati hepatikum dan perdarahan dari varises esophagus. Dua factor utama yang berkontribusi membangun dan memelihara hipertensi portal : resistensi vascular bergantung kepada kesulitan outflow darah portal ke vena hepatis dan meningkatnya aliran darah splanchnic (sindrom hiperdinamik). Hipertensi portal juga dihubungkan dengan formasi kolateral vena portosistemik yang diusahakan untuk dekompresi system vena portal. Bagaimanapun juga, sirkulasi kolateral memimpin ke generasi dari varises yang mana yang berkontribusi pada angka kesakitan dan kematian penyakit ini. B. PATOFISIOLOGI HIPERTENSI PPORTAL Penggunaan hukum Ohm di sistem vena porta : P = Q x R, lalu peningkatan tekanan portal (P), adalah hasil dari produk aliran darah dalam system vena porta seluruhnya (Q) dan hambatan vascular pada system vascular yang sama (R), termasuk vaskuler hepatis dasar dan kolateral porto sistemik. Jadi, hipertensi porta disebabkan oleh kenaikan aliran darah, kenaikan hambatan atau kedua-duanya terjadi bersamaan. Mekanisme awal yang
10
bertanggungjawab pada hipertensi portal adalah kenaikan hambatan hepatis, terutama dari hasil hambatan mekanis. Stadium selanjutnya, kenaikan aliran darah splanchnic bertanggungjawab kepada hiperdinamik nilai sirkulasi, yang berkontribusi pada pemeliharaan dan perburukan dari beberapa komplikasi dari sirosis dan hipertensi portal.
Gambar 8.Mekanisme pathofisiologi pada hipertensi portal Kenaikan hambatan vaskuler terhadap aliran darah porta Hambatan vaskuler di aliran darah porta tergantung pada dua factor, yaitu hambatan intrahepatal dan hambatan yang dibangkitkan oleh sirkulasi kolateral/ sirkulasi tambahan. Kenaikan hambatan vaskularitas intrahepatal (the increase intrahepatic vasculature resistance/ IHVR) ke aliran darah porta adalah factor utama dan factor penting hipertensi portal sekunder mengarah ke sirosis hepatis.
11
Hambatan intrahepatal Penyimpangan stuktural dari vaskularisasi intrahepatis, seperti fibrosis, jaringan parut dan thrombosis vakuler, dipertimbangkan sebagai penyebab utama dari kenaikan IHVR. Mekanisme seluler terdiri dari formasi fibrosis dan sirhosis. Dari respon kerusakan hepatoseluler, sel stellat/ sel bintang hepatis diaktivasi dan fenotip sel diubah dari sel diam menjadi sel myofibroblast-like (sel mirip dengan miofibroblas). Hasil dari aktivasi sel stellat hepatis, kolagenisasi/ kapilarisasi dari Space and Disse akan terjadi, dan hepar yang rusak akan menjadi sirhosis. Penelitian yang diawali dari Bathal dan Groszmann, berdasarkan hasil dari hewan uji tikus, mendemonstrasikan bahwa dengan tambahan perubahan struktur, komponen dinamik, dihasilkan oleh elemen kontraktil dari dasar vaskuler hepatis, mungkin berkontribusi pada kenaikan sifat vaskuler intrahepatal. Hasil dari modifikasi komponen tersebut memperlihatkan 40% dari total IHVR. Pada sirhosis hepatis, kenaikan produksi vasokonstriktor dan kekurangan pelepasan vasodilator, dalam kombinasi dari respon berlebihan vasokonstriktor dan kekurangan respon vasodilatasi dari dasar vaskuler hepatal, adalah mekanisme yang bertanggungjawab pada kenaikan komponen dinamik IHVR/ hambatan intrahepatal. Dari seluruh ekspresi vasokonstriktor yang berlebihan, endothelin/ ET memainkan peran penting dalam peningkatan sifat vaskuler di sirhosis hepatis. Pasien dengan sirhosis hepatis memperlihatkan kenaikan konsentrasi plasma ET-1 dan ET-3. Jadi, bukan hanya level ET-1 hepatis saja, tapi densitas reseptor ET juga mengalami kenaikan pada hepar tikus yang sirhosis. Reseptor ETA ditemukan pada sel otot halus, menyebabkan vasokonstriksi, dimana resptor subtype ET B berlokasi pada sel endothelial, menginduksi vasorelaksasi dengan menstimuli sintase nitrikoksida endotel (endothelial nitric oxcide synthase/ eNOS). Beberapa penelitian difokuskan ke terapi blockade ET. Bagaimanapun juga, dengan hasil yang berbalikan
12
dengan apa yang diharapkan, stimulasi reseptor ET B oleh administrasi agonis ETB, menghasilkan kenaikan tekanan porta pada hewan uji tikus sirhosis. Efek dari antagonis ETA dalam mengurangi tekanan porta pada tikus sirhosis terhitung controversial. Dengan penambahan endotelin, factor lain yang berkontribusi pada IHVR adalah produksi S-lipoxygenase (cysteinylleukotriene) dan cyclooxygenase pathways (thromboxane A2), angiotensin II dan system simpatis. Dengan penambahan produksi vasokontriktor yang berlebihan, produksi vasodilator intrahepatal, terutama nitric oxide (NO), menyisakan insufisiensi hepar yang sirhosis. NO adalah vasodilator poten yang memproduksi Larginin oleh NOS yang berbeda. Walaupun pada hepar terdapat eNOS dan isoform NOS induktabel (inducible NOS/ iNOS) yang dapat diaktifkan, observasi insufisiensi produksi NO hepatis pada sirhosis hepatis dihubungkan ke isoform endothelial. Karena mRNA dan level protein eNOS ditemukan dalam jumlah yang sama pada hepar yang normal dan hepar yang sirhosis, produksi NO ini dihubungkan dengan disfungsi post translasi aktivitas eNOS. Dengan kata lain, peningkatan ekspresi caveolin (protein penghambat eNOs) dan di sisi yang lain, penurunan fosforisasi eNOS terhadap abnormalitas pensinyalan Akt (protein kinase B), adalah mekanisme yang dimungkinkan dapat menjelaskan penurunan aktivitas eNOS di sirhosis hepatis. Dengan tambahan penurunan aktivitas NOS, peningkatan degradasi NO juga bertanggungjawab pada pengurangan bioavaibilitas NO. Sejak superoksida (superoxide/ O 2) dapat bereaksi dengan NO untuk meregenerasi peroksinitrit (peroxinitrite/ ONOO), bioavaibilitas NO dapat dikurangi jika level O 2 dinaikkan dengan konsekuensi aktivitas dismutase superoksida dikurangi. Tentu saja, injeksi porta adenovirus yang berisikan gene encoding dimutasi superokside mengurangi tekanan portal dengan menaikkan bioavaibilitas NO pada hewan uji tikus sirhosis.
13
Gambar 9.Patofisiologi hipertensi portal:pada sirosis hepatis,factor awal pada hipertensi portal adalah peningkatan resistensi vascular intra heppetal (R),dimana peningkaatan aliran darah portal (F) adalah fenomena yang kedua yang terjadi dan memperburuk kenaikan tekanan portal dan meningkatkan sindrom sirkulasi hiperdinaamik.Ditampilkan faaktor yang berbeda yang melibatkanmekanisme yang jelas pada hipertensi portal. AII :angiotensin II; AEA :anandamide; AM:adrenomudullin; CGRP: calcitonine gene related peptide; CO: carbon monoksida; ET:endotellin; H2S: hydrogen sulfide; LT: leukotrenes; NE :norepinepprine; NO: nitric oxide; PGI2: prostasiclin; SP:substance P ; TXA2:thromboxane A2.
14
Sirkulasi tambahan Kenaikan tekanan portal memainkan peran penting pada hubungan antara pembuluh darah porta dan sirkulasi tubuh. Usaha ini untuk menurunkan tekanan vena porta sebelaum menjadi komplikasi yang serius, seperti ensefalopati hepatikum dan varises esophagus. Telah dilaporkan bahwa shunt porto sistemik menghasilkan aliran darah porta yang keluar dari hepar sangat porta. besar, Formasi hambatan tambahan vaskuler system pada porto, pembuluh yang darah ini yang dari dimungkinkan berperan penting menaikkan hambatan vaskuler system vena mana terdiri neovaskularisasi dan terbukanya pembuluh darah yang telah ada, akan menjadi angiogenetik-dependen/ ketergantungan angiogenetik. Angiogenesis dimediasi terutama oleh factor pertumbuhan vaskuler endothelial/ the vascular endothelial growth factors (VEGF). Fernandez dkk mendemonstrasikan bahwa antibody monoclonal reseptor-2 anti-VEGF melindungi formasi pembuluh darah tambahan porto-sistemik pada hewan tikus putih dengan hipertensi porta. Lebih lanjut, sejak NAD(P)H dibutuhkan untuk angiogenesis VEGF-induced/ induksi VEGF, blockade oksidasi NAD(P)H mengurangi formasi tambahan porto-sistemik secara signifikan. Beberapa penulis mengatakan hal yang sama bahwa tikus dengan hipertensi porta yang diobati hambatan VEGF dan platelet derived growth factor (PDGF) berkurang penambahan system porto-nya secara signifikan. Penggunaan Sorafenib, hambatan proangiogenic reseptor-2 VEGF dan PDGF reseptor- poten, pada hewan uji dengan hipertensi porta, menginduksi hambatan penurunan porto-sistemik, neovaskularisasi ditandai splanchnic dan menaikkan splanchnic dengan perlemahan
hiperdinamik dan system sirkulasi. Kenaikan aliran darah splanchnic Sirkulasi splanchnic adalah pembuluh darah utama yang bertanggungjawab atas menurunnya hambatan vaskuler pada kejadian hipertensi porta.
15
Kenaikan aliran darah splanchnic pada hipertensi porta adalah hasil dari vasodilatasi dari arteri organ splanchnic, yang mana mengalirkan darah dari system vena porta. Kenaikan aliran darah dari organ splanchnic dan kenaikan aliran vena portal setelah itu, bersama dengan kenaikan hambatan aliran portal, semakin memperburuk sindrom hipertensi portal. Kenaikan produksi atai aktivasi system terhadap splancnic. Sirkulasi hiperdinamik Angka sirkulasi hiperdinamik dari hipertensi portal ditentukan oleh vasodilatasi perifer dan lien, kenaikan plasma volume dan kenaikan cardiac output.5 Sirkulasi hiperdinamik lien dimediasi sebagai bagian dari vasodilatasi aterial, tapi vasodilatasi saja tidak cukup untuk membuat sirkulasi menjadi hiperdinamik. Ini harus dikombinasikan antara vasodilatasi arterial dengan ekspansi volume darah yang menyediakan kondisi optimal untuk mempertahankan keadaan sirkulasi yang hiperdinamik pada hipertensi portal.35,36 (gambar 1) Vasodilatasi arterial di pembuluh darah perifer dan sirkulasi lien akan membuat penurunan volume darah sentral. Hipovolemia arterial relative akan menstimuli reseptor volume kardiopulmoner dan baroreseptor arteri, mengaktivasi system saraf simpatis, system 15etaboangiotensin-aldosteron dan vasopresor arginin (hormone antidiuretik). Mediator system diketahui dari hasil retensi sodium atau cairan di ginjal, dan akibatnya, ekspansi volume plasma. Retensi sodium akan menaikan reabsorpsi tubular tehadap sodium, dimediasi oleh reseptor untuk aldosteron, angiotensin dan stimulus alpha-adrenergic. Penurunan ekskresi air tergantung dari kenaikan sekresi 15etabol antidiuretik.37 hiperaemia dan mediator vasodilator, dan penurunan Sebagai tambahan, kenaikan reaktifitas vaskuler untuk berkonstriksi, adalah hal yang bertanggungjawab (vasodilatasi). angiogenesis dimungkinkan berkolaborasi dalam kenaikan aliran darah
16
Efek yang berbahaya dari sirkulasi hiperdinamik ini tidak terbatas pada sirkulasi lien saja, akan tetapi juga berefek pada jantung (peningkatan cardiac output), paru-paru (sindrom hepatopulmonary), dan sirkulasi ke cerebral (koma hepatikum akut).38,39 Organ lain yang mungkin dipengaruhi secara tidak langsung yaitu ginjal dan otak (ensephalopati kronik) karena vasodilatasi sirkulasi lainnya.5 Hewan uji Perkembangan eksperimental dengan model untuk mempelajari perubahan hipertensi portal sangat penting untuk mengetahui gejala-gejalanya. Percobaan awal yang dilakukan adalah eksperimen Chojkier dan Groszmann dalam membuat model portal-vein ligated (PVL) parsial, yang dijadikan prinsip dasar untuk mempelajari patofisiologi hipertensi portal. 3,40 Pada model ini, vena porta diisolasi dan dibuat stenosis dari ikatan tunggal dengan jarum blunt-tipped gauge no.20 yang dibuat sepanjang vena porta. Berikutnya, pencabutan jarum menghasilkan kalibrasi stenosis dari vena porta. Model PVL menghasilkan seluruh 16etaboli dan abnormalitas hemodinamik terdeteksi di hipertensi portal dan status sirkulasi hiperdinamik: tekanan porta dan kenaikan aliran portal, kejadian shunt porto-sistemik, vasodilatasi lien dengan penurunan hambatan arteri lienalis dan kenaikan aliran lien, vasodilatasi sistemik dengan hipotensi arteri, penurunan hambatan perifer total dan kenaikan cardiac output.40 Model ini homogenisasi secara menakjubkan, dapat dibuat dan secara kronologis dapat diprediksi secara tepat. Hal tersebut membuat uraian teori dari rangkaian kejadian yang terdiri dari generasi sindrom hiperdinamik. 41,42 Shunting porto-sistemik dapat dideteksi 2 (dua) hari setelah bedah PVL dan persentase pemindahan aliran darah porta dialihkan ke sirkulasi tambahan mencapai 100% setelah 1 (satu) minggu.42 Sirkulasi menjadi hiperedinamik 4-5 hari setelah PVL dan 1 minggu setelah ligasi vena porta, tikus uji menunjukkan range yang komplet dari
17
hipertensi porta dengan sindrom sirkulasi hiperdinamik dan formasi shunting porto-sistemik. Meskipun model PVL mudah digunakan dan dapat diproduksi, hewan uji tikus dengan sirhosis yang disebabkan oleh mekanisme yang berbeda (biasanya oleh ligasi duktus kandung empedu dan adanya karbontetraklorida) lebih mirip dengan kejadian sirhosis pada manusia, sejak penyampaian seluruh perubahan hemodinamik pada hipertensi porta, perubahan tersebut termasuk metabolic, infeksius dan komplikasi lain yang meningkatkan penyakit liver.
36,43
Hasil yang didapatkan dari tikus dengan PVL selalu diuji dengan model
sirhosis seperti ini. Mekanisme vasodilatasi pada lien Sifat vaskuler arteri ini ditentukan oleh keseimbangan anatara efek dari vasoaktif molekul yang bereaksi pada vaskularisasi otot halus. Seperti yang telah disebutkan, peningkatan konsentrasi vasodilator sirkulasi dan peningkatan produksi endothelial dari vasodilator local, juga penurunan respon vascular terhadap vasokokonstriktor endogen telah diobservasi di pembuluh darah lien pada hipertensi portal. 36 (gambar 1) Antara molekul dan factor yang diketahui menjadi potensial terdiri dari vasodilatasi arterial, tidak satupun dari mereka yang dapat disebutkan sebagai hal yang bertanggungjawab, sejak fenomena dari hipertensi porta ini multifaktorial. 44 Nitritoksida Nitritoksida (NO), factor pelepasan yang diturunkan dari endotel, dirancang sebagai molekul vasodilator yang sangat penting yang menengahi vasodilatasi arteri yang berlebihan pada hipertensi porta. 45 Hal ini, seperti yang disebut oleh Vallance dan Moncada, 46 telah dikonfirmasi beberapa penelitian lainnya. Pada pasien sirhosis, peningkatan level nitrat dan nitrit, hasil degradasi dari oksidasi NO, 47 telah diteliti. Pada system vaskuler splanchnic tikus uji dengan hipertensi portal, overproduksi NO telah diuji
18
bertanggungjawab kepada hiposensitifitas vasopresor. 48 Lebih jauh, inhibisi produksi NO mengurangi shunting portosistemik dan melindungi secara luas pembentukan sirkulasi hiperdinamik. 49 NO diproduksi dari L-arginin oleh enzim NOS, membentuk radikal bebas NO dan sitrulin sebagai hasil tambahan. NO memiliki daya tahan rendah dan sangat cepat dalam beroksidasi menjadi stabil, menginaktifkan produk akhir, nitrit dan nitrat. 51 Mekanisme yang menyebutkan NO menyebabkan vasodilatasi melalui stimulasi dengan soluble guanylyl cyclase (sGC) untuk menghasilkan cyclic guanosine monophosphate (cGMP) di vaskuler otot halus.52 (gambar 2).Tiga isoform yang diketahui memproduksi NO: isoform yang didapat, eNOS 53 dan NOS neuronal (nNOS),54 dan iNOS55 yang secara mengejutkan tidak terlihat pada pengingkatan produksi NO di kasus sirhosis. 56 Sumber enzim mayor di overproduksi NO vaskuler menjadi eNOS. 57 Pada hewan uji (tikus PVL), hal tersebut telah diteliti bahwa pengaturan eNOS mengawali perubahan sirkulasi hiperdinamik.45 Beberapa bukti selanjutnya menyarankan bahwa nNOS juga ditemukan di aorta58 dan arteri mesenterika,59 berperan penting pada pembentukan sirkulasi hiperdinamik splanchnic di eksperimen sirhosis. 18etaboli endotel, eNOS diaktivasi oleh kalsium, calmodulin (Ca 2+/CaM) sebagai respon kenaikan sitosolik Ca 2+ dan dengan fosforilasi dari eNOS pada beberapa bagian.60,61 Upregulasi awal dari eNOS dimulai dari tingkat post-translasi oleh fosforilasi eNOS 62 yang dimediasi oleh Akt,62 yang mana meningkatkan aktivitasnya di berbagai konsentrasi kalsium. 63 Selama stadium sirhosis awal, jalur ini distimulasi oleh berbagai stimulus yang berbeda, seperti VEGF (vascular endothelial growth factors), sitokin inflamasi dan kekuatan mekanis yang memotong jalur stressor. 63-65 Mekanisme ini terdiri dari interaksi kenaikan eNOS dengan molekul regulator positif chaperone heat shock protein 90 (Hsp90).66 Selanjutnya, dalam tahap sirhosis hepatis, translokasi bakteri mengaktifkan eNOS sepanjang tumor nekrosis factor alfa (TNF-) dependen yang naik oleh tetrahidrobiopterine, 67,68 (gambar 2) sebagai kofaktor eNOS. Hal ini disebutkan sesuai dengan penelitian yang
19
terdahulu, mekanisme lain seperti perubahan lokalisasi subseluler dari eNOS,69 S-nitrosilasi70-71 atau dimetilarginin asimetris yang terdegradasi enzyme mungkin dipengaruhi oleh regulasi aktivitas eNOS. 72 Sebagai ringkasan, mekanisme yang berbeda seperti komplek protein-protein interaksi dan post-tranlasi modifikasi, telah dilaporkan sebagai upregulasi eNOS pada hipertensi porta.73
Gambar 10.Jalur molekuler pada vasodilatasi lien. Mollekul vasoaktif terdapat pada tekanan vaskuler arteri di sirculasi lien.nitrit oksida(NO).karbon monoksida(CO),prostasiklin(PGI 2),atau hydrogen sulfide(H2S),melalui jalur yang berbeda,menyebabkan vasodilatasi di sel otot polos vascular melalui soluble guanylate cyclase (sGC) menjadi cyclic guanosin monophosphate (cGMP),menstimuli adenylate cyclase (AC) dan cyclic adenosine monophosphat (cAMP) atau melalui pembukaan kanal
20
K-ATP,anadamid mengaktifkan reseptor 1 kanabinoid endotel (CB1R) untuk bervasodilatasi.AA:arachidonic acid; AC:adenylyl cyclase; Akt:protein kinase B; BH4: tetrahydrobiopterin; CaM: calmodulin; CSE: cystathionine- -lyase; COX: cyclooksigenase; eNOS: endotileal nitric okside synthase; HSP 90: heat shock protein 90; IP3: inositol triphosphate; TNF : tumor nekrosis factor ; VEGF:vascular endothelial growth factor. Vasodilator parakrin lainnya Sebagai tambahan untuk NO, vasodilator autokrin atau parakrin laninnya telah dideskripsikan sebagai hal yang mungkin bertanggungjawab pada pathogenesis sirkulasi hiperdinamik yang berhubungan dengan hipertensi porta. Karbonmonoksida. Karbonmonoksida (CO) adalah molekul gas yang diproduksi oleh oksigenasi heme (HO) selama metabolism heme menjadi biliberdin IX, 74 CO, dengan pola yang sama dengan NO pada sirhosis, telah dipercaya sebagai hal yang merelaksasi sel otot polos melalui aktivasi NO yang tergantung oleh sGC., sebagai hasil dari kenaikan produksi cGMP. Walaupun CO bukan mediator yang sekuat NO,75 perannya dalam hipertensi porta telah diakui. 76 CO yang diinduksi vasodilatasi dapat terjadi lewat Ca 2+ yang diaktivasi kanal potassium.77 Pada hipertensi porta, isoform yang diinduksi HO, HO-1, diperlihatkan sebagai upregulasi di sistemik dan sirkulasi arteri lienalis, 78 walaupun mekanisme aktivasi telah dimengerti seluruhnya. Prostasiklin Prostasiklin (PGI2) adalah hasil sintesa siklooksigenase dan dilepaskan dari endotel untuk mempromosikan relaksasi otot polos dengan aktivasi adenilsiklase dan menambah tingkat intraseluler siklik adenosine monofosfat.79 Kenaikan tingkat sirkulasi PGI2 telah diteliti pada pasien
21
sirhosis80 dan kelinci dengan hipertensi porta 81, didukung dengan peran prostaglandin pada pathogenesis sindrom sirkulasi hiperdinamik. Hydrogen sulfide (H2S) Bukti terbaru yang menyebutkan peran dari H 2S, vasodilator poten pada kejadian sirkulasi hiperdinamik pada pasien sirhosis. 82 Hal ini didasarkan pada observasi jika pada sirhosis, endotoksemia memimpin upregulasi enzim sistathionin--lyase, yang bertanggungjawab terhadap produksi H 2S, yang mana menyebabkan vasodiltasi melalui pembukaan kanal kalium (K- ATP Channels).83 Vasodilator sirkulasi Penelitian awal pada fisiopatologi hipertensi porta yang difokuskan pada peran substansi vasodilator sirkulasi dari asal organ lien diakumulasi sebagai konsekuensi penurunan 21etabolism hepatis dan atau kenaikan shunting portosistemik. Bukti kuat adalah glucagon, dimana sustansi lainnya dideskripsikansebagai hal yang tidak terlalu diteliti. 84-85 Glucagon Beberapa penelitian telah menemukan bahwa peningkatan level glucagon pada pasien dengan sirhosis dan hipertensi porta pada hewan uji tikus. Glukosa meningkatkan vasodilatasi dengan merelaksasi vaskulrer otot polos dan menurunkan tingkat sensitifitasnya terhadap vasokonstriktor endogen., meskipun mekanisme yang sebenarnya telah dijelaskan. 86
22
Gambar 11.Vasodilatasi/sinyal kontraktil pada sel otot polos. Kontraktilitas sel otot polos tergantung padafosforilasi myosin light chains (MLCs),pada kondisi normal aktivasi kontraktil mengaktifasi G protein coumplek reseptors(GPCR).reseptor reseptor tersebut mengaktifasi efektor downsteam seperti phospholipase C (PLC) GTP ase RhoA,meningkatan phosphorilase MLC melalui aktifitas MLC-kinase atau hambatan MLCfosfatase. DAG: diacylglycerol; IP3:inositol triphosphate; PIP2: Phosphatidylinositol4,5-biphosphate; PKC: protein kinase C. Endokanabinoid Kontribusi system endokanabinoid pada pembentukan vasodilatasi lien telah dideskripsikan pada beberapa penelitian yang menyebutkan berbagai mekanisme. Mediator endokanabinoid utama adalah anandamide, produk metabolism asam araknoat. Endokanabinoid mengaktivasi endotel reseptor kanabinoid 1 dan reseptor vaniloid 1 yang membuat vasodilatasi tikus BDL..
23
Anandamide level ditingkatkan oleh monosit pada pasien sirhosis overaktivasi oleh reseptor kanabinoid 1, menginduksi produksi
dan NO
mesenterika oleh eNOS di pembuluh darah mesenterika dari tikus dengan hipertensi porta.87-88 Adrenomedulin Seperti halnya endokanabinoid, penigkatan level adrenomodulin peptida telah ditemukan di tikus89 dengan sirhosis dan pasien sirhosis 90. Adrenomodulin adalah peptide vasoaktif yang diketahui berkontribusi terhadap peningkatan aktivitas eNOS yang menyebabkan vasodilatasi. Fosforilasi peptide dan mengaktivasi Akt dan meningkatkan produksi cGMP pada aorta tikus, mungkin mempromosikan vasorelaksan selama produksi NO. 91 Factor hiperpolarisasi derivate endothelium Endothelium derived hyperpolarizating factor (EDHF) telah dikenal sebagai vasodilator dependen endothelium yang sangat penting pada pembuluh darah resisten dari eNOS pada tikus putih. 92 Peran tersebut menjadi penting karena ketika produksi NO dapat dihambat,maka NO tidak akan menghambat pelepasan EDHF.93 Vasodilator humoral endogen lainnya termasuk peptide natriuretik atrial, yang tingkatannya meningkatkan tahap lebih lanjut dari sirhosis hepatis dengan asites,94 adenosine, histamine, garam empedu, gene kalsitinin yang berhubungan dengan protein (CGRP/ calcitinin gene related protein) dan substansi P, telah diindikasikan meminkan peran dalam vasodilatasi arterial pada hipertensi porta.95 Perubahan sinyal kontraksi Pada sirhosis dan hipertensi porta, kelebihan pembuluh darah adalah dapat berdilatasi walaupun terdapat aktivasi sistemik vasokonstriktor. 96-98 Resistensi lien untuk bervasokontriksi dapat bergantung pada hiporesponsifitas terhadap
24
vaskuler,99,100 hal ini menjelaskan mengapa sirkulasi hiperdinamik meningkat dengan progresifitas penyakit walaupun terdapat stimulasi renninangiotensinm system saraf simpatis dan pelepasan vasopressin. Kerusakan responsifitas untuk bervasokontriksi tergantung baik dari kenaikan vasodilator dari lien dan vasokontriksi organ-organ penting selanjutnya, memicu komplikasi yang lebih berat dari sirhosis. Status kontraktil dari otot polos vaskuler tergantung dari fosforilasi ikatan pita myosin (myosin light chain/ MLC) dan pengaturan lewat aktivasi MLC-kinase atau hambatan fosfatase MLC.101-102 reseptor Sebaliknya, jalur vasorelaksan akan menjadi menurunkan fosforilasi MLC via deaktivasi MLC-kinase atau aktivasi fosfatase MLC.103-106 Seluruh vasokonstriktor superfamily dari guanine nucleotide binding protein (G-protein) coupled receptors (GPCR). Stimulasi dari GPCR pada otot polos vaskuler mengaktivasi G protein dan berakibat pada penurunan aliran efektornya, fosfolipase C (PLC ) dan GTPase kecil, RhoA. PLC menghidrolisasi fosfatidilinositol 4,5-bifosfat menjadi inositol trifosfat (IP3) dan diasilgliserol (DAG). IP3 berdifusi di sitosol dan menyisakan DAG di membrane plasma yang mengaktivasi protein kinase C. Kedua produk tersebut meningkatkan kalsium intraseluler di sel otot polos vaskuler. Pelepasan kalsium mengawali aliran intraseluler, berakibat fosforilasi MLC dan menghasilkan jembatan aktin-miosin, kemudian menimbulkan kontraksi. 101-102 Tambahannya, aliran paralel G-protein yang diinduksi aktivasi RhoA berikutnya mengaktivasi Rhokinase menghambat fosfatase MLC, meningkatkan fosforilasi MLC dan akhirnya menimbulkan vasokontriksi vaskuler. Pada beberapa penelitian baik dengan hewan uji atau sampel manusia, respon penurunan kontraktil terhadap 1adrenergic agonis atau vasokonstriktor lainnya dipertahankan setelah pemindahan endothelium atau terdapat hambatan farmakologikal dari produksi NO endogen. Hal ini diketahui bahwa hiporeaktifitas vaskuler tidak disebabkan oleh down-regulasi dari reseptor ke vasokonstriktor endogen paling relevan atau oleh penurunan
25
afinitas masing-masing. Vasokonstriktor tersebut ditingkatkan di arteri hepatica. Selanjutnya, kerusakan sinyal kontraktil harusnya berada di tingkat subreseptor.107-108 Bukti terbaru mengatakan bahwa selama hipertensi porta, jalur sinyalemen kontraksi diubah sejak awal setelah stimulasi reseptor, lebih mungkin di tingkat G-reseptor. Pada tikus uji dengan sirhosis bilier yang diinduksi oleh ligasi duktus bilier, telah diteliti jika respon perubahan terhadap stimulasi -adrenoreseptor menghasilkan penurunan aktivasi PLC dan akibatnya, akan terjadi penurunan pembentukan inositol phosphate, 109 seperti juga penurunan aktivasi RhoA dengan akibat defek aktivasi Rho-kinase. 110 Selanjutnya, kerusakan di PLC dan aktivasi RhoA secara resisten/ tahan terhadap pemusnahan endothelium atau hambatan farmakologikal NOS, 109,110 didukung oleh eksistensi defek di kontraksi aktivasi mediated-reseptor. Respon kerusakan terhadap agonis kontraktil terjadi pada hipertensi porta juga telah dijelaskan pada desentisisasi GPCRs oleh protein desentisisasi reseptor, yang dinamakan G-protein-coupled receptor kinase 2 (GRK-2)dan -arrestin 2. Protein desentisisasi reseptor telah ditemukan menjadi upregulasi di aorta tikus BDL juga pada arteri hepatica pasien2 sirhosis hepatis, yang dipicu oleh desentisisasi reseptor angiotensin II. 111 Lebih lanjut, desentisisasi reseptor yang dimediasi GRK-2/ -arrestin 2 telah dikenali responnya untuk memperbesar stimulasi reseptor.
112-113
Hal ini tampaknya
menunjukkan bahwa kenaikan level plasma angiotensin II dan katekolamin, yang terbentuk sempurna di sirhosis, bertanggung jawab terhadap onset proses tersebut di pembuluh darah kontraktil.114-115 Penelitian lainnya yang berkontribusi terhadap pemahaman dari disregulasi sinyalemen kontraktil pada hipertensi porta ditunjukkan pada penelitian2 terbaru pada kenaikan pelepasan dan peningkatan efek dari neuropeptida Y (NPY) pada kontraksi mesenterika adrenergic pada tikus PVL. 116 Selanjutnya, NPY memediasi vasokonstriksi secara tidak langsung, tetapi potensial membangkitkan vasokontriksi NE di pembuluh darah mesenterika melalui reseptor Y1 spesifik. Kenaikan pelepasan NPY akan menghasilkan
26
mekanisme kompensasi untuk mengimbangi vasodilatasi arterial dengan memperbaiki efikasi katekolamin endogen, khususnya aktivitas alpha1adrenergik yang tinggi. System saraf dan hipertensi porta Penelitian histologis telah menyatakan bahwa otot polos vaskuler diinervasi/ dipersyarafi oleh neuron-neuron yang terdiri dari imunoreaktifitas NOS
54
termasuk didalamnya hidroksilase tirosin dan asetiltransferase kolin. 117 Sarafsaraf post-ganglion eferen seperti nitrergik, nonadrenergik dan kolinergik, mengontrol vasokokontriksi dari sel otot polos vaskuler dari pembuluh darah. Secara fungsional, saraf nitrergik lebih penting sebagai pengontrol tekanan vaskuler daripada saraf kolinergik, yang mana hanya berperan dalam modulasi adrenergic dan fungsi saraf nitrergik 118.pada sirkulasi mesenterika, baik pada manusia atau tikus uji, vasokontriksi yang diinduksi oleh system saraf simpatis (SNS/ sympathetic nervous system) utamanya dimediasi oleh post-sinaptik 1-adrenoreseptor.119 Hasilnya, stimulasi 1-adrenoreseptor adalah mekanisme utama selama system saraf simpatis mengatur tekanan vaskuler. Hal tersebut ditunjukkan bahwa stimulasi dari saraf perifer di pembuluh darah membangkitkan vasokonstriksi. Vasokonstriksi tersebut dihambat oleh tetrodotoksin (neurotoksin), prazosin (1-adrenoreseptor agonis), guanethidine (adrenergic neuron bloker) atau 6-hidroksidopamin (neurotoksin yang merusak saraf adrenergik). 120-121 Hasilnya, tekanan vaskuler dari pembuluh darah perifer mungkin dapat dikontrol secara penuh oleh saraf adrenergic simpatis karena pelepasan neurotransmitter norepinefrin (NE). lebih lanjut, penelitian yang berbeda juga menunjukkan bahwa terdapat agen lain seperti NPY dan adenosine triposfat (ATP) yang juga dilepaskan di system saraf simpatis, bekerja sebagai ko-transmiter dari NE dan berpotensi beraksi.122 Terdapat banyak penelitian yang mempublikasikan peran SNS pada pasien sirhosis. Kenaikan tingkatan sistemik dari katekolamin ditemukan pada
27
beberapa penelitian yang menyebutkan bahwa katekolamin akan meningkat pada kerusakan liver yang semakin buruk. 114-115 Kenaikan level ini adalah hasil dari peningkatan produksi NE (peningkatan level plasma dari NE, membuang NE dari neuroefektor-junction dan aktivitas saraf simpatis otot), daripada pembuangannya.123,124 Bagaimanapun juga, asal dari hiperreaktifitas SNS tidaklah homogen, sejak terdapat organ-organ atau jaringan yang dapat meningkatkan produksi NE belum ditemukan. Satu organ yang memproduksi NE berlebih adalah ginjal.124,125 Tempat lain yan juga memproduksi NE adalah otot, dengan beberapa penelitian yang menunjukkan kenaikan lalu-lintas saraf simpatis otot,126-127 terdapat juga perbedaan regional yang menyatakan bahwa ekstremitas atas melepaskan kenaikan jumlah NE, tapi ekstremitas bawah tidak.125,128 Juga dinyatakan bahwa berkebalikan dari kenaikan lalulintas saraf simpatis yang ditemukan di otot, kulit menghasilkan aktivitas saraf simpatis yang normal.127
Gamba 12.Hipotesis mekanisme dan efek atropi post ganglion simpatis.stimulus eferen dari peningkatan tekanan di portal atau pembulu darah
28
mesenteric atau mikrovascularisasi,hingga nuclei cardiovascular batang otak melalui syaraf aferen dari jalur tersebut,regresi saraf simpatis post ganglion di mediasi oleh saraf eferen simpatis menghambat neurotransmisi dan vasokontriksi yang di mediasi norepinephrine (NE). Telah dijelaskan bahwa system adrenergic memainkan peran penting pada system kardiovaskular, homeostatic dan disfungsi metabolic yang dipresentasikan secara lebih dalam pada penyakit liver dan sirhosis dan juga hipertensi porta. Hal yang masih perlu dikaji adalah apakah hiperaktifitas SNS terdapat di tempat manapun di tubuh dan khususnya di pembuluh darah mesenterika. Dalam hal ini, kelompok penelitian kami telah menunjukkan down-regulasi yang sangat penting, baik dari tingkat transkripsi dan translasi, bahwa banyak protein yang berimplikasi pada beurotransmisi adrenergic di arteri mesenterika superior dari PVL dan tikus uji sirhosis. 129 Hambatan adrenergic ini berhubungan dengan regresi/ atrofi dari inervasi simpatis di seluruh vaskularisasi mesenterika. Bagaimanapun juga, atrofi saraf tidak ditemukan di bagian vascular lainnya seperti arteri renal. Down-regulasi dari system adrenergic mesenterika telah diinterpretasikan sebagai konsekuensi local dari hipertensi porta yang mungkin berkontribusi untuk memperburuk vasodilatasi lien, yang bertanggungjawab terhadap overaktifitas simpatis umumnya, terutama di otot dan ginjal. Penelitian yang menyatakan bahwa agonis alfa-adrenergik seperti norepinefrin dan midodrin, sangat efektif untuk pengobatan sindrom hepatorenal., 131,132 konsekuensi penting dari vasodilatasi arterial pada sirhosis, disarankan bahwa aktivitas adrenergic dibandingkan overaktivasi, mungkin dapat ditekan. Penelitian terbaru menyatakan bahwa NPY dapat memulihkan hiporeaktifitas arteri mesenterika superior adrenergic pada tikus PVL,116 dan juga ditujukan kepada defisiensi tekanan local adrenergic pada hipertensi porta. Juga, Joh dan relasinya 133 menemukan bahwa menggunakan antagonis terhadap -adrenergik reseptor, respon blockade vasokonstriktor pada hewan dengan hipertensi porta dibedakan
29
secara drastic dari hewan tikus normal. Tidak seperti respon dari tikus normal, blockade -adrenergik tidak mengubah dimensi mikrovaskular intestinal, akan tetapi vasopressin atau blockade angiotensin II dihubungkan dengan dilatasi arterial. Data ini menyatakan bahwa kehilangan tekanan vascular adrenergic dapat menjadi sangat penting bagi defek vasokonstriktor fungsional pada hipertensi porta. Jalur persarafan mengkontrol system kardiovaskuler termasuk inervasi aferen primer (neuron sensoris), saraf kardiovaskuler medulla batang otak, dan cabang efektor yang berisi saraf efern simpatis dan parasimpatis. 134,135 Sehubungan dengan system ini, sinyal2 bertanggungjawab terhadap regresi saraf simpatis post ganglion ditetapkan oleh penelitian kami, mungkin mulamula membentuk saraf preganglion atau saraf lain dengan koneksi sinaps ke saraf postganglion. Stimulus aferen diawali dari tekanan yang meningkat pada system porta atau pambuluh darah mesenterika atau mikrovaskuler yang dapat mencapai system saraf pusat melalui saraf aferan dan dari tempat tersebut ke ganglia simpatis. 136,137 Dalam hal ini, sangat penting dalam menyebutkan bahwa beberapa penelitian telah menyatakan jika dengan eliminasi saraf aferen primer secara farmakologik dengan pemberian capsaicin, pembentukan perubahan hemodinamik dan juga kejadian asites dapat dicegah, pada tikus PVL dan tikus sirhosis. 138-141 Sebagai tambahan, saraf sensoris aferen sekali diaktivasi oleh stimulus perifer dapat juga melepaskan isi transmitter (peptide vasodilator substansi P dan CGRP) dari terminal perifer pada inervasi jaringan untuk memperoleh fungsinya masingmasing.142 Hal ini telah dijabarkan bahwa stimulasi saraf periarterial pada arteri resisten mesenterika tikus uji menghasilkan vasodilatasi neurogenik dimediasi olah CGRP,143 dan CGRP tersebut melepaskan peningkatan saraf simpatis untuk vasokonstriksi.143 Akhirnya, beberapa penelitian berbeda menunjukkan tingkat tertinggi dari substansi P dan CGRP pada pasien dengan sirhosis dan gagal liver yang telajh disarankan bahwa secara
30
persarafan yang mengakibatkan vasodilator dapat memerankan peran penting pada vasodilatasi lien pada hipertensi porta. 144,145 Perivaskuler menunjukkan bahwa nNOS, terdiri dari saraf yang disebut saraf nitrergik, telah menunjukkan pada beberapa vaskularisasi dan banyak spesies. Serat imunoreaktif nNOS ini memainkan peran penting pada pengaturan tekanan vaskuler, dimediasi oleh vasodilatasi neurogenik dengan pelepasan NO. up-regulasi dari nNOS telah ditunjukkan pada arteri mesenterika tikus uji PVL.58,146 Aktivasi nNOS memediasi kenaikan vasodilatasi neural NO-mediated dan mungkin dapat sebagai jalur tambahan untuk relaksasi otot polos mesenterika dalam hipertensi porta. Lebih lanjut, hambatan non-selektif NOS oleh L-NAME (N-(G)-nitro L-arginine methyl ester) dan hambatan selektif dari nNOS oleh L-VNIO (vinyl-L-N-5-(1-imino-3butenyl)-L ornithine), meningkatkan induksi vasokonstriksi adrenergic pada arteri mesenterika tikus uji sebagai respon terhadap stimulasi saraf perifer. 147 Penemuan ini menyatakan bahwa NO endogen juga dapat memodulasi pelepasan saraf NE dari terminal saraf adrenergic
BAB IV
31
RINGKASAN Kenaikan aliran arteri lien yang berkontribusi terhadap hipertensi porta didapatkan dari vasodilatasi mesenterika persisten bersama dengan angiogenesis. Penelitian pada hewan uji dan pasien telah menunjukkan bahwa vasodilatasi arteri lienalis adalah fenomena multifaktorial. Sebagai tambahan terhadap overproduksi vasodilator (khususnya nitrit oksida), memperburuk jalur kontraktil sinyalemen pada sel otot polos sebagai respon terhadap vasokonstriktor yang berkontribusi terhadap hiporesponsifitas vaskuler menjadi vasokonstriktor endogen. Atrofi simpatis juga tampaknya berpertisipasi dalam tahap akhir hipertensi porta. Sangat disarankan bahwa atrofi simpatis mesenterika menurunkan tekanan vaskuler dari pohon mesenterika, menawarkan aktivitas peningkatan dari mediator vasodilator (humoral dan persarafan). Bagaimanapun juga, pengetahuan yang masih sedikit tentang interaksi antara jalur pastisipan dan mekanismenya, serta usaha yang lebih keras dibutuhkan untuk mengklarifikasi komponen yang penting dari hipertensi porta.
DAFTAR PUSTAKA
32
1. Martin P. Liver Transplantation. American College of Gastroenterology. 2010. (29):45-56. 2. Ng K.K, Lo C.M. Liver transplantation in Asia : Past, Present and Future. Ann Acad Singapore. 2009. (38):322-31. 3. Chan S.C, Fan S.T. Historical perspective of living donor liver transplantation. World J Gastroenterol. 2008. 14(1):15-21. 4. Abbasoglu O. Liver transplantation: yesterday, today and tomorrow. World J Gastroenterol. 2008. 14(20): 3117-3122. 5. Sugawara Y, Makuuchi M. Living donor liver transplantation: present status and recent advances. British Medical Bulletin. 2005. (76):15-28. 6. Sulaiman A. Transplantasi Hati. Dalam: Sulaiman A, Akbar N, Lesmana L.A, et all (eds). Buku Ajar Ilmu Penyakit Hati. 2007. Hal:581-89. 7. Morana J.G. Psychological evaluation and follow-up in liver transplantation. Gruttaduria S (ed). World J Gastroenterol. 2009. 15(6):694-696. 8. McGuire B.M, Rosenthal P, Brown C.C, Busch A.M.H, Calcatera S.M, Claria R.S, et all. Long term management of the liver transplant patient: recommendation for the primary care doctor. American Journal of Transplantation. 2009. (9):1988-2003. 9. McCaughan G.W. Immunology and Immunosupression. In: Bacon B.R, OGrady J.G, DiBisaglie A.M, et all(eds). Comprehensive Clinical Hepatology. Second Edition. Elsevier. 2006. P: 621-642. 10. Qamar A.A. liver Trasnplantation. In: Greenberger N.J, Blumberg R.S, Burakokoff R. Current Diagnosis and Treatment Gastroenterology, Hepatology and Endoscopy. Lange, McGraw Hill. 2009. P: 517-528. 11. Amirudin R. Fisiologi dan Biokimia hati. Dalam: Soedoyo AW, Setiyohadi B, Alwi, Marcellius SK, Setiati S, (editors). Buku Ajar Ilmu Penyakit Dalam. Jilid I Edisi IV. Jakarta: Balai Penerbit FK UI; 2006.hal: 417-421. 12. Putz R, Pabst R. Hati. Dalam: Putz R, Pabst R, (editors). Sobotta : Atlas Anatomi Manusia. Alih bahasa : Joko S. Jilid II. Jakarta: Buku Kedokteran EGC; 2007.hal:82. 13. Guyton A.C. The Liver : Biology and Pathobiology. In : Guyton A.C., Hall J.E, (editors). Text Book of Medical Physiology. 9th Edition. Pennsylvania: WB Saunders Company, Philadelphia ; 1996.hal:1103-1110. 14. Mae A, Hopskin J, Tetre B. Non alcoholic steatohepatitis: review. National Digestive Disease Information Clearinghouse. National Institute of Diabetes and Digestive and Kidney Disease. NIH Publication. 2006. 07-4921:2-6. 15. James M.C. Liver and Billiary Tract. In: Kumar, Abbas, Fausto, Mitchell (editors). Robbins and Cotran Pathology Basic of Disease. 8 th Edition. New York: WB Saunders Elsevier. 2007. P:877-905. 16. Imperial J.C, Keeffe E.B,. Liver Transplantation. In: Friedman L.S, Keeffe E.B (eds). Handbook of Liver Disease. 2008. P: 401-415.
33
17. Everson G.T, Membreno F.E,. Liver Transplantation: indications, contraindications and results. In: Rodes J, Benhamou J.P, Blei A.T (eds). Textbook of Hepatology. 3rd edition. Blackwell. 2007. P: 1984-1992. 18. Supardjo T. Transplantasi Hati. Health First. 2011. (14):25-27 19. Lee S.G. Living donor liver transplantation in adults. British Medical Bulletin. 2010. (94):33-48. 20. Florman S, Miller C.M. Live donor liver transplantation. Liver Transplantation. 2006. (12):449-510. 21. Wiesner R.H, Rakela J, Ishitani M.B, Mulligan D.C, Spiyev J.R, Steers J.L, et all. Recent advances in liver transplantation. Mayo Clin Proc. 2003. (78):197210. 22. Moreno R, Berenguer M. Post liver transplantation medical complications. Annals of Hepatology. 2006. 5(2): April-June:77-85. 23. Pillai A.A, Levitsky J. Overview of immunosuppression in liver transplantation. World J Gastroenterol. 2009. 15(34):4225-4233. 24. Murray K.F, Carithers R.I. AASLD Practice Guideline: Evaluation of the patients for liver transplantation. Hepatology. 2005. P:1407-1425. 25. Neuberger J. Developments in liver transplantation. Gut BMJ. 2004. (53):759768. 26. Ahmed A, Keeffe E.B. Pretransplant evaluation and care. In: Boyer T.D, Wright T.C, Manns M.P. Zakim and Boyers Hepatology : A textbook of liver disease. 5th edition. Elsevier. 2006. P:933-960. 27. Varma V, Mehta N, Kumaran V, Nundy S. Indications and contraindications for Liver Transplantation. International Journal of Hepatology. 2011. (10) 121862:1-9. 28. Sherlock S, Dooley J. Hepatic Transplantation. In: Disease of the Liver and Billiary System. 8th edition. Blackwell. London. 2002. P:657-676. 29. Kaido T, Uemoto S. Does living donation have advantages over deceased donation in liver transplantation? Journal of Gastroenterology and Hepatology. 2010. (25):1598-1603. 30. Chan S.C, Dai W.C, Lo C.M, Kwan Y.M, Ho W.Y, Fan S.T. Monday blues of deceased donor liver transplantation. Hepatobiliary Pancreas Dis Int. 2011. (10)26-29. 31. Clavien P.A, Petrowsky H, DeOlievera M.D, Graft R. Strategies for Safer Liver Surgery and Partial Liver Transplatation. N Engl Med. 2007. (356):1545-49. 32. Melendez H.V, Heaton N.D. Paediatric liver transplantation: the surgical review. Postgrad Med J. 2004. 80:571-76. 33. Brown R.S. Live Donors in Liver Transplatation. Gastroenterology. 2008. (134):1802-1813. 34. Han S.H, Tran T, Martin P. Liver Transplatation. In: Redy R, Faust T (eds). The Clinicians Guide to Liver Disease. 2006. P:297-318. 35. Chan S.C, Liu C.L, Lo C.M, Lam B.K, Lee E.W, Wong Y, et all. Estimating Liver Weight of Adults by Body Weight and Gender. World J Gastroenterolo. 2006. 12(14):2217-2222.
34
36. Lucey M.R. Assessment for Liver Transplantation. Liver Transplantation. 2003. Volume 6. P:80-92. 37. Nickkholgh A, Weitz J, Encke J, Sauer P, Mehrabi A, Buchler M.W, et all. Utilization of Extended donor criteria in liver transplantation: a comprehensive review of the literature. Nephrol Dial Transplant. 2007. 22(suppl 8):29-36. 38. Forns X, Rimola A. Recurrent Disease and Management in Liver Transplantation. In: Rodes J, Benhamou J.P, Blei A.T, et all(eds). Textbook of Hepatology. 3rd edition. Blackwell. 2007. P:2010-2017. 39. Chung R.T. Liver Transplantation. In: Fauci A.S, Kasper D.L, Braunwald E,et all(eds). Harrisons Principles of Internal Medicine. 18 th edition. McGrawHill. New York. 2008. Chapter 310. P:1-17. 40. Muller S.A, Mehrabi A, Schmied B.M, Welsch T, Fonouni H, Engelmann G, et all. Partial liver transplantation-living donor liver transplantation and split liver transplantation. Nephrol Dial Transplant. 2007. 22(suppl 8):13-22. 41. Lake J.R. Indications and Patients Selection. In: Bacon B.R, OGrady J.G, DiBisaglie A.M, et all (eds). Comprehensive Clinical hepatology. 2 nd edition. Elsevier.2006. p:585-604. 42. Schilky M.L, Kinkhabwala B, Emond J.C. The transplant operation: what the hepatologist should know. In: Bacon B.R, OGrady J.G, DiBisaglie A.M, et all(eds). Comprehensive Clinical Hepatology. 2nd edition. Elsevier. 2006. P:605-620. 43. Pietrosi G, Vizzini G.B, Gruttadauria S, Gridelli B. Clinical applications of hepatocyte transplantation. In: Pietrosi G (ed). World J Gastroenterol. 2009. 15(17):2074-2077. 44. Chandramohan A, Eupen A, Govil S, Jeyasechan V. Determining standard liver volume assessment of existing formulae in Indian population. Indian J Gastroenterol. 2007. (26):22-25. 45. Neuhaus P. Surgical Techiques. In: Rodes J, Benhamou J.P, Blei A.T, et all (eds). Textbook of Hepatology. 3rd edition. Blackwell. 2007. P:1965-1983. 46. Chouke A. Martignoni A, Dugas M, Eisenmenger W, Schauer R, Kaufmann I, et all. Estimation of liver size for liver transplantation : the impact of age and gender. Liver Transplantation. 2004. Vol 10, No 5 : 678-685. 47. Yu H.C, You H, Lee H, Jin Z.W, Moon J.I, Cho B.H. Estimation of standard liver volume for liver transplantation in the Korean Population. Liver Transplantation. 2004. Vol 10. No 6 : 779-783. 48. Walter J, Orth S.I, Broering D.C. The Accuracy of Estimations of Liver Volume. Liver Transplantation. 2010. (16):786-787. 49. Li G, Liu Y, Liang J. Isolation and protective effect in UW solution of human hepatocytes during cold storage. International Congress series. 2003. (1255):217-218. 50. Tan K.C. Liver transplantation for hepatocelluler carcinoma : how far can we push the envelope? Singapore Med J. 2003. Vol 44(6):309-311
35
51. Tanwar S, Khan S.A, Grover V.P.B, Gwilt C, Smith B, Brown A. Liver transplantation for hepatocelluler carcinoma. World J Gastroenterol. 2009. 15(44):5511-5516. 52. Gaglio P.J, Brown R.S. Post Liver Transplantation Management and Complication. In: Boyer T.D, Wright T.C, Manns M.P. Zakim and Boyers Hepatology : A Textbook of Liver Disease. Fifth edition. Elsevier. 2006. P:961-972. 53. Keegen M.T, Plevak D.J. The perioperative care and complications of liver transplantation. In: Rodes J, Benhamou J.P, Blei A.T, et all (eds). Textbook of Hepatology. Third Edition. Blackwell. 2007. P:1996-2001. 54. Neuberger J. Immunosuppression. In: Rodes J, Benhamou J.P, Blei A.T, et all (eds). Textbook of Hepatology. Third Edition. Blackwell. 2007. P:2003-2009. 55. Neuberger J. Acute and chronic rejection of the liver allograft. Gershwin M.A, Vierling J.M, Manns M.P (eds). In: Liver Immunology. 2007. Humana Press, Towota, New Jersey. p:423-430.
Anda mungkin juga menyukai
- Sirosis HepatisDokumen19 halamanSirosis HepatisIrfan Adi Saputra100% (3)
- Ikterus ObstruksiDokumen31 halamanIkterus ObstruksianggaBelum ada peringkat
- Patofisiologi AsitesDokumen34 halamanPatofisiologi AsitesDimarzsiana Dara Sjahruddin80% (5)
- PTBD-HEPARDokumen23 halamanPTBD-HEPARjoe_bartershakeBelum ada peringkat
- HEPATOBILIERDokumen131 halamanHEPATOBILIEREdward Arthur Iskandar100% (1)
- Sirosis HatiDokumen33 halamanSirosis Hatisusan lieBelum ada peringkat
- Referat Sirosis HepatisDokumen24 halamanReferat Sirosis HepatisAnna Hafeezah ZahrahBelum ada peringkat
- Bab 34 Fisiologi Hati Dan AnestesiDokumen26 halamanBab 34 Fisiologi Hati Dan AnestesiKadek Rudita YasaBelum ada peringkat
- Referat Sirosis HepatisDokumen36 halamanReferat Sirosis HepatisPutri NisrinaBelum ada peringkat
- Ascites Pada Sirosis Hepatis (RSGR Referat)Dokumen28 halamanAscites Pada Sirosis Hepatis (RSGR Referat)Yustinus TeddyBelum ada peringkat
- OPTIMASI HATI DAN EMPEDUDokumen6 halamanOPTIMASI HATI DAN EMPEDUFitrahBelum ada peringkat
- JUDULDokumen28 halamanJUDULaswanfaqihBelum ada peringkat
- Marisa Citra Kinasih 22010113130149 Lap Kti Bab 2Dokumen23 halamanMarisa Citra Kinasih 22010113130149 Lap Kti Bab 2Hanik Annur MariaBelum ada peringkat
- SIROSIS HATIDokumen26 halamanSIROSIS HATIPutu Ricca Tiara0% (1)
- Laporan Pendahuluan Sirosis HepatisDokumen10 halamanLaporan Pendahuluan Sirosis HepatisAnonymous 03naxhBelum ada peringkat
- SIROSIS HATIDokumen15 halamanSIROSIS HATISucii JuwitaBelum ada peringkat
- BAB II (-O-)Dokumen36 halamanBAB II (-O-)Joe DavisBelum ada peringkat
- Referat Hipertensi Portal Dan Koma Hepatikum PD Sirosis HepatisDokumen25 halamanReferat Hipertensi Portal Dan Koma Hepatikum PD Sirosis HepatisBambang HadyBelum ada peringkat
- Novita Ikbar K 22010112130097 Lap - KTI Bab2 PDFDokumen21 halamanNovita Ikbar K 22010112130097 Lap - KTI Bab2 PDFRahmawan Adhy PutraBelum ada peringkat
- Laporan Pendahuluan Sirosis HepatisDokumen21 halamanLaporan Pendahuluan Sirosis HepatisRoma RadiahBelum ada peringkat
- SH SlesaiDokumen50 halamanSH SlesaiEfa Imama Nur MaulinaBelum ada peringkat
- SIROSIS HEPATISDokumen39 halamanSIROSIS HEPATISDESSYBelum ada peringkat
- Referat Januari 2018 HepatobilierDokumen51 halamanReferat Januari 2018 HepatobilierFahrunnisa HNBelum ada peringkat
- LP Sirosis HepatisDokumen15 halamanLP Sirosis HepatisRamda SariBelum ada peringkat
- Makalah PBLDokumen35 halamanMakalah PBLMuhammad Sandy IrwansyahBelum ada peringkat
- Referat Sirosis HepatisDokumen30 halamanReferat Sirosis HepatiswipradxBelum ada peringkat
- BBBBBDokumen17 halamanBBBBBDinda AgilBelum ada peringkat
- SIROSIS HATIDokumen54 halamanSIROSIS HATIDinny Ria PertiwiBelum ada peringkat
- Makalah Hepatitis, Sirosis, Dan KankerDokumen90 halamanMakalah Hepatitis, Sirosis, Dan KankerIdaFajriyahBelum ada peringkat
- CyfdnDokumen7 halamanCyfdninfaindan2014Belum ada peringkat
- Cara Kerja HatiDokumen10 halamanCara Kerja HatiRizki oktarinaBelum ada peringkat
- LP Sirosis HepatisDokumen35 halamanLP Sirosis HepatisBagas Novan ImandiBelum ada peringkat
- Sirosis HepatisDokumen31 halamanSirosis HepatisTasdik SyadikinBelum ada peringkat
- Askep Sistem Metabolik & PankreasDokumen146 halamanAskep Sistem Metabolik & PankreasConnie Fahyuna DaimboaBelum ada peringkat
- 24.11 (Terjemahan)Dokumen7 halaman24.11 (Terjemahan)ARINA AMALINA NAFA DIAZBelum ada peringkat
- LP Sirosis HepatisDokumen34 halamanLP Sirosis HepatisRizkainna SafitriBelum ada peringkat
- LP Sirosis HepatisDokumen13 halamanLP Sirosis HepatisChannel MyAzaria100% (1)
- Bab Ii PDFDokumen32 halamanBab Ii PDFnova rachmanBelum ada peringkat
- Makalah ToxikologiDokumen18 halamanMakalah ToxikologiSiti Mashita CaopanaBelum ada peringkat
- BAB II Seminar SIROSIS HEPATISDokumen15 halamanBAB II Seminar SIROSIS HEPATISAngel Septa MegaBelum ada peringkat
- Makalah Sirosis HepatisDokumen20 halamanMakalah Sirosis HepatisMulyati 'mull' Ningsih100% (1)
- ANATOMI DAN FISIOLOGI HATIDokumen16 halamanANATOMI DAN FISIOLOGI HATIAngel Septa MegaBelum ada peringkat
- LP Sirosis HepatisDokumen26 halamanLP Sirosis HepatisEfril Lianhidayat DuabelasaprilBelum ada peringkat
- Referat Abses HeparDokumen32 halamanReferat Abses HeparYushera Atika SariBelum ada peringkat
- LP Sirosis Hepatis AnakDokumen18 halamanLP Sirosis Hepatis AnakDona KristinaBelum ada peringkat
- Sirosis HepatisDokumen25 halamanSirosis HepatisNurul SakinahBelum ada peringkat
- LBM 1 Entero SGD 9Dokumen18 halamanLBM 1 Entero SGD 9Bagus Sofian AdhatamaBelum ada peringkat
- USG SIROSIS HEPATISDokumen24 halamanUSG SIROSIS HEPATISibnukharismanBelum ada peringkat
- OPTIMALKAN HATIDokumen99 halamanOPTIMALKAN HATImarthagusnadiBelum ada peringkat
- DETEKSI DINIDokumen24 halamanDETEKSI DINImirza_ariandiBelum ada peringkat
- Cirrhosis HepaticDokumen48 halamanCirrhosis HepaticAndi Nurul IlmiBelum ada peringkat
- Anatomi HeparDokumen28 halamanAnatomi HeparTheresia KarinaBelum ada peringkat
- Bab 2Dokumen23 halamanBab 2Jefri IrawanBelum ada peringkat
- Laporan Pendahuluan Sirosis HepatisDokumen26 halamanLaporan Pendahuluan Sirosis HepatisSusi SuryaniBelum ada peringkat
- DAFTAR PUSTAKA Penghambat TrombinDokumen1 halamanDAFTAR PUSTAKA Penghambat TrombinArwindy AlmarBelum ada peringkat
- Membuat Foto Hitam Putih Jadi WarnaDokumen9 halamanMembuat Foto Hitam Putih Jadi WarnaJean_rpaBelum ada peringkat
- 4 Bab ViiiDokumen1 halaman4 Bab ViiiArwindy AlmarBelum ada peringkat
- 2 Direct Trombin Inhibitor LAST AKHIRDokumen32 halaman2 Direct Trombin Inhibitor LAST AKHIRArwindy AlmarBelum ada peringkat
- Kasus TiroidDokumen42 halamanKasus TiroidArwindy AlmarBelum ada peringkat
- 2 Direct Trombin Inhibitor LAST AKHIRDokumen32 halaman2 Direct Trombin Inhibitor LAST AKHIRArwindy AlmarBelum ada peringkat
- Direct Trombin InhibitorDokumen23 halamanDirect Trombin InhibitorArwindy AlmarBelum ada peringkat
- LPR-KEGIATANDokumen5 halamanLPR-KEGIATANArwindy AlmarBelum ada peringkat
- Cara Pasang, Jalankan & Atur FirefoxDokumen1 halamanCara Pasang, Jalankan & Atur FirefoxFahmi Wahyu TrihasnoBelum ada peringkat
- Judul Case 4Dokumen2 halamanJudul Case 4Arwindy AlmarBelum ada peringkat
- Cara Pasang, Jalankan & Atur FirefoxDokumen1 halamanCara Pasang, Jalankan & Atur FirefoxFahmi Wahyu TrihasnoBelum ada peringkat
- Kaki Diabetik RalatDokumen32 halamanKaki Diabetik RalatArwindy AlmarBelum ada peringkat
- Cara Pasang, Jalankan & Atur FirefoxDokumen1 halamanCara Pasang, Jalankan & Atur FirefoxFahmi Wahyu TrihasnoBelum ada peringkat
- Cara Pasang, Jalankan & Atur FirefoxDokumen1 halamanCara Pasang, Jalankan & Atur FirefoxFahmi Wahyu TrihasnoBelum ada peringkat
- Cara Pasang, Jalankan & Atur FirefoxDokumen1 halamanCara Pasang, Jalankan & Atur FirefoxFahmi Wahyu TrihasnoBelum ada peringkat