Kimia - 12 - Eza
Diunggah oleh
Hefri Noer Ramadhan0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
469 tayangan1 halamanTugas kimia mengenai reaksi redoks dan sel volta, termasuk menentukan spontanitas reaksi, contoh sel volta sehari-hari.
Deskripsi Asli:
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniTugas kimia mengenai reaksi redoks dan sel volta, termasuk menentukan spontanitas reaksi, contoh sel volta sehari-hari.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
469 tayangan1 halamanKimia - 12 - Eza
Diunggah oleh
Hefri Noer RamadhanTugas kimia mengenai reaksi redoks dan sel volta, termasuk menentukan spontanitas reaksi, contoh sel volta sehari-hari.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 1
Nama : Eza Nadila
Kelas : XII MIPA 1
Mata Pelajaran : Kimia
Tugas
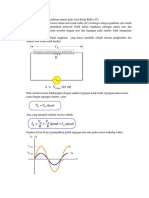
1. Suatu sel volta mengalami reaksi redoks sebagai berikut.
Fe2+(aq) + Zn(s) → Fe(s) + Zn2+(aq)
Apakah reaksi redoks di atas dapat berlangsung secara spontan atau tidak?
[ E°Fe2+|Fe = –0,44 V dan E°Zn2+|Zn = –0,75 V ]
2. Suatu sel volta mengalami reaksi redoks sebagai berikut.
Zn2+(aq) + Mg(s) → Zn(s) + Mg2+(aq)
Reaksi redoks di atas apakah dapat berlangsung secara spontam atau tidak? Jika diketahui
[ E°Zn2+|Zn = –0,76 V dan E°Mg2+|Mg = –2,37 V ]
3. FeSO4(aq) + 2Ag(s) → Fe(s) + 2Ag+(aq)
Apakah reaksi di atas dapat berlangsung secara spontan?
4. Temukan tiga contoh prinsip sel volta dalam kehidupan sehari-hari!
Jawaban
1. Soal nomor satu dapat diselesaikan dengan cara berikut:
Fe2+(aq) + Zn(s) → Fe(s) + Zn2+(aq)
Fe2+(aq) → Fe(s) (reduksi)
Zn(s) → Zn2+(aq) (oksidasi)
Gunakan deret volta
Li K Ba+ Ca Na Mg Al Mn Zn Cr Fe Ni Co Sn Pb (H) Hg Ag Au
E°sel = E°katode - E°anode = (-0,44) – (-0,75) = +0,31 volt
Karena Fe merupakan reduksi maka letaknya harus di kanan dan Zn merupakan oksidasi letaknya
harus di kiri jadi reaksinya adalah spontan.
2. Soal nomor dua dapat diselesaikan dengan cara berikut:
Zn2+(aq) + Mg(s) → Zn(s) + Mg2+(aq)
Zn2+(aq) → Zn(s) (reduksi)
Mg(s) → Mg2+(aq) (oksidasi)
Gunakan deret volta
Li K Ba+ Ca Na Mg Al Mn Zn Cr Fe Ni Co Sn Pb (H) Hg Ag Au
Karena Zn merupakan reduksi maka letaknya harus di kanan dan Mg oksidasi letaknya harus di
kiri jadi reaksinya adalah spontan.
3. Soal nomor tiga dapat diselesaikan dengan cara berikut:
Gunakan deret volta
Li K Ba+ Ca Na Mg Al Mn Zn Cr Fe Ni Co Sn Pb (H) Hg Ag Au
FeSO4(aq) + 2Ag(s) → Fe(s) + 2Ag+(aq)
Maka reaksinya dapat berlangsung secara spontan, karena sesuai dengan deret volta.
4. Contoh prinsip sel Volta dalam kehidupan sehari-hari antara lain:
a. Baterai biasa atau sel kering
b. Baterai alkali
c. Baterai perak oksida
d. Baterai nikel-kadmium
e. Sel aki (accu)
Anda mungkin juga menyukai
- Hukum I FaradayDokumen7 halamanHukum I FaradaylittlehaaaafBelum ada peringkat
- Radiasi Benda HitamDokumen4 halamanRadiasi Benda HitamMukhlisyah Amalia PutriBelum ada peringkat
- ORGAN PADA TUMBUHANDokumen9 halamanORGAN PADA TUMBUHANHafsahBelum ada peringkat
- Fisika 12SMA Fisika Kuantum 1Dokumen33 halamanFisika 12SMA Fisika Kuantum 1Mutiara IzzatiBelum ada peringkat
- PANJANG GELAMBANGDokumen4 halamanPANJANG GELAMBANGNdy Stefany LeparBelum ada peringkat
- Jawaban Tugas Kimia ElektrolisisDokumen1 halamanJawaban Tugas Kimia ElektrolisisJustisia PadmiyatiBelum ada peringkat
- Aplikasi Turunan Kedua Untuk Menentukan Titik Ekstrim Dan Titik BelokDokumen11 halamanAplikasi Turunan Kedua Untuk Menentukan Titik Ekstrim Dan Titik BelokAnd ThanBelum ada peringkat
- Rangkaian KapasitifDokumen6 halamanRangkaian KapasitiflunsBelum ada peringkat
- ES2-Medan ListrikDokumen31 halamanES2-Medan ListrikhizBelum ada peringkat
- Contoh Soal Turunan Fungsi Trigonometri Lanjutan1Dokumen2 halamanContoh Soal Turunan Fungsi Trigonometri Lanjutan1Rayhan AghnatBelum ada peringkat
- TURUNAN FUNGSI TRIGONOMETRIDokumen98 halamanTURUNAN FUNGSI TRIGONOMETRIRendi Yanto100% (1)
- MetabolismeDokumen20 halamanMetabolismeVira Nurjannah0% (1)
- Percobaan IngenhouszDokumen3 halamanPercobaan IngenhouszVallentia NisrinaBelum ada peringkat
- PDF Soal Pgs Kurva Trigonometri - CompressDokumen5 halamanPDF Soal Pgs Kurva Trigonometri - CompressbletangtaehBelum ada peringkat
- Kelompok Kreatif XII MIPA 3 (Matematika Peminatan) (Autosaved)Dokumen21 halamanKelompok Kreatif XII MIPA 3 (Matematika Peminatan) (Autosaved)BIMA MOHAMMADBelum ada peringkat
- Aplikasi TurunanDokumen6 halamanAplikasi TurunanRully RyandhaniBelum ada peringkat
- Presentation1 Soall SoalDokumen9 halamanPresentation1 Soall SoalFor PcBelum ada peringkat
- Kimia Periode 4Dokumen23 halamanKimia Periode 4nabila safitriBelum ada peringkat
- MakalahDokumen6 halamanMakalahAmatullah100% (1)
- LKPD Hukum Faraday Sman 4 PrayaDokumen10 halamanLKPD Hukum Faraday Sman 4 PrayaKhaerul anamBelum ada peringkat
- Kunci LKPD IDokumen1 halamanKunci LKPD Irila susantiBelum ada peringkat
- MTK Normal AsliDokumen17 halamanMTK Normal AsliSiti SalsabilaBelum ada peringkat
- FISIKA SMADokumen37 halamanFISIKA SMAYunita RahmaniBelum ada peringkat
- Gaya ListrikDokumen5 halamanGaya ListrikFachri Teguh SantosoBelum ada peringkat
- KOROSI PADA LOGAMDokumen12 halamanKOROSI PADA LOGAMkaesta puriBelum ada peringkat
- ELEKTROLISISDokumen19 halamanELEKTROLISISabuhilman421Belum ada peringkat
- Tugas FisikaDokumen4 halamanTugas FisikaariniBelum ada peringkat
- Bio Pernapasan 1Dokumen4 halamanBio Pernapasan 1Andre NathanielBelum ada peringkat
- Soal Energi Listrik Dan Cara MenghitungnyaDokumen7 halamanSoal Energi Listrik Dan Cara MenghitungnyaKresna Agung PrasetyaBelum ada peringkat
- Materi Fisika IntiDokumen45 halamanMateri Fisika IntiRei Angga100% (2)
- Biologi 8.2Dokumen15 halamanBiologi 8.2aekaBelum ada peringkat
- Bab 3 ElastisitasDokumen21 halamanBab 3 ElastisitasAchmad RonyBelum ada peringkat
- Contoh Soal Dan Pembahasan Sel Volta - Post 2 - Chemistry Is Fun PDFDokumen5 halamanContoh Soal Dan Pembahasan Sel Volta - Post 2 - Chemistry Is Fun PDFrara_nduttBelum ada peringkat
- GARAM SUKARDokumen4 halamanGARAM SUKARSyazaymaniiax JunggellfuryBelum ada peringkat
- U H Ii RedoksDokumen2 halamanU H Ii RedoksalexpigaiBelum ada peringkat
- GAS MULIA DAN HALOGENDokumen4 halamanGAS MULIA DAN HALOGENFildzah Putri GhaisaniBelum ada peringkat
- Unsur Transisi Periode 3Dokumen6 halamanUnsur Transisi Periode 3Ali Misbahul Mu'affanBelum ada peringkat
- TTS Sejarah Indonesia Kelompok 5Dokumen2 halamanTTS Sejarah Indonesia Kelompok 5Egalita Adelianda PutriBelum ada peringkat
- JUDULDokumen3 halamanJUDULElsa C.Belum ada peringkat
- 5 6224172025888374811Dokumen19 halaman5 6224172025888374811yeni anggraeniBelum ada peringkat
- Penugasan Mandiri AdelDokumen3 halamanPenugasan Mandiri AdelAdelia PratiwiBelum ada peringkat
- Radioaktif dan Waktu ParuhDokumen3 halamanRadioaktif dan Waktu ParuhエフレンシトモランBelum ada peringkat
- Modul Sel Elektrolisis Faraday Kelas 12Dokumen15 halamanModul Sel Elektrolisis Faraday Kelas 12Azka ZulfaBelum ada peringkat
- DIABETES INSULINDokumen11 halamanDIABETES INSULINZainul AnwarBelum ada peringkat
- Kuis ElektrokimiaDokumen4 halamanKuis ElektrokimiairzfileBelum ada peringkat
- 3.1 LKS 1Dokumen5 halaman3.1 LKS 1RATNAWATIBelum ada peringkat
- Contoh SoalDokumen6 halamanContoh SoalDelfyBelum ada peringkat
- Laporan Biologi 3 PercobaanDokumen29 halamanLaporan Biologi 3 PercobaanIcca FerariBelum ada peringkat
- Tugas Prakary2Dokumen7 halamanTugas Prakary2Nursyafika AnggrainjBelum ada peringkat
- KD 3 ElektrolisisDokumen2 halamanKD 3 ElektrolisisJulianto Julai100% (4)
- Materi Gejala KuantumDokumen21 halamanMateri Gejala KuantumHardianti MediBelum ada peringkat
- Finishing Soal PETDokumen2 halamanFinishing Soal PETNafies KamaludienBelum ada peringkat
- Enzim KatalaseDokumen14 halamanEnzim KatalaseBestka ZaushaBelum ada peringkat
- Senter DCDokumen9 halamanSenter DCNadya ComellBelum ada peringkat
- Aplikasi Sel VoltaDokumen11 halamanAplikasi Sel VoltaKhairul ImamiBelum ada peringkat
- Tugas ElektrokimiaDokumen11 halamanTugas ElektrokimiaMiningBelum ada peringkat
- ELEKTROKIMIADokumen45 halamanELEKTROKIMIARahayu CamscanBelum ada peringkat
- Jawaban Kimia Bab 10Dokumen11 halamanJawaban Kimia Bab 10Mining100% (1)
- 1 - Konsep ElektrokimiaDokumen64 halaman1 - Konsep ElektrokimiafidelBelum ada peringkat
- Sel VoltaDokumen19 halamanSel VoltaMassihali SyuaibBelum ada peringkat
- Kimia Kelompok ZulDokumen8 halamanKimia Kelompok ZulHefri Noer RamadhanBelum ada peringkat
- ABCDDokumen4 halamanABCDHefri Noer RamadhanBelum ada peringkat
- Analisis Novel - EzaDokumen5 halamanAnalisis Novel - EzaHefri Noer RamadhanBelum ada peringkat
- Anum 1Dokumen2 halamanAnum 1Hefri Noer RamadhanBelum ada peringkat
- Hefri Noer Ramadhan - FISIKADokumen7 halamanHefri Noer Ramadhan - FISIKAHefri Noer RamadhanBelum ada peringkat
- NovelDiponegoroDokumen5 halamanNovelDiponegoroHefri Noer RamadhanBelum ada peringkat
- (NSN) 2Dokumen4 halaman(NSN) 2Hefri Noer RamadhanBelum ada peringkat
- Bahasa IndonesiaDokumen6 halamanBahasa IndonesiaHefri Noer RamadhanBelum ada peringkat
- Bahasa 2 - EditorialDokumen2 halamanBahasa 2 - EditorialHefri Noer RamadhanBelum ada peringkat
- Bahasa 3 - EditorialDokumen3 halamanBahasa 3 - EditorialHefri Noer RamadhanBelum ada peringkat
- A. Bacalah Surat Lamaran Pekerjaan Di Bawah Ini!Dokumen2 halamanA. Bacalah Surat Lamaran Pekerjaan Di Bawah Ini!Hefri Noer RamadhanBelum ada peringkat
- NovelDiponegoroDokumen5 halamanNovelDiponegoroHefri Noer RamadhanBelum ada peringkat
- AnumDokumen3 halamanAnumHefri Noer RamadhanBelum ada peringkat
- (NSN) 2Dokumen4 halaman(NSN) 2Hefri Noer RamadhanBelum ada peringkat
- Anum 2Dokumen2 halamanAnum 2Hefri Noer RamadhanBelum ada peringkat
- B4Dokumen1 halamanB4Hefri Noer RamadhanBelum ada peringkat
- B3Dokumen1 halamanB3Hefri Noer RamadhanBelum ada peringkat
- Bahasa 1 - EditorialDokumen3 halamanBahasa 1 - EditorialHefri Noer RamadhanBelum ada peringkat
- Anum 1Dokumen2 halamanAnum 1Hefri Noer RamadhanBelum ada peringkat
- AbcdefgDokumen2 halamanAbcdefgHefri Noer RamadhanBelum ada peringkat
- A. Bacalah Surat Lamaran Pekerjaan Di Bawah Ini!Dokumen2 halamanA. Bacalah Surat Lamaran Pekerjaan Di Bawah Ini!Hefri Noer RamadhanBelum ada peringkat
- (NSN) 2Dokumen4 halaman(NSN) 2Hefri Noer RamadhanBelum ada peringkat
- D.listrik Magnet Muatan DiskritDokumen24 halamanD.listrik Magnet Muatan DiskritJeremia AnkesaBelum ada peringkat
- (NSN) 2Dokumen4 halaman(NSN) 2Hefri Noer RamadhanBelum ada peringkat
- ATAVISME GENDokumen8 halamanATAVISME GENHefri Noer RamadhanBelum ada peringkat