Latihan
Diunggah oleh
Warda 'adr' HasanahHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Latihan
Diunggah oleh
Warda 'adr' HasanahHak Cipta:
Format Tersedia
Latihan
Latihan Tentang Jenis Reaksi Termo Kimia
1. Bagaimanakah arah aliran kalor pada reaksi eksoterm ?
2. Ditehui reaksi : R P merupakan reaksi eksoterm.
a) Zat manakah ( R atau P ) yang mempunyai entalpi lebih besar ?
b) Bagaimanakan tanda (negatif / positif) untuk AH reaksi tersebut ?
3. Bagaimanakah tanda AH untuk reaksi berikut ?
a) H
2
O(l) H
2
O(g)
b) CH
4
(g) + 2O
2
(g) CO
2
(g) + H
2
O(g)
c) CaO(s) + H
2
O(l) Ca(OH)
2
(aq)
d) Fe(s) + S(s) FeS(s)
e) Ba(OH)
2
.8H
2
O(s) + 2NH
4
Cl(s) BaCl
2
.2H
2
O(s) + 2NH
3
(g) + 8H
2
O(l)
4. Diketahui dua reaksi berikut:
a) C(s) + O
2
(g) CO
2
(g) AH = 393,5 kJ
b) 2NH
3
(g) N
2
+ 3H
2
AH = 92 kJ
5. Tulis persamaan termokia untuk reaksi berikut:
a) Pembentukan asam cuka (l) dari unsur-unsurnya jika diketahui
o
f
H A
CH
3
COOH(l) = 487 kJ.mol
1
b) Peruraian amonium nitrat padat menjadi unsur-unsurnya jika diketahui
o
f
H A
NH
4
NO
3
(s) = 365,6 kJ.mol
1
c) Pembakaran sempurna 2 mol C
2
H
6
(g) jika diketahui pada pembakaran gas tsb
dibebaskan kalor 52 kJ.mol
1
d) Penguapan H
2
O(l) jika diketahui kalor penguapan air 2,45 kJ.mol
1
.
6. Jika 1,418 gram besi direaksikan dengan klorin (berlebihan), terbentuk 3,175 besi
(II) klorida dan dibebaskan kalor sebanyak 8,58 kJ. Tulislah persamaan
termokimia untuk reaksi tersebut.
7. Entalpi pembentukan gas asetilena adalah 226,7 kJ mol
1
. Tentukan perubahan
entalpi pada pembentukan 13 gram asetilena. (Ar C =12 ; H = 1).
Latihan Perhitungan Enthalphi Reaksi
1. Ke dalam 50 ml larutan tembaga (II) sulfat 0,4 M dimasukkan serbuk seng (agak
berlebihan), ternyata suhu naik 20
o
C. Dengan menganggap kalor jenis larutan
sama dengan kalor jenis air, yaitu 4,18 J g
1
K
1
dan kapasitas kalor wadah
diabaikan, tentukan AH reaksi:
Zn(s) + Cu
2+
(aq) Zn
2+
(aq) + Cu(s)
2. Tiga puluh tiga mili liter HCl 1,2 M dicampur dengan 42 ml larutan NaOH 1M
dalam sebuah wadah plastik. Suhu awal larutan masing-masing 25
O
C dan setelah
pencampuran suhu larutan menjadi 31,8
O
C. Apabila kapasitas kalor bejana dapat
diabaikan sedangkan kalor jenis larutan sama dengan kalor jenis air, yaitu 4,18 J
g
1
K
1
, tentukan perubahan entalpi reaksi: HCl(aq) + NaOH(aq) NaCl(aq)
+ H
2
O(l)
3. Pada pelarutan 15,3 g natrium nitrat dalam sebuah kalorimeter, terjadi penurunan
suhu dari 25
o
C menjadi 21,56
o
C. Jika kapasitas kalor larutan dan wadah adalah
1071 J
o
C
1
, tentukan perubahan entalphi pelarutan 1 mol NaNO
3
.
NaNO
3
(s) Na
+
(aq) + OH
AH = .........
4. Pada pembakaran 0,8 gram belerang menjadi belerang dioksida dalam suatu
kalorimeter terjadi kenaikan suhu dari 25
o
C menjadi 25,6
o
C. Tentukan perubahan
entalpi pada pembakaran 32 gram belerang jika kapasitas kalor dan wadahnya
10,67 kJ
o
C
1
.
5. Pada penetralan 25 ml NaOH 1 M dengan HCl 1M yang volumenya sama, terjadi
kenaikan suhu 6,8
o
C. Berapakah perubahan suhu, jika yang dinetralkan adalah
50 ml NaOH 0,5 M ?
Latihan Hukum Hess
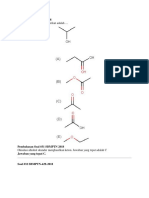
1. Ditentukan diagram siklus sebagai berikut:
Berdasarkan diagram di samping,
tentukanlah harga AH
1
Answer :
A B
C D
AH
1
AH
2
= 100 kJ AH
4
= 75 kJ
AH
3
= 50 kJ
2. Diketahui:
H
2
(g) + F
2
(g) 2HF(g) AH = 537 kJ
C(s) + 2F
2
(g) CF
4
(g) AH = 680 kJ
2C(s) + 2H
2
(g) C
2
H
4
(g) AH = 52,3 kJ
Tentkanlah AH reaksi:
C
2
H
4
(s) + 6F
2
(g) 2 CF
4
(g) + 4HF
Answer
C
2
H
4
(g) 2C(s) + 2H
2
(g) AH = 52,3 kJ
2H
2
(g) + 2F
2
(g) 4HF(g) AH = 1074 kJ
2C(s) + 4F
2
(g) 2CF
4
(g) AH = 1360 kJ
C
2
H
4
(s) + 6F
2
(g) 2 CF
4
(g) + 4HF AH = 2381,7 kJ
3. Diperkirakan pada lapisan stratosfir terjadi reaksi berikut:
HO(g) + Cl
2
(g) HOCl(g) + Cl(g)
Tentukanlah perubahan entalpi reaksi tersebut jika diketahui,
Cl
2
(g) 2Cl AH = 242kJ
H
2
O
2
(g) 2OH(g) AH = 134 kJ
H
2
O
2
(g) + Cl
2
(g) 2HOCl(g) AH = 209 Kj
Answer:
Cl
2
(g) 2Cl AH = 242 kJ
2OH(g) H
2
O
2
(g) AH = -134 kJ
H
2
O
2
(g) + Cl
2
(g) 2HOCl(g) AH = 209 kJ
2HO(g) + 2Cl
2
(g) 2HOCl(g) + 2Cl(g) AH = 101 kJ
HO(g) + Cl
2
(g) HOCl(g) + Cl(g) AH = 50,5 kJ
4. Diketahui entalpi pembakaran karbon (grafit), hidrogen, dan etanol(C
2
H
6
OH)
berturut-turut, yaitu 393,5 kJ mol
1
, 286 kJ mol
1
, dan 278 kJ mol
1
. Tentukan
entalpi pembentukan etano!
5. Diketahui entalpi pembentukan CO
2
(g) = 393,5 kJ mol
1
; H
2
O(l) = 242 kJ mol
1
dan C
2
H
8
(g) = 104 kJ mol
1
. Tentukanlah jumlah kalor yang dapat dibebaskan
jika 1 gram C
3
H
8
(g) dibakar sempurna membentu gas CO
2
dan air . (H = 1; C =
12)
Answer
[( ) ( )] ( )
Latihan Energi Atomisasi dan Energi Ikatan
1. Dengan menggunakan data berikut:
C(s) + O
2
(g) CO
2
(g) AH = 393,5 kJ
C(s) C(g) AH = +715 kJ
O
2
(g) 2O(g) AH = +249 kJ
Tentukanlah energi ikatan rata-rata C = O dalam CO
2
!
Answer :
C(s) + O
2
(g) CO
2
(g) AH = 393,5 kJ
( )
2. Diketahui AH
f
0
CH
4
(g) = 75 kJ mol
1
; A
H H
= 436 kJ mol
1
dan entalpi penguapan
C(s) = 715 kJ mol
1
, tentukan energi ikatan rata-rata C H dalam CH
4
(g)
Answer
[ ( )]
( )
3. Kalor pembentukan gas Cl
2
O = 75,2 kJ mol
1
Energi ikatan gas klorin = -242 kJ mol-
1
Energi ikatan gas oksigen = +496 kJ mol-
1
Hitunglah energi ikatan rata-rata untuk ikatan Cl O!
Answer :
( )
4. Jika diketahui AH pembentukan gas karbon dioksida (CO
2
), uap air (H
2
O), dan
gas propana (C
3
H
8
) berturut-turut, yaitu 393,5 kJ ; 241,8 kJ; dan 103,7 kJ.
tentukan banyak panas yang diberikan pada pembakaran 100 gram gas propana
(H = 1 ; C = 12 ; O = 16)
Answer:
C
3
H
8
+ 5O
2
3CO
2
+ 4H
2
O
[( ) ( )] ( )
D. EVALUASI
Pilihan Ganda
1. Pada proses eksoterm . . . . . . .
A. entalpi sistem bertambah dan perubahan entalpi positif
B. entalpi sistem berkurang dan perubahan entalpi negatif
C. entalpi sistem berkurang dan perubahan entalpi positif
D. entalpi sistem bertambah dan perubahan entalpi negatif
2. Manakah di antara proses berikut yang disertai dengan bertambahnya entalpi
sistem?
A. CH
4(g)
+ 2O
2(g)
CO
2(g)
+ 2H
2
O
(l)
B. NaOH
(s)
+ H
2
O
(l)
NaOH
(aq)
C. H
2
SO
4(l)
+ H
2
O
(l)
H
2
SO
4(aq)
D. Na
(g)
Na
+
(s)
+ e
3. Diketahui persamaan termokimia
2C
2
H
2(g)
+ 5O
2(g)
4CO
2(g)
+ 2H
2
O
(l)
AH = 2372,4 kJ
Pada pembakaran sempurna 5,6 liter C
2
H
2
(STP) . . . .
A. membebaskan 593,1 kJ C. diserap 296,55 kJ
B. memerlukan 593,1 kJ D. dibebaskan 296,55 kJ
4. Kalor pembentukan NH
4
Cl
(s)
pada keadaan standar adalah 314,4 kJ mol
-1
.
Persamaan mana dari persamaan termokimia di bawah ini yang menggambarikan
data tersebut ?
A. NH
3(g)
+ HCl
(g)
NH
4
Cl
(s)
AH = 314,4 kJ
B. NH
4
+
(g)
+ Cl
(g)
2NH
4
Cl
(s)
AH = 314,4 kJ
C. N
2(g)
+ 4H
2(g)
+ Cl
2(g)
2NH
4
Cl
(s)
AH = 628,8 kJ
D. NH
3(g)
+
1
/
2
H
2 (g)
+
1
/
2
Cl
2 (g)
NH
4
Cl
(s)
AH = 314,4 kJ
5. Diketahui entalpi pembakaran H
2(g)
, C (grafit), CH
4(g)
, dan C
2
H
4(g)
berturut-turut
adalah:
285,85 kjmol
-1
, 393,5 kj mol
-1
, 890,4 kJ mol
-1
, 1411 kJ mol
-1
.Pada
pembakaran 1 gram zat-zat berikut, manakah yang menghasilokan kalor paling
banyak . . . . .
A. H
2 (g)
B. C (grafit)
C. CH
4 (g)
D. C
2
H
4 (g)
6. Diketahui:
2C (grafit) + O
2(g)
2CO
(g)
AH = p kJ
C (grafit) + O
2(g)
CO
2(g)
AH = q kJ
2CO
(g)
+ O
2(g)
2CO
2(g)
AH = r kJ
Sesuai dengan hukum Hess, maka . . . .
A. p = q + r
B. 2q = p + r
C. q = 2(p + r)
D. p = q r
7. Bila diketahui kalor pembentukan gas C
2
H
4
dan C
2
H
6
berturut-turut adalah 51,8
kJ dan 84,4 kJ maka besar panas yang dibebaskan reaksi berikut ini adalah . . . .
C
2
H
4(g)
+ H
2(g)
C
2
H
6(g)
A. 32,6 kJ
B. 68,1 kJ
C. 136,2 kJ
D. 168,9 kJ
8. CO
(g)
+
1
/
2
O
2(g)
2CO
2(g)
AH = x kJ, x adalah entalpi . . . . .
A. pembentukan CO
B. penguraian CO
2
C. pembakaran CO
D. pembakaran CO
2
E. Pembentukan CO
2
9. Manakah di antara reaksi berikut yang perubahan entalpinya sama dengan energi
ikatan I I . . . .
A. I
2 (s)
2I
(g)
B. I
2 (s)
I
2(g)
C. I
2 (g)
2I
(g)
D.
1
/
2
I
2 (g)
I
(g)
10. Jika energi iikatan rata-rata dari"
C = C = 146 kkal/mol
C C = 83 kkal/mol
C H = 99 kkal/mol
C Cl = 79 kkal/mol
H Cl = 103 kkal/mol
maka perubahan entalpi pada adisi etena denganasam klorida menurut
persamaan:
H
2
C = CH
2
+ HCl CH
3
CH
2
Cl adalah sebesar ..
A. 510 kkal
B. 72,8 kkal
C. 12 kkal
D. 12 kkal
Uraian
1. Mengapa entalphi pembakaran karbon sama dengan entalphi pembentukan
karbon dioksida?
2. Berapa kalor yang dibebaskan pada pembakaran 1 gram metana jika kalor
pembakaran metana adalah x kJ/mol?
3. Jika energi ikatan N H adalah x J/mol, berapakah energi atomisasi
amoniak?
[ ]
[ ]
4. Apakah yang dimaksud dengan senyawa endoterm dan apa pula senyawa
eksoterm?
An exothermic compound is compuond that can occure exothermic reaction in
which relesased energy. This is associated with a decrease in the enthalpy of the
system and an increase in the temperature of the surroundings.
An endothermic compound is compound that can occure endothermic reaction in
which absorbed energy . This is associated with an increase in the enthalpy of the
system and decrease in the temperature of the surroundings.
Anda mungkin juga menyukai
- Rangkuman Dan Soal TermokimiaDokumen22 halamanRangkuman Dan Soal TermokimiaFatimatuz ZahroBelum ada peringkat
- Term Okimi ADokumen12 halamanTerm Okimi Awisokresno100% (1)
- Soal Dan Pembahasan Termokimia Kelas XiDokumen11 halamanSoal Dan Pembahasan Termokimia Kelas XiTsabita AfaaninBelum ada peringkat
- Latihan Contoh Soal Dan Jawaban Perubahan EntalpiDokumen12 halamanLatihan Contoh Soal Dan Jawaban Perubahan EntalpiPsaeBelum ada peringkat
- Soal KimiaDokumen9 halamanSoal KimiaDragon KnightBelum ada peringkat
- Bab II TermokimiaDokumen23 halamanBab II TermokimiaAttiya Sari0% (1)
- Ilham KurniawanDokumen8 halamanIlham KurniawanIlham KurniawanBelum ada peringkat
- Tes DiagnostikDokumen6 halamanTes Diagnostikyurianti lamaya50% (2)
- Soal Tentang Stokiometri 1Dokumen6 halamanSoal Tentang Stokiometri 1WidyaBelum ada peringkat
- Soal Dan Pembahasan Termokimia Kelas XI IPA Soal Dan Pembahasan Termokimia Kelas XI IPADokumen19 halamanSoal Dan Pembahasan Termokimia Kelas XI IPA Soal Dan Pembahasan Termokimia Kelas XI IPAirawati sholikhahBelum ada peringkat
- Soal Penyisihan + JawabanDokumen11 halamanSoal Penyisihan + JawabanAlexis PutraBelum ada peringkat
- Contoh Soal Dan Pembahasan Termokimia Bagian 1Dokumen24 halamanContoh Soal Dan Pembahasan Termokimia Bagian 1tari100% (1)
- Soal Dan Pembahasan Bab 8 Gas Ideal PDFDokumen3 halamanSoal Dan Pembahasan Bab 8 Gas Ideal PDFNaruto UzumakiBelum ada peringkat
- Kisi2 Dan EvaluasiDokumen8 halamanKisi2 Dan EvaluasiIda KhaerunnisahBelum ada peringkat
- Soal TermokimiaDokumen6 halamanSoal TermokimiaEmir Nobel ImaltinBelum ada peringkat
- Pembahasan Soal Kimia OSK (KSN) Tingkat Kabupaten/Kota 2020: Urip - InfoDokumen6 halamanPembahasan Soal Kimia OSK (KSN) Tingkat Kabupaten/Kota 2020: Urip - InfoMauly Simbolon100% (1)
- Soal Soal Laju ReaksiDokumen3 halamanSoal Soal Laju ReaksiFaizal Liestyandhi100% (1)
- Pas Kimia Kls Xi SMT Ganjil 2017-2018Dokumen21 halamanPas Kimia Kls Xi SMT Ganjil 2017-2018neneng rohayatiBelum ada peringkat
- Po 3 KimiaDokumen9 halamanPo 3 KimiaFatry LawangBelum ada peringkat
- Bab 7-Kesetimbangan KimiaDokumen31 halamanBab 7-Kesetimbangan KimiaMalik LamendoBelum ada peringkat
- OSP Kimia 2017Dokumen15 halamanOSP Kimia 2017Ria KastrianiBelum ada peringkat
- Soal TermodinamikaDokumen9 halamanSoal TermodinamikaBali32Gede Wisnu Ambara PutraBelum ada peringkat
- Tugas Kimia Laju ReaksiDokumen5 halamanTugas Kimia Laju ReaksiULanKiireiiy100% (1)
- Soal Sulit Asam BasaDokumen4 halamanSoal Sulit Asam Basasri0% (1)
- Bab 1-3 FixDokumen19 halamanBab 1-3 FixNatski IdBelum ada peringkat
- Laju ReaksiDokumen7 halamanLaju ReaksiAdi NugrahaBelum ada peringkat
- Bank Soal Kimia Bab Termokimia Dan HidrokarbonDokumen49 halamanBank Soal Kimia Bab Termokimia Dan HidrokarbonAini Damayanti100% (1)
- Kimia LmfaoDokumen18 halamanKimia Lmfaodying pcBelum ada peringkat
- Kisi Soal Fisika CardionDokumen15 halamanKisi Soal Fisika CardionSMA ALS AL-IZZAH BATUBelum ada peringkat
- Analisis MOdel PembelajaranDokumen6 halamanAnalisis MOdel PembelajaranRivellia KumalaBelum ada peringkat
- Tugas Jepang 2 Kelas Xi IpsDokumen1 halamanTugas Jepang 2 Kelas Xi IpsFarida LewangBelum ada peringkat
- 15benda TegarDokumen11 halaman15benda TegarMansur HarisBelum ada peringkat
- Kunci JawabanDokumen9 halamanKunci JawabanRudy SebatuBelum ada peringkat
- TermokimiaDokumen6 halamanTermokimiaRizal AdBelum ada peringkat
- Jawaban Soal PH LarutanDokumen5 halamanJawaban Soal PH LarutanAura AryantiBelum ada peringkat
- Soal Pilihan Ganda Materi Turunan Fungsi TrigonometriDokumen5 halamanSoal Pilihan Ganda Materi Turunan Fungsi TrigonometriAdela ResaniaBelum ada peringkat
- Latihan Soal Matematika Wajib Kelas XDokumen9 halamanLatihan Soal Matematika Wajib Kelas XAlviBelum ada peringkat
- Notasi SigmaDokumen12 halamanNotasi SigmaNurhadyati100% (1)
- Soal UraianDokumen5 halamanSoal UraiansilviaawdBelum ada peringkat
- Tujuan Pembelajaran:: T Menghubungkan Tetapan Hasil Kali Kelarutan Dengan Tingkat Kelarutan Atau PengendapannyaDokumen4 halamanTujuan Pembelajaran:: T Menghubungkan Tetapan Hasil Kali Kelarutan Dengan Tingkat Kelarutan Atau PengendapannyafitriBelum ada peringkat
- Termokimi ADokumen24 halamanTermokimi AYohanes SutrisnoBelum ada peringkat
- Soal KesetimbanganDokumen4 halamanSoal KesetimbanganKenny RBelum ada peringkat
- Kunci TermoDokumen5 halamanKunci TermonurjannahBelum ada peringkat
- Laju Reaksi SoalDokumen9 halamanLaju Reaksi SoalArief Maolana IbrahimBelum ada peringkat
- Soal Hots Energi IkatanDokumen1 halamanSoal Hots Energi Ikatanwarjo pmlBelum ada peringkat
- Gong LuangDokumen6 halamanGong LuangAlya SyauqiBelum ada peringkat
- Soal KoDokumen10 halamanSoal KoEka PrasetyaningsihBelum ada peringkat
- Penentuan Entalpi Energi IkatanDokumen4 halamanPenentuan Entalpi Energi IkatanHanna SalwaBelum ada peringkat
- 5 Cara Mencari EntalpiDokumen6 halaman5 Cara Mencari Entalpizakky100% (3)
- Soal Essayy Kesetimbangan KimiaDokumen10 halamanSoal Essayy Kesetimbangan KimiaFitarenica Talia PurbaBelum ada peringkat
- Contoh Soal Perubahan Entalpi Pilihan GandaDokumen4 halamanContoh Soal Perubahan Entalpi Pilihan GandaWinda CuteBelum ada peringkat
- TermodinamikaDokumen9 halamanTermodinamikaKharisma NugrahaBelum ada peringkat
- Kompetensi 6 Laju Reaksi Dan KesetimbanganDokumen10 halamanKompetensi 6 Laju Reaksi Dan KesetimbanganViskia Makrist100% (1)
- Soal Dan JawabanDokumen140 halamanSoal Dan Jawabannayla sakura hanumBelum ada peringkat
- Kelompok 2 Soal TermokimiaDokumen43 halamanKelompok 2 Soal TermokimiaBrama RizkyBelum ada peringkat
- Rangkuman Dan Soal TermokimiaDokumen12 halamanRangkuman Dan Soal TermokimiaDhea PrasiwiBelum ada peringkat
- Ulangan Harian Ke-2 Xi Mipa TermokimiaDokumen2 halamanUlangan Harian Ke-2 Xi Mipa Termokimia,sxjBelum ada peringkat
- Soal TermoDokumen4 halamanSoal TermoYoga Bririan JatiBelum ada peringkat
- Pembakaran 1 Mol KarbonDokumen7 halamanPembakaran 1 Mol KarbonsamsulBelum ada peringkat
- Surat Sponsor 1Dokumen20 halamanSurat Sponsor 1Warda 'adr' HasanahBelum ada peringkat
- Laporan KKN Desa WonosariDokumen80 halamanLaporan KKN Desa WonosariWarda 'adr' HasanahBelum ada peringkat
- Core Logrant Materi BufferDokumen5 halamanCore Logrant Materi BufferWarda 'adr' HasanahBelum ada peringkat
- Panduan Skripsi MIPADokumen59 halamanPanduan Skripsi MIPAEny SulistianiBelum ada peringkat
- Basic CompetencyDokumen1 halamanBasic CompetencyWarda 'adr' HasanahBelum ada peringkat
- Kelarutan Sebagai Fungsi Dari TemperaturDokumen8 halamanKelarutan Sebagai Fungsi Dari TemperaturWarda 'adr' HasanahBelum ada peringkat
- Isoterm Adsorption Karbon AktifDokumen13 halamanIsoterm Adsorption Karbon AktifWarda 'adr' HasanahBelum ada peringkat
- Jurnal EnzimDokumen3 halamanJurnal EnzimWarda 'adr' HasanahBelum ada peringkat
- Pembelajaran Kimia Berbasis Laboratorium 1Dokumen36 halamanPembelajaran Kimia Berbasis Laboratorium 1Warda 'adr' HasanahBelum ada peringkat
- Catatan StatistikaDokumen3 halamanCatatan StatistikaWarda 'adr' HasanahBelum ada peringkat
- Definisi Psikologi Pendidikan Menurut para AhliDokumen6 halamanDefinisi Psikologi Pendidikan Menurut para AhlimariafirmaBelum ada peringkat
- Artikel KWNDokumen4 halamanArtikel KWNWarda 'adr' HasanahBelum ada peringkat
- Mendongkrak Suara Lewat ArtisDokumen1 halamanMendongkrak Suara Lewat ArtisWarda 'adr' HasanahBelum ada peringkat
- Kimia Lingkungan 2Dokumen5 halamanKimia Lingkungan 2Warda 'adr' HasanahBelum ada peringkat
- NemathelminthesDokumen6 halamanNemathelminthesWarda 'adr' HasanahBelum ada peringkat
- Had ItsDokumen6 halamanHad ItsWarda 'adr' HasanahBelum ada peringkat