Dasar Reaksi Anorganik
Diunggah oleh
Ilm Nafsi0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
61 tayangan49 halamanRencana perkuliahan mata kuliah Dasar Reaksi Anorganik memberikan gambaran mengenai:
1) Materi pelajaran yang mencakup konsep-konsep dasar reaksi kimia anorganik seperti energi, ikatan kimia, dan reaksi dalam berbagai media,
2) Jadwal pertemuan selama semester yang meliputi ujian tengah dan akhir semester.
Deskripsi Asli:
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPT, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniRencana perkuliahan mata kuliah Dasar Reaksi Anorganik memberikan gambaran mengenai:
1) Materi pelajaran yang mencakup konsep-konsep dasar reaksi kimia anorganik seperti energi, ikatan kimia, dan reaksi dalam berbagai media,
2) Jadwal pertemuan selama semester yang meliputi ujian tengah dan akhir semester.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPT, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
61 tayangan49 halamanDasar Reaksi Anorganik
Diunggah oleh
Ilm NafsiRencana perkuliahan mata kuliah Dasar Reaksi Anorganik memberikan gambaran mengenai:
1) Materi pelajaran yang mencakup konsep-konsep dasar reaksi kimia anorganik seperti energi, ikatan kimia, dan reaksi dalam berbagai media,
2) Jadwal pertemuan selama semester yang meliputi ujian tengah dan akhir semester.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPT, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 49
RENCANA PERKULIAHAN
DASAR REAKSI ANORGANIK (2sks)
Minggu
ke
Materi
1 Pengertian reaksi kimia dan peranan energi dalam menentukan
arah reaksi
2 Konsep: elektronegativitas, ukuran dan muatan dlm senyawa
anorganik
3 Kekuatan ikatan kimia, ikatan ionik, ikatan kovalen, ikatan
koordinasi, ikatan logam
4 Peranan gaya kimia dalam reaksi anorganik
5 Eksistensi senyawa anorganik dalam beberapa media
6 Beberapa gaya kimia penting dalam reaksi anorganik, Ikatan
hidrogen dan peranannya dalam reaksi anorganik dalam air
7 Pengaruh temperatur dan faktor-faktor lain dalam kelarutan
senyawa anorganik dalam air
8 Ujian Tengah Semester
9 Mekanisme pelarutan senyawa anorganik dalam air
10 Reaksi anorganik dalam medium air
11 Sistem reaksi asam-basa
12 Sistem reaksi redoks dan Hubungannya dengan reaksi asam-
basa dengan
13 Reaksi anorganik dalam media non air
14 Sifat pelarut non air sebagai media reaksi anorganik
15 Contoh reaksi anorganik dalam berbagai media : NH
3
cair, SO
2
cair, HF cair, HCN cair, asam asetat
16 Ujian Akhir Semester
BAB I
ENERGI DALAM REAKSI KIMIA
Energi adalah kemampuan untuk melakukan kerja
Energi Radiasi berasal dari matahari dan
merupakan sumber energi utama di Bumi.
Energi Termal adalah energi yang berkaitan
dengan gerakan atom-atom dan molekul.
Energi Kimia tersimpan dalam satuan struktur
zat kimia.
Energi Nuklir merupakan energi yg tersimpan
dalam gabungan neutron dan proton pada atom.
Energi Potential adalah energi yang tersedia
akibat posisi suatu benda.
Kalor adalah perpindahan energi termal antara dua benda
yang suhunya berbeda.
Perubahan Energi dalam Reaksi Kimia
Suhu adalah ukuran energi termal.
90
0
C
40
0
C
Energi termalnya lbh besar
(walaupun suhunya lebih rendah)
Suhu = Energi Termal
Termokimia adalah ilmu yang mempelajari perubahan kalor
yang menyertai reaksi kimia.
Sistem adalah bagian tertentu dr alam yg menjadi perhatian kita.
terbuka
massa & energi Perpindahan:
tertutup
energi
terisolasi
tdk terjadi apa2
SISTEM
LINGKUNGAN
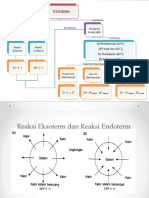
Proses eksotermik adalah setiap proses yang melepaskan
kalor (yaitu, perpindahan energi termal ke lingkungan).
Proses endotermik adalah setiap proses dimana kalor harus
disalurkan ke sistem oleh lingkungan.
2H
2
(g) + O
2
(g) 2H
2
O (l) + energi
H
2
O (g) H
2
O (l) + energi
energi + 2HgO (s) 2Hg (l) + O
2
(g)
Eksotermik Endotermik
6.2
Fungsi keadaan merupakan sifat-sifat yang ditentukan oleh
keadaan sistem, terlepas dari cara keadaan tersebut dicapai.
Energi potential gravitasi potensial
pendaki 1 dan pendaki 2 adalah sama,
tidak bergantung pada lintasan yang
dipilih.
energi , tekanan, volume, suhu
6.3
DE = E
k. akhir
E
k. awal
DP = P
k. akhir
P
k. awal
DV = V
k. akhir
- V
k. awal
DT = T
k. akhir
- T
k. awal
Hukum termodinamika pertama energi
dpt diubah dr satu bentuk ke bentuk yg lain,
tetapi tdk dpt diciptakan atau dimusnahkan.
DE
sistem
+ DE
lingkungan
= 0
or
DE
sistem
= -DE
lingkungan
C
3
H
8
+ 5O
2
3CO
2
+ 4H
2
O
Reaksi kimia eksotermik!
6.3
Energi kimia yg hilang dr pembakaran = Energi yg diperoleh dari lingkungan
sistem
lingkungan
Bentuk Hukum Pertama untuk DE
sistem
DE = q + w
DE perubahan energi dalam suatu sistem
q jumlah kalor yang dipertukarkan antar sistem dan lingkungan
w adalah kerja yang dilakukan pada (atau oleh) sistem tersebut
w = -PDV ketika gas memuai thd tekanan eksternal yg konstan
merupakan kerja yg dilakukan gas pd lingkungannya
Sistem menyerap kalor dari lingkungan: q bertanda +
Sistem melepas kalor ke lingkungan: q bertanda
Sistem melakukan kerja kpd lingkungan: w bertanda +
Sistem menerima kerja dari lingkungan: w bertanda -
Kerja yang Dilakukan pada Suatu Sistem
w = Fd
w = -P DV
P x V = x d
3
= Fd = w
F
d
2
DV > 0
-PDV < 0
w
sis
< 0
kondisi awal Kondisi akhir
Suatu sampel gas nitrogen volumenya memuai dari 1,6 L
menjadi 5,4 L pada suhu yg konstan. Berapakah kerja
yang dilakukan dalam satuan joule jika gas memuai pada
tekanan tetap 3,7 atm?
w = -P DV
DV = 5,4 L 1,6 L = 3,.8 L P = 3,7 atm
w = -3,7 atm x 3,8 L = -14,1 Latm
w = -14,1 Latm x
101,3 J
1Latm
= -1.430 J
Entalpi Reaksi Kimia
DE = q + w
DE = DH - PDV
DH = DE + PDV
q = DH dan w = -PDV
Pada tekanan konstan:
Entalpi (H) biasanya digunakan untuk menghitung aliran kalor
ke dalam atau ke luar sistem dalam suatu proses yang terjadi
pada tekanan konstan.
DH = H (produk) H (reaktan)
DH = kalor yg diberikan atau diterima selama rekasi pada tekanan konstan
H
produk
< H
reaktan
DH < 0
H
produk
> H
reaktan
DH > 0
Persamaan Termokimia
H
2
O (s) H
2
O (l) DH = 6,01 kJ
Apakah DH negatif atau positif?
Sistem menerima panas
Endotermik
DH > 0
6,01 kJ diterima untuk setiap 1 mol es yg meleleh
pada suhu 0
0
C dan tekanan 1 atm.
Persamaan Termokimia
CH
4
(g) + 2O
2
(g) CO
2
(g) + 2H
2
O (l) DH = -890,4 kJ
Apakah DH negatif atau positif?
Sistem melepas panas
Eksotermik
DH < 0
890,4 kJ dilepaskan untuk setiap pembakaran 1 mol
metana pada suhu 25
0
C dan tekanan 1 atm.
H
2
O (s) H
2
O (l) DH = 6,01 kJ
Koefisien stoikiometri selalu menunjukkan jumlah mol zat
Persamaan Termokimia
Ketika kita membalik suatu persamaan, kita mengubah
peran reaktan dan produk, DH sama tetapi berubah tanda
H
2
O (l) H
2
O (s) DH = -6,01 kJ
Jika kita mengalikan kedua ruas persamaan termokimia
dg suatu faktor n, maka DH jg harus berubah dg faktor yg
sama n.
2H
2
O (s) 2H
2
O (l) DH = 2 x 6,01 = 12,0 kJ
H
2
O (s) H
2
O (l) DH = 6.01 kJ
Kita harus selalu menuliskan wujud fisis semua reaktan
dan produk, karena akan membantu penentuan
perubahan entalpi yg sesungguhnya.
Persamaan Termokimia
H
2
O (l) H
2
O (g) DH = 44.0 kJ
Berapa kalor dihasilkan jika 266 g fosfor putih (P
4
) dibakar
di udara?
P
4
(s) + 5O
2
(g) P
4
O
10
(s) DH = -3.013 kJ
266 g P
4
1 mol P
4
123,9 g P
4
x
3.013 kJ
1 mol P
4
x = 6.470 kJ
Perbandingan DH dan DE
2Na (s) + 2H
2
O (l) 2NaOH (aq) + H
2
(g) DH = -367,5 kJ/mol
DE = DH - PDV pada 25
0
C, 1 mol H
2
= 24,5 L pd 1 atm
PDV = 1 atm x 24,5 L = 2,5 kJ
DE = -367,5 kJ/mol 2,5 kJ/mol = -370,0 kJ/mol
Tanda dari H dan Kespontanan
Semua reaksi pembakaran adalah spontan dan eksotermik:
CH
4 (g)
+ 2 O
2 (g)
CO
2 (g)
+ 2 H
2
O
(g)
H
o
rxn
= -802 kJ
Besi berkarat secara spontan dan eksotermik:
2 Fe
(s)
+ O
2 (g)
Fe
2
O
3 (s)
H
o
rxn
= -826 kJ
Senyawa-senyawa ion secara spontan terbentuk dari unsur-unsurnya
dgn melepas kalor:
Na
(s)
+ Cl
2 (g)
NaCl
(s)
3
2
1
2
H
o
rxn
= -411 kJ
Pd tekanan normal, air membeku di bawah 0C dan mencair di atas 0C.
keduanya adalah proses spontan, namun yang pertama termasuk eksotermik
sedangkan yang kedua termasuk endotermik.
H
2
O
(l)
H
2
O
(s)
H
o
rxn
= -6,02 kJ
(eksotermik; spontan pada T < 0
o
C)
H
2
O
(s)
H
2
O
(l)
H
o
rxn
= +6,02 kJ
(endotermik; spontan pada T > 0
o
C)
Apakah dengan menurunkan entalpi berarti bahwa
suatu proses terjadi secara spontan?
CH
4
(g) + 2O
2
(g) CO
2
(g) + 2H
2
O (l) DH
0
= -890.4 kJ
H
+
(aq) + OH
-
(aq) H
2
O (l) DH
0
= -56.2 kJ
H
2
O (s) H
2
O (l) DH
0
= 6.01 kJ
NH
4
NO
3
(s) NH
4
+
(aq) + NO
3
-
(aq) DH
0
= 25 kJ
H
2
O
Reaksi-reaksi Spontan
Entropi (S) adalah ukuran keacakan atau ketidakteraturan
suatu sistem.
teratur
S acak
S
DS = S
akhir
- S
awal
Jika perubahan mengakibatkan kenaikan keacakan
S
f
> S
i
DS > 0
Untuk semua zat, keadaan padatnya lebih teratur daripada
keadaan cair dan keadaan cairnya lebih teratur daripada
keadaan gas
S
padat
< S
cari
<< S
gas
H
2
O (s) H
2
O (l) DS > 0
Proses-proses
yang
menghasilkan
kenaikan entropi
(DS > 0)
Memprediksi Nilai Entropi Relatif
Soal:
1. Pilihlah yang memiliki entropi lebih tinggi dalam masing-masing soal
di bawah ini, dan jelaskan.
(a) 1 mol NaCl
(s)
atau 1 mol NaCl
(aq)
(b) 1 mol O
2
dan 2 mol H
2
atau 1 mol H
2
O
(c) 1 mol H
2
O
(s)
atau 1 mol H
2
O
(g)
(d) semangkuk sup pada 24
o
C atau pada 95
o
C
2. Apakah perubahan entropinya positif ataukah negatif untuk:
(a) pembekuan etanol
(b) penguapan bromin
(c) pelarutan urea di dalam air
(d) pendinginan gas N
2
Perubahan Entropi dalam suatu Sistem (DS
sis
)
aA + bB cC + dD
DS
0
dS
0
(D) cS
0
(C)
= [ + ] - bS
0
(B) aS
0
(A) [ + ]
DS
0
nS
0
(produk)
=
S mS
0
(reaktan) S -
Entropi reaksi standar (DS
0
) adalah perubahan entropi
untuk reaksi yang terjadi pada1 atm dan 25
0
C.
S
0
(CO) = 197,9 J/Kmol
S
0
(O
2
) = 205,0 J/Kmol
S
0
(CO
2
) = 213,6 J/Kmol
DS
0
= 2 x S
0
(CO
2
) [2 x S
0
(CO) + S
0
(O
2
)]
DS
0
= 427,2 [395,8 + 205,0] = -173,6 J/Kmol
Tentukan tanda dari perubahan entropi untuk reaksi
2Zn (s) + O
2
(g) 2ZnO (s)
Perubahan Entropi dalam Sistem (DS
sis
)
Ketika gas-gas dihasilkan (atau dipergunakan)
Jika reaksi menghasilkan gas lebih banyak
dibandingkan yang dipergunakan, DS
0
> 0.
Jika jumlah total molekul gas berkurang, DS
0
< 0.
Jika tidak ada perubahan bersih dalam jumlah total
molekul gas, maka DS
0
bisa positif atau negatif
TETAPI DS
0
nilainya akan kecil.
Tentukan tanda dari perubahan entropi untuk reaksi
2Zn (s) + O
2
(g) 2ZnO (s)
Jumlah total molekul gas berkurang, DS bertanda negatif.
DS
semesta
= DS
sis
+ DS
ling
> 0 Proses spontan :
DS
semesta
= DS
sis
+ DS
ling
= 0 Proses Kesetimbangan :
Energi Bebas Gibbs
Untuk proses suhu-konstan:
DG = DH
sis
-TDS
sis
Energi Bebas
Gibbs(G)
DG < 0 Reaksi spontan dalam arah maju.
DG > 0 Reaksi nonspontan. Reaksi ini spontan dalam arah
yang berlawanan.
DG = 0 Reaksi dalam kesetimbangan.
Kespontanan Reaksi dan Tanda untuk
H
o
, S
o
, and G
o
H
o
S
o
-T S
o
G
o
Keterangan
- + - - spontan pada semua T
+ - + + nonspontan pada semua T
+ + - + atau - spontan pada T tinggi;
nonspontan pada T rendah
- - + + atau - spontan pada T rendah;
nonspontan pada T tinggi
Reaksi endotermik bisa spontan hanya jika terdapat kenaikan
entropi (semakin tidak teratur).
aA + bB cC + dD
DG
0
dDG
0
(D)
f
cDG
0
(C)
f
= [ + ] - bDG
0
(B)
f
aDG
0
(A)
f
[ + ]
DG
0
nDG
0
(produk)
f
=
S
mDG
0
(reaktan)
f
S -
Energi-bebas reaksi standar (DG
0
) adalah perubahan energi
bebas suatu reaksi pada kondisi-kondisi standar.
Energi bebas pembentukan
standar adalah perubahan
energi bebas yang terjadi ketika 1
mol senyawa terbentuk dari unsur-
unsurnya pada keadaan standar.
DG
0
dari semua unsur dalam
bentuk standarnya adalah nol.
f
(DG
0
)
2C
6
H
6
(l) + 15O
2
(g) 12CO
2
(g) + 6H
2
O (l)
DG
0
nDG
0
(produk)
f
=
S
mDG
0
(reaktan)
f
S -
Berapakah perubahan energi bebas standar untuk reaksi
di bawah ini pada 25
0
C?
DG
0
6DG
0
(H
2
O)
f
12DG
0
(CO
2
)
f
= [ + ] - 2DG
0
(C
6
H
6
)
f
[ ]
DG
0
=
[ 12x394,4 + 6x237,2 ] [ 2x124,5 ] = -6405 kJ
DG
0
= -6405 kJ < 0
spontan
Persamaan penting yang menghubungkan antara
perubahan energi bebas gibbs dan konstanta
kesetimbangan.
G
o
= -RT ln K
CUKUP
KALORIMETRI
Kalor jenis (c) suatu zat adalah jumlah kalor yang dibutuhkan
untuk menaikkan suhu 1 gram zat sebesar 1 derajat Celcius.
Kapasitas kalor (C) suatu zat adalah jumlah kalor yang
dibutuhkan untuk menaikkan sejumlah zat sebesar 1 derajat
Celcius.
C = mc
Kalor (q) diterima atau dilepaskan:
q = mcDt
q = CDt
Dt = t
k. awal
- t
k. akhir
6.5
Berapa banyak kalor yang diberikan jika 869 g batang besi
didinginkan dari suhu 94
0
C menjadi 5
0
C?
c dr Fe = 0,444 J/g
0
C
Dt = t
k. akhir
t
k. awal
= 5
0
C 94
0
C = -89
0
C
q = mcDt = 869 g x 0,444 J/g
0
C x 89
0
C = -34.000 J
Kalorimeter Volume-Konstan
Tidak ada kalor yang diserap
atau dilepaskan!
q
reaksi
= - (q
air
+ q
bom
)
q
air
= mcDt
q
bom
= C
bom
Dt
6.5
Reaksi pd V konstan
DH ~ q
reaksi
DH = q
reaksi
Kalorimeter Tekanan-Konstan
Tidak ada kalor yang diserap
atau dilepaskan!
q
reaksi
= - (q
air
+ q
kal
)
q
air
= mcDt
q
kal
= Ck
al
Dt
6.5
Reaksi pada P Konstan
DH = q
reaksi
6.5
Kimia dalam Kehidupan:
Nilai Energi Makanan dan Zat Lainnya
C
6
H
12
O
6
(s) + 6O
2
(g) 6CO
2
(g) + 6H
2
O (l) DH = -2.801 kJ/mol
1 kal = 4.184 J
1 Kal = 1.000 kal = 4.184 J
6.5
Entalpi Pembentukan Standar (DH
0
) adalah perubahan
kalor yang dihasilkan ketika 1 mol suatu senyawa dibentuk
dari unsur-unsurnya pada tekanan 1 atm.
f
Entalpi pembentukan standar setiap unsur dalam
bentuknya yang paling stabil adalah nol.
DH
0
(O
2
) = 0
f
DH
0
(O
3
) = 142 kJ/mol
f
DH
0
(C, grafit) = 0
f
DH
0
(C, intan) = 1,90 kJ/mol
f
6.6
Entalpi reaksi standar (DH
0
) didefiniskan sebagai entalpi
reaksi yang berlangsung pada tekanan 1 atm.
reaksi
aA + bB cC + dD
DH
0
rxn
dDH
0
(D)
f
cDH
0
(C)
f
= [ + ] - bDH
0
(B)
f
aDH
0
(A)
f
[ + ]
DH
0
rxn
nDH
0
(produk)
f
=
S
mDH
0
(reaktan)
f
S -
6.6
Hukum Hess: bila reaktan diubah menjadi produk,
perubahan entalpinya adalah sama, terlepas apakah reaksi
berlangsung dalam satu tahap atau dalam beberapa tahap.
(Entaalpi adalah fungsi keadaan. Tidak peduli bagaimana
caranya, yg dilakukan adalah memulai dan mengakhirinya.)
Hitung entalpi pembentukan standar dari CS
2
(l) dimana:
C(grafit) + O
2
(g) CO
2
(g) DH
0
= -393,5 kJ
reaksi
S(rombik) + O
2
(g) SO
2
(g) DH
0
= -296.1 kJ
reaksi
CS
2
(l) + 3O
2
(g) CO
2
(g) + 2SO
2
(g) DH
0
= -1.072 kJ
rea
1. Tuliskan entalpi pembentukan standar untuk CS
2
C(grafit) + 2S(rombik) CS
2
(l)
2. Tambahkan reaksi yg diberikan shg hasilnya merupakan
reaksi yg diharapkan.
reaksi
C(grafit) + O
2
(g) CO
2
(g) DH
0
= -393,5 kJ
2S(rombik) + 2O
2
(g) 2SO
2
(g) DH
0
= -296,1x2 kJ
rea
CO
2
(g) + 2SO
2
(g) CS
2
(l) + 3O
2
(g) DH
0
= +1.072 kJ
rea
+
C(grafit) + 2S(rombik) CS
2
(l)
DH
0
= -393,5 + (2x-296,1) + 1.072 = 86,3 kJ
rea
6.6
Benzena (C
6
H
6
) terbakar diudara dan menghasilkan
karbon dioksida dan air cair. Berapakah panas yang
dilepaskan per mol oleh pembakaran benzena? Entalpi
pembentukan standar benzena adalah 49,04 kJ/mol.
2C
6
H
6
(l) + 15O
2
(g) 12CO
2
(g) + 6H
2
O (l)
DH
0
rea
nDH
0
(produk)
f
=
S
mDH
0
(reaktan)
f
S -
DH
0
rea
6DH
0
(H
2
O)
f
12DH
0
(CO
2
)
f
= [ + ] - 2DH
0
(C
6
H
6
)
f
[ ]
DH
0
rea
=
[ 12x393,5 + 6x285.8 ] [ 2x49,04 ] = -5.946 kJ
-5.946 kJ
2 mol
= - 2.973 kJ/mol C
6
H
6
6.6
entalpi pelarutan (DH
soln
) adalah panas yang dilepaskan atau
diterima ketika sejumlah zat larut dalam sejumlah tertentu zat
pelarut.
DH
soln
= H
larutan
- H
komponen
6.7
Zat manakah yang dapat
digunakan untuk mencairkan
es?
Zat manakah yang dapat
digunakan untuk pendingin?
Proses pencairan NaCl
DH
cair
= Tahap 1 + Tahap 2 = 788 784 = 4 kJ/mol
6.7
Anda mungkin juga menyukai
- TermodinamikaDokumen47 halamanTermodinamikaWillybrordus PramudhitaBelum ada peringkat
- Kimia Anorganik IiDokumen46 halamanKimia Anorganik Iiapriyandika950Belum ada peringkat
- KimiaDokumen63 halamanKimiaFitra SaputraBelum ada peringkat
- Termokimia IDokumen38 halamanTermokimia Ibubble beeBelum ada peringkat
- ThermokimiaDokumen35 halamanThermokimiaVicky raihan akbar 068Belum ada peringkat
- Hubungan Energi Dalam Reaksi KimiaDokumen36 halamanHubungan Energi Dalam Reaksi Kimiadewilestari6372Belum ada peringkat
- Hubungan Energi Dalam Reaksi KimiaDokumen32 halamanHubungan Energi Dalam Reaksi KimiaAllensius Karelsta HarefaBelum ada peringkat
- TermodinamikaDokumen38 halamanTermodinamikaHafidzah RaBelum ada peringkat
- Termokimia 1 PDFDokumen33 halamanTermokimia 1 PDFMaria P RisrianiBelum ada peringkat
- TermokimiaDokumen31 halamanTermokimiabellaBelum ada peringkat
- EnergetikaDokumen25 halamanEnergetikaDHe Vic'zBelum ada peringkat
- 7 Energibebasgibbs 140612231233 Phpapp01Dokumen40 halaman7 Energibebasgibbs 140612231233 Phpapp01Rendi MulyadiBelum ada peringkat
- Bab6 Hubungan Energi Dalam Reaksi KimiaDokumen31 halamanBab6 Hubungan Energi Dalam Reaksi KimiaMuhammad Firdaus FebriansyahBelum ada peringkat
- 3 Termokimia Hukum HessDokumen29 halaman3 Termokimia Hukum HessDiLa Resti WahyuniBelum ada peringkat
- Bab6-Kesetimbangan KimiaDokumen42 halamanBab6-Kesetimbangan KimiaRicky_Pratama_PulBelum ada peringkat
- Termodinamika KimiaDokumen25 halamanTermodinamika KimiaSaputra RaharjaBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Materi 2 Dasar TermodinamikaDokumen56 halamanMateri 2 Dasar TermodinamikaNurul InsaniawatiBelum ada peringkat
- ThermodynamicsDokumen36 halamanThermodynamicsMarkus Renaldy CristopanBelum ada peringkat
- Termokimia 2Dokumen25 halamanTermokimia 2Julia CitraBelum ada peringkat
- Modul Xi Kimia SMT 2Dokumen21 halamanModul Xi Kimia SMT 2zainalBelum ada peringkat
- TermodinamikaDokumen28 halamanTermodinamikagfasahi2Belum ada peringkat
- TERMOKIMIADokumen63 halamanTERMOKIMIAAri Sofyan SauriBelum ada peringkat
- TermokimiaDokumen27 halamanTermokimianrangwesthiBelum ada peringkat
- Termokimia Kelas XiDokumen4 halamanTermokimia Kelas XidwiBelum ada peringkat
- Termodinamika KimiaDokumen25 halamanTermodinamika Kimiasembulungan2Belum ada peringkat
- Laporan Reaksi Eksoterm Dan Reaksi EndotermDokumen11 halamanLaporan Reaksi Eksoterm Dan Reaksi EndotermTheodorus Garry Putra GanaBelum ada peringkat
- Thermo Dina MikaDokumen33 halamanThermo Dina MikaDada DoniBelum ada peringkat
- Termokimia Sman GabunganDokumen42 halamanTermokimia Sman Gabunganmamanya inchanBelum ada peringkat
- 4 Entropi Spontanitas ReaksiDokumen32 halaman4 Entropi Spontanitas ReaksiPamungkas Febrinalditya GautamaBelum ada peringkat
- 4 Entropi Spontanitas ReaksiDokumen32 halaman4 Entropi Spontanitas ReaksiIbu_MiminBelum ada peringkat
- TermokimiaDokumen65 halamanTermokimiaDarmawan Ardyansyah 17Belum ada peringkat
- Hukum Termodinamika IiDokumen4 halamanHukum Termodinamika IiAllensius Karelsta HarefaBelum ada peringkat
- Modul 10Dokumen24 halamanModul 10Aditya ayuwulandaBelum ada peringkat
- Termokimia (12-13) PDFDokumen83 halamanTermokimia (12-13) PDFYuliantari YuliantariBelum ada peringkat
- I - ThermokimiaDokumen111 halamanI - ThermokimiaTheresia AustinBelum ada peringkat
- Chang18 TermodinamikaDokumen25 halamanChang18 Termodinamikanurullqalby100% (1)
- Materi TermokimiaDokumen32 halamanMateri Termokimianurhikmah_88Belum ada peringkat
- Termokimia PDFDokumen42 halamanTermokimia PDFstrygwyrgtBelum ada peringkat
- Termokimia 2Dokumen83 halamanTermokimia 2Smahangtuah MakassarBelum ada peringkat
- TERMODINAMIKADokumen22 halamanTERMODINAMIKAMau LydiaBelum ada peringkat
- TermodinamikaDokumen52 halamanTermodinamikacinantyaBelum ada peringkat
- Materi 3.termodinamika Agust 19Dokumen52 halamanMateri 3.termodinamika Agust 19sela septiani kusmayadiBelum ada peringkat
- Presentasi 2Dokumen23 halamanPresentasi 2anita sukariniBelum ada peringkat
- TERMOKIMIA MateriDokumen30 halamanTERMOKIMIA MateriYolanda Nda AdindaBelum ada peringkat
- Kel 4Dokumen33 halamanKel 4Moch Ilham RachaelBelum ada peringkat
- Termokimia PPTXDokumen23 halamanTermokimia PPTXEfrin SitumorangBelum ada peringkat
- Slide Termodinamika Kimia NewDokumen51 halamanSlide Termodinamika Kimia NewparelBelum ada peringkat
- TermokimiaDokumen14 halamanTermokimiaAr Rahman MugaBelum ada peringkat
- TermokimiaDokumen41 halamanTermokimiaHanifahDwi SaharaBelum ada peringkat
- Panas ReaksiDokumen36 halamanPanas ReaksiVickiBelum ada peringkat
- NEW - TermokimiaDokumen3 halamanNEW - TermokimiaLintang Punggi zahra 22Belum ada peringkat
- 1 Bab6 Hubungan Energi Dalam Reaksi KimiDokumen37 halaman1 Bab6 Hubungan Energi Dalam Reaksi KimiYuda AdiBelum ada peringkat
- TermokimiaDokumen40 halamanTermokimiaMega RestiaBelum ada peringkat
- TERMOKIMIADokumen37 halamanTERMOKIMIATM-21-084 RIFQI TUBAGUS HILMIBelum ada peringkat
- 5 - TermokimiaDokumen26 halaman5 - Termokimiapopyafifah00Belum ada peringkat
- CARBON-NANOTUBE KirimDokumen8 halamanCARBON-NANOTUBE KirimIlm NafsiBelum ada peringkat
- Biodiesel PDFDokumen15 halamanBiodiesel PDFIlm NafsiBelum ada peringkat
- Nanoteknologi1 PDFDokumen4 halamanNanoteknologi1 PDFIlm NafsiBelum ada peringkat
- Nanoteknologi2 PDFDokumen10 halamanNanoteknologi2 PDFIlm NafsiBelum ada peringkat
- Makalah 9 Proc Seminar Fisika HFI 2008 PDFDokumen8 halamanMakalah 9 Proc Seminar Fisika HFI 2008 PDFIlm NafsiBelum ada peringkat
- BATUBARA1Dokumen47 halamanBATUBARA1Wilson JelekBelum ada peringkat
- Gas MuliaDokumen1 halamanGas MuliaIlm NafsiBelum ada peringkat
- Bahan Bakar Alternatif Pengganti BBMDokumen5 halamanBahan Bakar Alternatif Pengganti BBMIlm NafsiBelum ada peringkat
- Carbon Nanotube PDFDokumen12 halamanCarbon Nanotube PDFIlm NafsiBelum ada peringkat
- Unsur Transisi Periode 3Dokumen2 halamanUnsur Transisi Periode 3AanBelum ada peringkat
- Apa Itu Learn IndonesiaDokumen2 halamanApa Itu Learn IndonesiaIlm NafsiBelum ada peringkat
- Gas Hidrat Sebagai Energi AlternatifDokumen4 halamanGas Hidrat Sebagai Energi AlternatifIlm NafsiBelum ada peringkat
- Aplikasi Nanosains Dalam Kehidupan SehariDokumen9 halamanAplikasi Nanosains Dalam Kehidupan SeharihestysukmaBelum ada peringkat
- HalogenDokumen2 halamanHalogenIlm NafsiBelum ada peringkat
- Lindungi Bumi KitaDokumen4 halamanLindungi Bumi KitaIlm NafsiBelum ada peringkat
- Alkali TanahDokumen1 halamanAlkali TanahIlm NafsiBelum ada peringkat
- AlkaliDokumen2 halamanAlkaliIlm NafsiBelum ada peringkat
- Penggunaan Turunan Dalam KalkulusDokumen16 halamanPenggunaan Turunan Dalam KalkulusIlm NafsiBelum ada peringkat
- Energi Terbarukan Adalah Topik Yang Sangat Populer Dewasa IniDokumen1 halamanEnergi Terbarukan Adalah Topik Yang Sangat Populer Dewasa IniIlm NafsiBelum ada peringkat
- Kelemahan Dan Keunggulan Energi TerbarukanDokumen2 halamanKelemahan Dan Keunggulan Energi TerbarukanAanBelum ada peringkat
- 2013 Ukt UgmDokumen3 halaman2013 Ukt UgmAbiz Na ImoetBelum ada peringkat
- Destilasi BertingkatDokumen3 halamanDestilasi BertingkatIlm NafsiBelum ada peringkat
- Beasiswa Unggulan Monash InstituteDokumen2 halamanBeasiswa Unggulan Monash InstituteIlm NafsiBelum ada peringkat
- Pemanfaatan Sumber Energi Tenaga SuryaDokumen5 halamanPemanfaatan Sumber Energi Tenaga SuryaIlm NafsiBelum ada peringkat
- Makalah Matematika DasarDokumen14 halamanMakalah Matematika DasarIlm NafsiBelum ada peringkat
- Fenomena Kimia Pada Telur Dan UbiDokumen1 halamanFenomena Kimia Pada Telur Dan UbiIlm NafsiBelum ada peringkat
- Kloning ManusiaDokumen2 halamanKloning ManusiaIlm NafsiBelum ada peringkat
- Fenomena Kimia Pada Telur Dan UbiDokumen1 halamanFenomena Kimia Pada Telur Dan UbiIlm NafsiBelum ada peringkat
- Bagaimana Gas Alam TerbentukDokumen3 halamanBagaimana Gas Alam TerbentukIlm NafsiBelum ada peringkat
- Aplikasi Titrasi PengendapanDokumen54 halamanAplikasi Titrasi Pengendapanrandy17farm50% (2)