Hukum Faraday 2013
Diunggah oleh
Astri Ggamjong Xiao LuHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Hukum Faraday 2013
Diunggah oleh
Astri Ggamjong Xiao LuHak Cipta:
Format Tersedia
Hukum Faraday
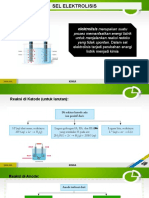
Pembahasan dalam artikel ini merupakan kelanjutan dari sel elektrolisis, jadi tentang sel elektrolisis harus kalian fahami
terlebih dahulu. Bila dalam sel elektrolisis dibahas penulisan reaksi di katoda dan anoda maka pada pembahasan kali ini
adalah perhitingan matematisnya.
Hukum Faraday I
Jumlah massa zat yang dihasilkan pada katoda atau anoda berbanding lurus dengan jumlah listrik yang digunakan
selama elektrolisis.
Apabila arus listrik sebesar 1 Faraday ( 1 F dialirkan ke dalam sel maka akan dihasilkan !
1 eki"alen zat yang disebut massa eki"alen (e
1 mol elektron ( e
#
"sebelum melanjutkan materi.... yang perlu diperhatikan adalah lambang massa ekivelen mirip dengan lambang elektron,
pada penulisan lambang elektron ada yang menuliskan e dan ada juga yang menyertakan muatannya e
-
. Untuk
membedakan dengan lambang massa ekivalen maka muatan pada elektron saya cantumkan."
Cara menghitung massa ekivalen (e) :
e $ Ar %nsur & jumlah muatan ionnya
sebagai 'ontoh jika 1 F dialirkan ke reaksi elektrolisis !
(u
)*
* )e
#
+ (u
maka massa eki"alen ( e logam (u (Ar (u $ ,-,. $ e (u $ ,-,.&) $ -1,/.
jika arus listrik diperbesar menjadi ) kalinya massa (u yang diendapkan juga dikali ).
0alam penulisan perbandingan mol suatu reaksi yang dijadikan patokan adalah mol dari elekrton.....
1 F = 1 mol e
(penting banget.... !
jika mol elektron $ 1 mol maka !
(u
)*
* )e
#
+ (u
1&) mol 1 mol 1&) mol
Hubungan Muatan Listrik dengan Arus Listrik
1eterangan !
( $ muatan listrik ( (oloumb
2 $ arus listrik ( Ampere
t $ 3aktu ( sekon
sedangkan hubungan antara Faraday dan muatan listrik ( ( !
maka rumus Faraday !
dan massa logam yang diendapkan !
(ontoh soal!
0alam elektrolisis Fe456 digunakan listrik sebesar 7,6 F. 8itung massa Fe (Ar Fe $ ., yang dihasilkan di katoda9
reaksi penguraiannya !
Fe456 + Fe
)*
* 456
#
(ingat... muatan 456 itu hafalan.....
reaksi pada katoda !
Fe
)*
* )e
#
+ Fe
Jadi muatan Fe ( n Fe $ )
massa eki"alen Fe ( e Fe $ .,&) $ ):
m Fe = e.F
$ ):.7,6 $ 11,) gram
cara lain.... bisa juga dihitung dengan prinsip Faraday $ mol elektron, maka perbandingan mol dari persamaan reaksi di
atas !
Fe
)*
* )e
#
+ Fe
7,) mol 7,6 mol 7,) mol
m Fe $ mol Fe . Ar Fe $ 7,) mol . ., $ 11,) gram
antara ) 'ara di atas ada kelebihannya masing#masing..... untuk 'ara pertama sebenarnya jika tahu muatan Fe $ *)
maka sebenarnya massa Fe dapat di'ari langsung dengan rumus tanpa menuliskan persamaan reaksinya....
sedangkan
(ara yang terakhir itu lebih umum... dapat menyelesaikan berbagai soal dalam bab ini.....
misalnya ada pertanyaan lanjutan !
Berapa "olume gas oksigen yang dihasilkan pada anoda dalam keadaan 4;P9
456 adalah sisa asam yang mengandung oksigen berarti yang bereaksi pada anoda adalah air !
)8)5(a< + 68
*
(a< * 5)(g * 6e
#
7,1 mol 7,6 mol
ingat perbandingan mol = koefisien reaksi jika 6e
#
$ 7,6 mol maka satu 5) $ 7,1 mol
setelah mol oksigennya tahu.... tinggal di'ari "olumenya dengan rumus stokiometri !
=olume 5) $ mol 5) . )),6 liter $ 7,1 . )),6 liter $ ),)6 liter
Hubungan Hukum Faraday dengan Elektrolisis
Jika arus listrik 1 A dialirkan ke dalam 177 ml larutan perak nitrat Ag>5- melalui
elektroda Pt selama 1?-7 detik maka hitunglah Ph nya9
elektrolisis larutan Ag>5- dengan elektroda Pt
1atoda (* ! Ag
*
(a< * e
#
+ Ag(s
Anoda (# ! )8)5(a< + 68
*
(a< * 5)(g * 6e
#
reaksi pada anoda terlihat dihasilkan ion 8
*
maka larutan tersebut bersifat asam. mula) kita 'ari dahulu muatan yang
le3at dalam larutan !
karena F = mol elektron maka mol e
#
$ 7,7) mol
)8)5(a< + 68
*
(a< * 5)(g * 6e
#
7,7) mol 7,7) mol
konsentrasi 8 dalam larutan !
Ph nya ! 1 # log ) (masih ingat 'aranya kan...
Hukum Faraday II
Apabila ) sel atau lebih dialiri arus listrik dalam jumlah yang sama (disusun seri maka perbandingan massa zat#zat yang
dihasilkan sebanding dengan massa eki"alen (e zat#zat tersebut.
Keterangan :
m $ massa zat dalam gram
e $ massa eki"alen zat
Ar $ massa molekul relatif
n $ muatan ion positif zat&kation
Contoh :
1. Jika arus listrik dialirkan melalui larutan Ag>5- dan >i (>5-) yang disusun seri maka akan terjadi endapan perak
sebanyak )/ gram. 8itung massa endapan nikel yang terjadi9 (Ar Ag $ 17: dan Ar >i $ .?
n Ag $ 1 dan n >i $ )
m Ag ! m >i $ Ar Ag&n Ag ! Ar >i&n >i
)/ ! m >i $ 17:&1 ! .?&)
m >i $ /,-/. gram
). Pada elektrolisis (u(l
)
arus listrik yang digunakan 7,) A dan dalam 3aku ).
menit .
;entukan reaksi elektrolisa (u (l
)
menggunakan elektroda Pt dan berapa 'u
yang mengendap di katoda ( Ar (u $ ,-,.
Anda mungkin juga menyukai
- Kinetika KorosiDokumen6 halamanKinetika KorosiOnggy Aries SekaBelum ada peringkat
- ELEKTROLISISDokumen25 halamanELEKTROLISISrika umamiBelum ada peringkat
- Sel ElektrolisisDokumen15 halamanSel ElektrolisisMarganingtyas Wicaksanti0% (1)
- Hukum FaradayDokumen30 halamanHukum FaradayIndri Agisti100% (1)
- ELEKTROLISISDokumen8 halamanELEKTROLISISAbdullah Nizhamuddin AminBelum ada peringkat
- Hukum Faraday 1 Dan 2Dokumen6 halamanHukum Faraday 1 Dan 2Intan Shabrina100% (1)
- Elektrokimia PDFDokumen8 halamanElektrokimia PDFLidya PurwasihBelum ada peringkat
- Modul Redoks Dan ElektrokimiaDokumen6 halamanModul Redoks Dan ElektrokimiaGiovany ValenciaBelum ada peringkat
- Kimia - Sel Elektrolisis Dan Hukum FaradayyyyDokumen10 halamanKimia - Sel Elektrolisis Dan Hukum FaradayyyyCaca SelaBelum ada peringkat
- PARAMETERDokumen10 halamanPARAMETERVika XieBelum ada peringkat
- FaradayDokumen5 halamanFaradayMuhamad IhsanBelum ada peringkat
- Hukum Faraday EditDokumen21 halamanHukum Faraday EditTaulifa MudrikhaBelum ada peringkat
- LKPD Hk. FaradayDokumen3 halamanLKPD Hk. FaradayGiska AmeliaBelum ada peringkat
- Makalah ElektrolisisDokumen12 halamanMakalah ElektrolisisTasya AristaBelum ada peringkat
- Bahan Ajar Sel ElektrolisisDokumen9 halamanBahan Ajar Sel ElektrolisisIndriani Nur HiyaharaBelum ada peringkat
- Laporan Praktikum Elektro 3Dokumen19 halamanLaporan Praktikum Elektro 3Yuliansyah DharmaputraBelum ada peringkat
- 5 Konsep Mol Dan StoikiometriDokumen19 halaman5 Konsep Mol Dan StoikiometriMika FebryatiBelum ada peringkat
- Ringkasan Materi Kimia SMADokumen6 halamanRingkasan Materi Kimia SMADia Andri WijayadiBelum ada peringkat
- Sel Elektrolisis XII MIA 3Dokumen14 halamanSel Elektrolisis XII MIA 3Era MelaniaBelum ada peringkat
- Penamaan SenyawaDokumen9 halamanPenamaan SenyawaJimmi MamahitBelum ada peringkat
- Bahan Ajar Hukum Faraday FixDokumen8 halamanBahan Ajar Hukum Faraday FixAnggelika PaiBelum ada peringkat
- Tugas Kimia Fisika IIIDokumen6 halamanTugas Kimia Fisika IIIPurnamadewi ErnaBelum ada peringkat
- Kumpulan Soal Kimia Dan PembahasanDokumen28 halamanKumpulan Soal Kimia Dan PembahasanEllo I. Mutia100% (1)
- Reaksi Redoks Dan ElektrokimiaDokumen19 halamanReaksi Redoks Dan ElektrokimiaErwin Nur CahyantoBelum ada peringkat
- KSTB ElektrokimiaDokumen37 halamanKSTB ElektrokimiaRoza FaradillaBelum ada peringkat
- Resume Sel ElektrolisisDokumen10 halamanResume Sel ElektrolisisUlylhilmiBelum ada peringkat
- Makalah Sel EloktrokimiaDokumen13 halamanMakalah Sel EloktrokimiaFisal Soamole FadilahBelum ada peringkat
- 2 Bahan Ajar Sel ElektrolisisDokumen9 halaman2 Bahan Ajar Sel ElektrolisisAmmar FarabyBelum ada peringkat
- Elektroplating Pik Xi KiDokumen20 halamanElektroplating Pik Xi KiZaynBelum ada peringkat
- Hukum FaradayDokumen5 halamanHukum FaradayFAYSAL SMAN 5 KendariBelum ada peringkat
- Bahan Ajar ElektrolisisDokumen15 halamanBahan Ajar ElektrolisisWanda ErsintaBelum ada peringkat
- Kimia Analitik - Pemisahan Secara ElektrolisisDokumen16 halamanKimia Analitik - Pemisahan Secara ElektrolisisPutri Halimah100% (1)
- Resume Kelompok 7 - ElektrokimiaDokumen9 halamanResume Kelompok 7 - ElektrokimiaReVengeR 178 PBGIBelum ada peringkat
- Laporan Praktikum Kimia FisikaDokumen19 halamanLaporan Praktikum Kimia FisikaAdela ShofiaBelum ada peringkat
- Redoks ElektrokimiaDokumen30 halamanRedoks ElektrokimiaRIFQUU G.IBelum ada peringkat
- ELEKTROLISISDokumen7 halamanELEKTROLISISRyan Nazwan HidayatBelum ada peringkat
- Kelompok 2 TGS Pekan IiiDokumen30 halamanKelompok 2 TGS Pekan Iii13. La Ode Muh. Arya Zaltian P.Belum ada peringkat
- Sel ElektrolisisDokumen13 halamanSel ElektrolisisfikarakhmalindaBelum ada peringkat
- Makalah Sel ElektrolisisDokumen13 halamanMakalah Sel ElektrolisisDiah Mega100% (1)
- Contoh Soal Uts Bag 2Dokumen5 halamanContoh Soal Uts Bag 2Teguh RamadhanBelum ada peringkat
- Redoks Dan ElektrokimiaDokumen9 halamanRedoks Dan ElektrokimiaAndreanSaputraBelum ada peringkat
- FaradayDokumen28 halamanFaradayDewa Ayu WismayantiBelum ada peringkat
- Hukum FaradayDokumen8 halamanHukum FaradayNay ShelinglungBelum ada peringkat
- Elektrogravimetri MilaDokumen13 halamanElektrogravimetri MilaAprimaRezaBelum ada peringkat
- Rangkuman Kimia LanjutanDokumen19 halamanRangkuman Kimia LanjutanR. Addo Athallasyah Teknologi PanganBelum ada peringkat
- Kelompok 6 Kimia Dasar Farmasi: ElektrokimiaDokumen19 halamanKelompok 6 Kimia Dasar Farmasi: ElektrokimiaDr YurizalBelum ada peringkat
- Struktur AtomDokumen19 halamanStruktur Atomnur'arina ardiniBelum ada peringkat
- Fitri ElektrokimiaDokumen8 halamanFitri ElektrokimiaFitria YunusBelum ada peringkat
- 15 16 Denture WaxDokumen36 halaman15 16 Denture WaxAstri Ggamjong Xiao LuBelum ada peringkat
- GTCDokumen41 halamanGTCAstri Ggamjong Xiao LuBelum ada peringkat
- 12 13 Memilih Bentuk Dan Warna Gigi & Penyusunan GigiDokumen27 halaman12 13 Memilih Bentuk Dan Warna Gigi & Penyusunan GigiAstri Ggamjong Xiao LuBelum ada peringkat
- Outline Form Orifice Gigi IDokumen2 halamanOutline Form Orifice Gigi IAstri Ggamjong Xiao LuBelum ada peringkat
- Gambaran Radiografi ASTRIDokumen2 halamanGambaran Radiografi ASTRIAstri Ggamjong Xiao LuBelum ada peringkat
- Laporan Praktikum PADokumen12 halamanLaporan Praktikum PAAstri Ggamjong Xiao LuBelum ada peringkat
- Proposal KegiatanDokumen15 halamanProposal KegiatanAstri Ggamjong Xiao LuBelum ada peringkat