Kimia Organik
Diunggah oleh
mifta_huda200495100%(9)100% menganggap dokumen ini bermanfaat (9 suara)
2K tayangan48 halamankimia organik untuk universitas
Judul Asli
Kimia Organik
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inikimia organik untuk universitas
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
100%(9)100% menganggap dokumen ini bermanfaat (9 suara)
2K tayangan48 halamanKimia Organik
Diunggah oleh
mifta_huda200495kimia organik untuk universitas
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 48
Akademis IMTK 2014
Bersatu dan Peduli
Menebar Manfaat
KIMIA
ORGANIK
26
27
28
29
30
31
32
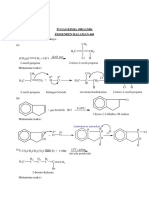
UTS Kimia Organik 1
1. Within the last month an experimental drug (now just called PDX 101 structure shown
in the box below) entered into phase 2 clinical trials for treatment of patients with
advanced multiple myloma or lymphoma (types of cancer). How many carbon atoms are
present in PDX 101? (A) 11 (B) 12 (C) 15 (D) 16 (E) 17
Jawab : 15.(C)
Jumlah atom karbon pada PDX 101
Setiap titik sudut pada gambar merupakan penggambaran atom karbon gambar detailnya
adalah:
Jadi, banyaknya atom karbon adalah 15.
33
2. How many hydrogen atoms are present in PDX 101? (A) 8 (B) 11 (C) 12 (D) 14 (E) 15
Jawab: 14.(D)
Jumlah atom hidrogen pada PDX 101 dihitung berdasarkan jumlah tangan yang tersisa
dari setiap dari setiap atom C.
Jadi, jumlah atom hidrogen adalah 14.
3. What is the relationship of the molecule shown in the box below to PDX 101?
(A) It is identical molecule
(B) It is constitutional isomer
(C) It is conformational isomer
(D) It is configuration isomer
Jawab : Isomer konfigurasi(D)
Hubungan antara
34
dengan
Maka hubungan antara keduanya adalah isomer konfigurasi.
Penjelasan mengenai jenis-jenis isomer:
1.) Molekul identik
Molekul identik adalah dua molekul yang sama namun dalam penggambarannya
terlihat seperti isomer.
(Lengkap baca Fessenden halaman 87)
2.) Isomer konstitusi
Isomer konstitusi adalah isomer rangka atau isomer posisi awal, missal:
a.) Isomer rangka
b.) Isomer posisi
3.) Isomer konformasi
Isomer konformasi adalah isomer yang disebabkan oleh rotasi pada atom karbon.
Misalnya bentuk eclipse dan stuggard.
35
(Lengkap baca Fessenden halaman 121)
4.) Isomer konfigurasi
Isomer konfigurasi adalah isomer salah satu bentuk isomer geometri. Contohnya
isomer cis, trans dan E,2.
(Lengkap baca Fessenden halaman 112)
In this set of five species, identify the nucleophiles and the electrophiles, then answer the
two following question.
4. How many are electrophiles? (A) 1 (B) 2 (C) 3 (D) 4 (E) All five
Jawab : 1.(A)
Elektrofil adalah suatu senyawa yang memiliki kecenderungan untuk menarik elektron.
Contoh elektrofil adalah kation. Jadi hanya ada satu elektrofil yaitu CH
3
CH
2
+
.
5. How many nucleophiles? (A) 1 (B) 2 (C) 3 (D) 4 (E) All five
Jawab : 2.(B)
Nukleofil biasanya berada dalam bentuk anion atau senyawa yang memiliki pasangan
elektron bebas [biasanya ada atom O].
Contoh nukleofil:
H
2
O ROH Cl
-
Br
-
OH- -OR
Jadi, yang bersifat nukleofil adalah CH
3
O
-
dan
36
For question 6, 7, and 8 select your question from the following a) selection may beused
more than once, if necessary: (A) configurational isomers (B) constitutional isomers (C)
conformational isomers (D) they are same molecule (just drawn differently)
6. What is the relationship between n-octane and 2,2,3,3-tetramethylbutane?
Jawab: Hubungan antara n-oktana dan 2.2.3.3 tetrametil butane
Jadi, hubungan keduanya adalah isomer rangka.(D)
7. What is the relationship between molecule (1) and molecule (2) shown in the box below?
Jawab: Molekul 1 dan 2 adalah sama yaitu anti-bromo propana.(E)
37
8. What is the relationship between molecule (2) and molecule (3) shown in the box below?
Hubungan isomer antara molekul 2 dan 3 adalah isomer konformasi.(C)
9. Which of the figure (1-5) in the box above represents a gauche form?
(A) 1 dan 2 (B) 3 (C) 4 dan 5 (D) 1,2,dan 3 (E) 3, 4, dan 5
Jawabannya adalah 3.(B)
Molekul 1) adalah tipe anti yaitu kondisi staggered yang paling stabil.
2) adalah molekul yang sama dengan molekul
3) adalah tipe gauche yaitu tipe staggered dengan 2 gugus fungsi yang tidak saling
berjauhan.
4) dan 5) bukan merupakan isomer konformasi karena gugus fungsi berada
pada atpm C yang sama.
38
10. Why is the anti-conformation more stabil (lower energy) than the syn- (eclipsed)
conformation?
(A) Eclipsed groups increase the energy of the conformation due to steric repulsion
between the groups on adjacent carbon atoms
(B) Eclipsed conformations have higher energy due to electron repulsion of adjacent
sigma bonds
(C) The anti- conformation is lower in energy due to the opposed bond dipoles present
in this conformation
(D) The anti- conformation is lower in energy because bond lengthns between
tetrahedral carbon atoms in this conformation are shorter
(E) Anti- conformation are not energetically favored over eclipsed conformations
Jawab: Eclipsed groups increase the energy of the conformation due to steric repulsion
between the groups on adjacent carbon atoms..(A)
Anti lebih stabil daripada eclipse karena pada posisi eclipse terdapat rintangan sterik
antara atom yang diikat oleh karbon sehingga menyebabkan peningkatan energi.
11. How many quartenary carbon atoms are present in the molecule above?
(A) none (B) 1 (C) 2 (D) 3 (E) 4
Jawab: 2(C)
dibuat dalam bentuk lain:
39
Jadi terdapat dua atom karbon kuartener:
- Karbon primer (1) yaitu karbon yang mengikat satu karbon lain
- Karbon sekunder (2) yaitu karbon yang mengikat dua karbon lain
- Karbon tersier (3) yaitu karbon yang mengikat tiga karbon lain
- Karbon kuarterner (4) yaitu karbon yang mengikat empat karbon lain
12. The orientation of the chloro- sunstituent is..
(A) axial (B) equatorial (C) eclipsed (D) gauche (E) anti
Jawab: Axial(A)
Lengkap baca Fessenden halaman 129
13. How many hydrogen atoms are in equatorial position?
(A) 3 (B) 5 (C) 7 (D) 10 (E) 15
Jawab: 7..(C)
Banyaknya hidrogen pada posisi ekuatorial, posisi axial atau ekuatorial hanya untuk siklo
heksana jadi gugus lain kita sebut sebagai
40
Jadi terdapat 7 buah atom H equatorial.
14. Using the three structures shown in the box below, which of these compounds would be
classified as 2 alkyl bromides?
(A) compound 1 (B) compound 2 (C) compound 3 (D) compound 1 and 2 (E)
compound 2 and 3
Jawab: Compound 2 and 3.(E)
Jadi, molekul 1 gugus Br berada pada
atom primer
41
Jadi, molekul 2 gugus Br
berada pada atom
sekunder
Jadi, molekul 2 gugus Br
berada pada karbon
sekunder
15. Which of the following generic class is likely to be the most nucleophilic?
(A) weak acid (B) ions carrying a positive charge (cations) (C) conjugate bases of weak
acids (D) strong acids (E) H
2
and halogen gases
Jawab: Conjugate bases of weak acids..(C)
Gugus yang bersifat paling nukleofil adalah CN yang merupakan basa konjugasi dari
asam lemah HCN.
16. The product of the reaction shown is:
42
The next seven question refer to the diagram below (a plot energy vs degree of bond
reaction about the C
2
-C
3
bond in butane). As appropriate, choose your answer from the
drawings at the top of the next page.
Jawab: (C)
43
17. Which drawing represents the conformation of the butane at the highest energy
transition state?
Jawab: (A)
Posisi paling tidak stabil (energi yang paling tinggi) adalah posisi eclipse dengan gugus
metal berimpit.
18. Which drawing represents the conformation of butane at (3) in the diagram?
Jawab: (E)
Untuk mengetahui posisi pada diagram maka harus diurutkan berdasarkan energi
tertinggi.
1.) Energi paling tinggi yaitu eclipse dengan metal berimpit
2.) Minimum lokal yaitu posisi gauche
3.) Maksimum lokal yaitu eclipse dengan metal tidak saling berhimpit
4.) Minimum global yaitu posisi anti
44
19. Which drawing represents the conformation of butane at the global minimum energy?
Jawab: (C)
Global minimum energi pada posisi anti.
20. Which drawing represents an anti conformation of butane?
Jawab: (C)
21. Which conformation represents a gauche conformation of butane?
Jawab: (B) dan (D)
22. Which number on the diagram indicates the energy (and the angle of rotation) of a global
minimum? (A) 1 (B) 2 (C) 3 (D) 4
Jawab: 4..(D)
23. Which number on the diagram indicates the energy (and the angle of rotation) of local
minimum? (A) 1 (B) 2 (C) 3 (D) 4
Jawab: 3.(C)
Lengkap baca Fessenden halaman 121-124
24. Which of the following physical properties will be different for the constitutional
isomers?
(A) Boiling point (B) Solubility in acetone (C) Melting point (D) Vapour pressure at STP
(E) All of these
Jawab: All of these..(E)
Isomer rangka menyebabkan beberapa perbedaan sifat fisika:
1.) Kenaikan titk didih, semakin panjang rantai utama maka, titik didih semakin tinggi.
Hal ini dikarenakan oleh semakin sulitnya ikatan antar molekul pada molekul yang
memiliki rantai lebih panjang.
45
2.) Kelarutan pada aseton,. Semakin panjang rantai utama maka semakin bersifat
nonpolar sehingga rantai yang lebih panjang semakin tidak laurt dalam pelarut
aseton.
3.) Titik leleh. Semakin panjang rantai menyebabkan semakin kuat ikatan antar molekul
sehingga titk leleh senyawa yang memiliki rantai utama yang lebih panjang memiliki
titik leleh yang lebih tinggi.
4.) Tekanan uap pada STP. Suatu zat dikatakan mendidih ketika tekanan uap sama
dengan tekanan udara (1 atm pada STP). Karena semakin panjang rantai
menyebabkan semakin tinggi titik didih maka berbanding terbalik dengan hal itu
berarti semakin panjang rantai utama maka tekanan uap semakin kecil.
25. Which of the following organic compound contain a nucleophilic site?
Jawab: None of the other selections contains a nucleophilic site.(E)
26. Which of the following is trans-1,3-diclorocyclohexane?
46
Jawab: (C)
27. In cis-1,3-dichlorocyclohexane yhe cholrine would be:
(A) eq,eq (B) ax,ax (C) one would be ax and one would be eq
Jawab: One would be ax and one would be eq..(C)
Posisi cis pada sikloheksana didasarkan pada posisi subsituen trans terjadi apabila salah
satu substituent mengarah ke bawah dan substituent lainnya ke arah atas.
47
Posisi trans pada sikloheksana terjadi apabila subsituen memiliki arah yang sama.
Lengkap baca Fessenden halaman 137-183.
28. Tuliskan mekanisme reaksi dari reaksi radikal bebas pada monoklorinasi etana. Tentukan
produk samping dari reaksi tersebut!
Jawab:
Ada tiga tahap mekanisme reaksi:
Tahap 1: Inisiasi
Tahap 2: Propagasi
Tahap 3: Terminasi
Jadi,
48
29. Tuliskan mekanisme reaksi dari reaksi adisi air dengan katalis asam dari 2-butena!
Jawab:
Ada tiga tahap mekanisme reaksi:
Tahap 1: Serangan H
+
Tahap 2: Serangan H
2
O
Tahap 3: Pelepasan H
49
UTS Kimia Organik 1
30. Alkena merupakan suatu senyawa hidrokarbon yang mengandung ikatan rangkap. Alkena
bisa diperoleh dari hasil sintesis ataupun hasil alam.
- Jelaskan 3 sumber alkena dari hasil alam yang Anda ketahui.
- Jelaskan sifat fisika dan kimia alkena.
Sumber alkena dari hasil alam:
Minyak atsiri, selanjutnya diolah menjadi limoene. Perbedaan kiralitas
menyebabkan limonene dapat dibedakan menjadi limoene (R) dan limoene (S),
masing-masing memiliki kegunaan berbeda dalam kehidupan sehari-hari. Jika
limoene (R) aman untuk dikonsumsi, maka Limonene (S) adalah racun. Contoh:
Limonene (R) untuk obat-obatan beraroma jeruk, Limonene (S) untuk pengharum
ruangan beraroma jeruk.
Dalam reaksi suhu kamar, limonene berwujud cair.
Dari organisme di alam, seperti daun kutu. Kutu daun menghasilkan feromon
(sebuah alkena) yang digunakan sebagai tanda bahaya.
Dari minyak bumi, tetapi presentasenya relatif kecil.
Sifat fisika alkena:
Sebetulnya hampir sama dengan alkana, dimana alkena dengan nomor atom C
terendah C
7
H
14
berwujud gas pada suhu kamar, C
8
H
16
-C
17
H
34
berwujud cair pada
suhu kamar dan C
18
H
36
-C dengan nomor atom di atasnya berwuud padat pada suhu
kamar.
Titik didih bertambah seiring dengan pertambahan jumlah nomor atom, hal ini
erat kaitannya dengan gaya Van der Walls.
Sifat kimia alkena:
50
Dapat mengalami reaksi adisi, dimana ikatan pi pada ikatan rangkap menarik
elektrofil dan karbokation berikatan dengan nukleofil sehingga alkena mengalami
perubahan menjadi alkana.
Dapat mengalami reaksi eliminasi
Dapat mengalami reaksi ozonisasi
Akena + Ozon Aldehid + Keton
31. Berikut ini persamaan reaksi eliminasi alkil halida untuk mendapatkan senyawa alkena.
Jelaskan perbedaan E
1
, E
2
, dan E
CB
.
Reaksi E
1
, E
2
, dan E
CB
sama-sama menghasilkan akena tetapi mekanismenya berbeda-
beda.
E
1
: Sebuah gugus yang disebut leaving group meninggalkan senyawa atom C yang
awalnya mengikat LG selanjutnya menjadi karbokation. Keadaan ini disebut keadaan
transisi. Selanjutanya salah satu atom H yang berikatan dengan C di sebelah
karbokation akan berikatan dengan senyawa lain berupa basa. Lalu, senyawa
tersebut lepas dari hidrokarbon sehingga terjadi ikatan rangkap pada hidrokarbon.
E
2
: Lepasnya LG bersamaan dengan lepasnya H
+
yang ada pada atom C di sebelah atom
C yang mengikat LG. Pada proses selanjutnya dua atom C yang telah ditinggali LG
dan H
+
membentuk ikatan rangakap sehingga membentuk alkena.
51
E
CB
: -H
+
terlebih dahulu lepas bersama basa yang mengikatnya. Fase ini disebut transisi.
Selanjutnya LG meninggalkan senyawa hidrokarbon dan dua atom C yang
ditinggalkan H
+
dan LG membentuk alkena.
32. Berikut ini adalah beberapa cara membuat alkena dengan mensintesisnya dari bahan
lain.
Jelaskan perbedaan reaksi 1 dan 2.
Reaksi 1 : mengadisi ikatan rangkap 3 menjadi 2, berlangsung pada suhu rendah (-72C),
katalis2 eq. Red-Al, reaksinya cukup lama (25 min).
Reaksi 2 : mengeliminasi 2 atom Br dari alkana hingga terbentuk alkena berlangsung pada
suhu tinggi (135C) katalis (pmlm) BF
4
, reaksinya cukup singkat (5 min).
33. Senyawa diena terkonjugasi dapat mengalami reaksi adisi 1,2 dan 1,4. Jelaskan
perbedaan antara 2 jenis reaksi adisi tersebut. Jelaskan juga tentang reaksi Diels-Alder.
Reaksi adisi adalah reaksi penambahan atom pada tom pusat yang memiliki ikatan
rangkap. Karbon berikatan rangkap terurai ikatannya menjadi ikatan tunggal karena
mengikat atom baru.
Reaksi adisi 1,2 adalah peristiwa tertariknya elektrofil ke ikatan pi pada salah satu
ikatan rangkap diena terkonjugasi. Pada reaksi ini hanya salah satu ikatan rangkap
diena terkonjugasi yang berubah menjadi tunggal.
Reaksi adisi 1,4 dalah terurainya dua ikatan rangkap pada senyawa diena terkonjugasi
akibat tertariknya elektron dan nukleofil ke ikatn pi yang berbeda.
Reaksi Diels-Alder adalah reaksi suatu diena dengan dienofil membentuk cincin
segienam.
52
34. Jelaskan pengertian masing-masing istilah di bawah ini.
*Silakan cari sendiri jawabannya di buku yaaah..
53
UJIAN MID SEMESTER KIMIA ORGANIK I
JURUSAN TEKNIK GAS PETROKIMIA-FTUI
2-April Semester Genap 2004/2005, Waktu: 60 menit, Dosen: Ir. Sukirno, M.Eng
Diberikan dua senyawa sebagai berikut:
Jawablah pertanyaan berikut:
1. Tulislah stuktur Lewis senyawa a) dan tunjukkan ada berapa pasang elektron menyendiri
(lone pair electron)
Jawab:
54
2. Tunjukkan jenis tumpang tindih orbital apa yang terdapat dalam semua ikatan pada
senyawa a) di atas.
Jawab:
3. Tuliskan namanya beserta penandaan E, Z senyawa a) di atas
Jawab:
(Z)-2-karboksil-2-butena
Kedua prioritas paling besar berada pada satu sisi (cis) maka penandaannya (Z).
55
4. Hitunglah muatan formal semua oksigen pada senyawa a) di atas.
Jawab:
Muatan formal (mf) = elektron valensi elektron bebas elektron berikatan
Oksigen : 1. mf = 6 4 2 = 0
2. mf = 6 6 1 = -1
5. Senyawa a) di atas dalam kondisi ruang (ambient) berupa gas, cair atau padat? Jawaban
harus disertai penjelasan dengan mempertimbangkan jumlah karbon, gugus fungsional,
ikatan non-kovalen
Jawab:
Gas karena pada umumnya senyawa alkena memiliki titik didih yang rendah. Rendahnya
titik didih ini disebabkan oleh adanya ikatan kovalen yang cukup banyak. Selain itu,
jumlah karbon yang tidak terlalu banyak juga menyebabkan rendahnya titik didih
senyawa a). Oleh karena itu, diduga pada kondisi ruang senyawa a) berupa gas.
56
6. Di antara senyawa a) dan b) manakah yang memiliki titik didih yang lebih tinggi? Berikan
alasan!
Jawab:
Senyawa b) karena pada senyawa b) terdapat ikatan hidrogen (O----H) yang relative sulit
diputuskan. Sedangkan pada senyawa a) tidak terdapat ikatan hidrogen, melainkan ikatan
kovalen yang relatifmudah diputuskan. Oleh karena itu, senyawa b) memiliki titik didih
yang lebih tinggi dibandingkan senyawa a).
7. Di antara senyawa a) dan b) manakah kelarutannya dalam air lebih tinggi? Berikan
alasannya!
Jawab:
Senyawa b) karena senyawa b) memiliki gugus hidroksil (-OH) yang sangat mudah
bereaksi dengan air dan memiliki ikatan hidrogen (O----H). Pada dasarnya, kedua senyawa
memiliki gugus karboksil (COO
-
) yang dapat bereaksi dengan air. Namun, kereaktifan
gugus karboksil tak sebesar gugus hidroksil sehingga senyawa b) lebih larut dalam air
(kelarutan lebih tinggi) dibandingkan senyawa a).
8. Suatu senyawa 1-bromo-1,2 difenil propana, berapa jumlah karbon kiral yang
dimilikinya. Kemudian gambarkan semua konfigurasi R, S senyawa tersebut dengan
menggunakan proyeksi Fischer.
Jawab:
Senyawa 1-bromo-1,2 difenil propane memiliki 2 karbon kiral. Konfigurasi R,S-nya:
57
9. Untuk senyawa pada soal 8, gambarkan pula proyeksi Newman konformasi anti dengan
karbon kiral sebagai pusatnya.
Jawab:
Proyeksi Newman konformasi anti dengan karbon kiral sebagai pusatnya.
58
10. Komponen utama penarik sek sejenis cacing adalah 11Z, 13Z-heksadekadienal.
Gambarkan stukturnya!
Jawab:
59
Midtest Kimia Organik 1
Semester Ganjil 2003/2004
Jurusan TGP FT-UI
Waktu: 90 menit Dosen: Ir. Sukirno, M.Eng
1. Susun tiap deret senyawa berikut menurut bertambahnya kepolaran, dan berikan
alasan dengan menggunakan gambar stuktur dan simbol kimia.
a) CH
3
CH
2
CH
2
NH
2
, CH3CH2CH3, CH
3
CH
2
CH
2
OH
b) CH
3
CH
2
CH
2
Br, CH
3
CH
2
CH
2
I, CH
3
CH
2
CH
2
Cl
Jawab:
a) CH
3
CH
2
CH
3
< CH
3
CH
2
CH
2
NH
2
< CH
3
CH
2
CH
2
OH
Karena keelektronegatifan dari atom-atom tersebut
hampir sama & membentuk ikatan kovalen, dalam
mana atom-atom tersebut menerapkan tarikan yang
hampir sama terhadap elektron ikatan sehingga
membentuk ikatan kovalen nonpolar.
Ikatan C-N adalah ikatan kovalen polar tetapi
perbedaan keelektronegatofan C-O lebih besar
daripada C-N sehingga C-O lebih polar.
Ikatan kovalen yang paling polar karena memiliki
perbedaan keelektronegatifan C-O yang terbesar.
60
b.) CH
3
CH
2
I < CH
3
CH
2
CH
2
Br < CH3CH2CH
2
Cl
urutan keelektronegatifan: I < Br < Cl
Karena Cl paling elektronegatif sehingga perbedaan keelektronegatifan C-Cl paling besar
sehingga C-Cl paling polar.
2. Susun tiap deret senyawa di atas menurut bertambahnya titik didih air, berikan alasan!
a.) CH
3
CH
2
CH
3
< CH
3
CH
2
CH
2
NH
2
< CH
3
CH
2
CH
2
OH
Jawab:
Senyawa CH
3
CH
2
CH
3
tidak memiliki ikatan hidrogen.
Senyawa CH
3
CH
2
CH
2
NH
2
memiliki ikatan hidrogen.
Atom H kurang positif sehingga ikatan hidrogen lebih lemah.
Senyawa CH
3
CH
2
CH
2
OH memiliki ikatan hidrogen yang lebih kuat.
Atom H lebih positif sehingga ikatan hidrogen lebih kuat.
Karena oksigen lebih elektronegatif daripada nitrogen, maka gugus O-H lebih
polar & mempunyai H yang lebih positif (lebih tertarik oleh pusat negatif).
61
b.) CH
3
CH
2
CH
2
I > CH
3
CH
2
CH
2
Br > CH
3
CH
2
CH
2
Cl
Kenaikan titik didih juga dipengaruhi oleh bertambahnya berat molekul.
3. Senyawa CH3CH2OCH2CH3 dan CH3CH2CH2OH dua-duanya larut dalam air, namun
keduanya memiliki perbedaan titik didih 83C. Keterangan apa yang dapat saudara
berikan untuk pengamatan ini.
Jawab:
propanol (memiliki ikatan hidrogen)
dietil eter (tidak memiliki H untuk membentuk ikatan
hidrogen)
Titik didih propanol lebih tinggi karena memiliki ikatan hidrogen sedangkan molekul
dietil eter tak dapat saling membentuk ikatan hidrogen antara molekul-molekulnya.
4. Susun senyawa ini menurut bertambahnya kelarutan dalam air dan berikan
alasannya CH3COOH, CH3CH3, CH3CH2OCH2CH3.
Jawab:
CH3CH3 < CH3CH2OCH2CH3 < CH3COOH
62
CH
3
CH
3
tidak memiliki ikatan hidrogen dengan air sehingga tidak dapat larut dalam
air.
(memiliki 1 jenis ikatan hidrogen sehingga dapat larut dalam air)
(me
m
i
l
iki lebih dari 1 jenis ikatan hidrogen sehingga lebih larut dalam air)
5. Tunjukkan semua jenis ikatann hidrogen dari CH3NHCH3 dalam air, mana yang
merupakan ikatan hidrogen terkuat.
* Ikatan hidrogen lebih kuat
* Ikatan hidrogen lebih lemah
63
Karena nitrogen kurang elektronegatif dari oksigen, elektron-elektronnya terikat
kurang kuat dan lebih mudah ditarik oleh atom lain. Kombinasu elektron dari nitrogen
yang terikat lemah dari hidrogen yang lebih positif dan gugus O-H menyebabkan
terjadinya ikatan hidrogen yang cukup kuat.
6. Mengapa senyawa A mendidih pada suhu yang lebih rendah daripada senyawa B
(gunakan interaksi intermolekul dan intramolekul dalam jawaban anda)
Senyawa A mengalami rintangan sterik karena jarak O-H dan NO
2
yang lebih dekat
daripada senyawa B sehingga senyawa A tidak dapat membentuk ikatan hidrogen.
7. Berikan label semua jenis orbital ikatan pada senyawa orbital A pada soal nomor 6.
8. Berapakah jumlah maksimum stereoisomer yang mungkin untuk asam 3-hidroksi-2-
metil-butanoat. Gambarkan dan beri nama kepada masing-masing.
Senyawa A
Senyawa B
64
cis-3-hidroksi-2-metil-butanoat trans-3-hidroksi-2-metil-butanoat
9. Komponen utama penarik seks ngengat artic betina diberi nama (3Z, 6Z, 9Z)
heneikosatriena. Gambarkan stuktur senyawa ini.
.' ORGANIC CHEMISTRY
MID TEST b
CTMMICAL ENGINEERING DEPARTMENT FT.UI
Time: 90 menit, Lecturer: Dr.Ir.Sukirno M.Eng
:::-: r::::::::::::::::::=:::::::-:-:::-::=:
::::=-:=::==:
- - -
1. Physical/chemical reactivity
(15 points)
a). Arrange the following series of alkenes in order of stability, from
the most stable
to the least stable compound
,
^,
(i)
,
('i;')
,
(,,)
,
(,"\
ts
i,'tti!'.rr
(.
"-i
i"i'i,''
,
(i)
o
rl
---A-,,
-'*-/'x--
tll
(ii)e (iiD)
lIBr
----------*
CH.
l'
{lHiCCHrCHr
-l
Br
d^'tt
i ir +
\l
rlJ{"j1,r" $"{1
b). For electrophilic reaction below, whether the hydroxyl in phenol activates or
deactivates benzene ring? Explain horv it work ?
/>-.
-OH
?' Y
(:$.t,itLJ,r.ll-t.(111.,{ }
I ll +
rr' '
*
n
\,
-,
.&,t('l . 0.c
.). f,*pfuin how the hydroxy in the fenol dir.ects the electrophilic substitution, by
drawing the reaction mechanism of the 3 possibilities (orto, para or meta),
including the formation of the electrophile, the intermediates, and the products.
b). For molecule (iv), identify the 6 atoms
lpse
lay on the plane and
give the name
with its E/Z designation.
Qt5 CH- C(= i
C
I
CHa
c). For benzene which is an aromatic compound, its reaction with bromide
would not
give di-bromo benzene. Explain why ? Use energy diagram.
2. Below is an electrophilic addition reaction.
CHr
t-
CH3C:HCH:C:H2
a). Give the stepwise mechanism for the reaction. Show the intermediates and use
arrows to indicate the electron flow. (15 points)
b). Draw energy diagram to show the number of reaction step, the position of reactant,
interrneCiates anC product, and whether the reaction is exothermic or endothermic
process (20 points)
3. For molecule (iv) in the problem 1a above
,
show the complete polymerization reaction
mechanism using ROOR as radical initiator catalyst.
(15 points)
4. Mechanism of electrophilic aromatic substitution.
(40 points)
a).
predict
the produci and draw the complete mechanism of the following reaction
:.,)
(iv)@
R R
\l
C=C
z\
r<
\/
/\
RKH
A
L"so,"
R
-.
,(1
C=C
1\
ltg
RR
\
/\
r"ratkjn
S
t"tbi I
-nr.W,
,o,
CH"
/
)-
CH
b
6
^*or
padu Sa.*v Lt,{^n3
od.o\uV
ot1o r". ftoyne,.r
1,2,7,
Ll,
S
,
Aar
6
t
cHv
T,',l6.k
ol-'?d
a(iber( nctrnot
JertSc'- e
g
Z
Vo'rexro, rtor,. 6 norvtac
Z
rn<-raitca.t
d,oa fiovw l-1"
Nar,^
tU fA C
=
3,1
- cl^r' efi/- \ -
Pe'Ye-''a
"
C-
Y^r"*-,
Sfr,,\r-t..,r Wnz<-r"q sango'*
sfo-bil
Bq^z<-u..^
ll"loV
n,enlaL.rvt-,'
nea.\,csr
d.oU.?i
t
Untu\r
mert)ayn'\Vo'n
dihor"v Wnzera
-
ffi
e;,t^u^d^)
C
*to*va.taLis
(oof*ny^
cesor,^a.zti).
t.tepi
Substrt..,94.
at;gr{rVa-n Rx ad-r*
Ja,r'
t Br
v*atts
h'g'
+ HB-
Crae-orrton)
I
'2
a.
cfrz
i
cfrz* cH-
C-,rlq+o"
)
trnter.ne"Li<)L+Bc-
CH,
r-
t
f-{8"
=
Cfri
--?
c,n'
c\12-?-c
-CHz
Br
CHz
t- )'
CHs-
CH
-Ctlz
-
cHz
tH'
c+z-cfr
-?-cdz
Mekanism
e
Cl-\a
t
CVa-
cd
-
CH.
=
CH>
+ H- B..
lr$errne&id 1-
lnte-r*
clc
Br-
--?
CH3-CH
-CHz -c*-l.f).
--l
arrI
I
Ct1"2-9
*cH
-c1g
t+
H
CflE- Cr1
-
CHz- CtiL +
ln
t-zx,"n ."1^& L +
9,c- :
CH,
t)
Cfrz- cH
-
Cq- cfit+
Br
+
lnke.
,,-eQ^e*
7
+ (\c'
:
Qnz
t
cHL-?
THz-cfrt+e"-
CL{^
r-
+ C-l\- Cl-t- CHB"
-
cH=
cl4l
--?
cQ
4
-c+z -c-(47.
I
B-
la\ermeolie*
L
t
[",t<r
aed;e-t 2
a [r,t?rmEiat'j
-l
on,
'Tlon.'
lonu
'/
- bnt
CVI-cir
-cu
=CHz+
rt}r
L
CHu.
l'
(nter,rvre
d;e*
"
LV,
da.^ r\Hz
@
(uv"dolec-\
J,a.^ Al-l=
e(.zsole-,^).
T
3
tI=
Cfl
r-
cH
-
cH
-
cH,= eltz
(
cHz
tnnx^r
noYDe
?O,
+ CHz-cH-
I
CHs
CYlz*
C,H
cH3
ROOR
i?
----a
27o'
.l{.
Ct13
I
eH
-ck>e-Hz
---o
6,1rcq-cH-
cJ-cHz-oR
cHa
\_/
cHa .1, Ct{. cl+z
I
t'
|
(
-
9
-
CVz- oaz
-o
nf cf-r,
-CtJ -
cU- CH
=cHz -+
kO*cH z-Glz'C'cHr-c*1-
cr1-cH-cH,
1
t*-/
^:
c?z
at9- Cfl
c,t-13
I
st13
ffz
I
C-H1-c-\-f
I
cH3
car- Ju
I
gH3
CHz
l-
CH.
lzo -car-cH,
-c
-cliz-c*l2-
c', + CUz
-Ctt
- CH
-
CEt,
=
CHz
_z
da_ 3gf erusny
a
L
U.n9.J3a
I
CHs eHz
CHt-
c4
int -ru{-e4z
t
cWz
V-r.f <r",A fne,urOy-Vd
de.ncatn
610.
Ao,rr\
m el^5 ho5't
Lca-n
kqO*
lernninalt
Z
\
a
"
0
.
cvtc+Lc+zc+zc,S.
+ ALLAa
j
CHg- CHz- CH2
-Ctl2 -
?er';*,aaq
+
Alc.0,a
-$n
cl
t
AL:A
\/
CHe-CHz
-CH - C;,
,iU
I
'b
Interrnedi?*
1-
l-
I
"*
r-
CHz- Cu - cH,
lrtz.^ eAi.ej 1,
u.
t
^ze-nq l^t r*.AieT,
T
+ CHg-c+{2- LH,
*
C-Hz
c+tcflz.ctl"c)13
-r)
/x I
U
-r
H@
+ A,Q-CQj
cfs
lt"tt"or)
z
\ nlnr^""l*e*
2
+
VenT<t
q
/xr
V.
c+s-cffz'cA-ct-tr
a
4b
V.crrol
aolalc'L^ a\ctt
"rc'"tec
t-ccr*'r't lp4vena
N'n*
e;."cvzc\zcH2&
+
Alrlj
V
+Wia
c-H7ct_12
Tilt
.dd?r+L
Airiv;tan:-
AAC&-,
mr*'^p a2"n' tovt"
CV\
z-LR
z
LIl z'cu
"-
r!-
I
\ r'tzrrn
L
CHE'cHz-C
I
?lnbrn.,hrJ
[
+
V--^4
O'n-
ctrbcfr"cHrci'-
''&?n
2p)t\zc'ze'3
-D
qy-
cilzc,Lc.:ff
+
Muz
o?\o
r
ff:.*te-*--dr.',u,
a
_ft'"i
Aa-ca;
-F'
Q19- C,V
cHt
I
cfi5
l'4
iv"rOr
.
1
*
&r_*
*c.Lta-
+ Ht!+r*LCr,
CH5
Mo
--D
h/o*
--+
p
+vtc!-+MClt
Q+z-CVl
'
|
?a'trc\
c\-{z
I
c?1.t
f-{c"7ec
5
cHgal|c?hcH7
?a.rr,,
2
\^Y.o*m.A;*
Z
+
fe','el
0'i
c'3-ct1z':r-
cH, +
o{>qlLCArCdT
4".
0'.
aU
rnc.".cn
A
o\d'o'("ff
b
ad^V^
\ nta.
m,)ie)'
,?roL*^,l^
4A
g
OH
i
{
i
g"
7H-
ot,
CH,
b,-1,
&?u
cwcttz
(v^vo'.
Qr'v
Cf -*r-rolt
cVj
C
^d^L'^l^
Dt+
(t_t^r;,
C+tl.*^J^)
S,et i^
it ,,
3t'{'
s W)'rows
M?n-tyta-Vo'v1
c"Ltivatbr
cP.t*Ctl
(+L
.h,
tebrh slabiL
tz_re-
i-arbolationnya
aAa
.lli
YDgl* Y^ry
te4'ih sh:"f i 1
ctctri
f^^
y^r5
o'Ao'
'Li
i'ngf^
'.
r ,,1 -
-,
.-
{o
?'t
t
cHsCHzCH
CH7
pc-nmjoV-
octo dan fara
'
UTS KIMIA ORGANIK
f(Lrti',
\
ir.,'.t: t:
25 MARET 2013, SBNIN, PK 10.00 -12.00 (120 menit), 5205, Closed Book
Berikrn
penarnaan untuk senyawa berikut ini:
[Nilai
12]
CH^
Y''
CH;CH;CH_CH -CH;CH -CH; CH.
-r'l
'/
CH, CH.
cH,
I
CH;CH;C-CH;CH.
"'l
CH; CH; CH; CH,-
Q-CH;CH;
CH, CH.
I
CH;CH;CH.
a, Apa yang anda ketahui tentang isomer dan stereoisomer,
jelaskan
dan berikan contohnya?
[Nilai
10]
Apakah kedr-ra senyawa di bar,val-r ini merupakan isomer? Jika kedua senyawa ini merupakan isomer, termasuk
nis isomer apa serta berikan nama untuk masing-masing senyawa di bawah ini.
lNilai
l2]
. a. Tuliskan secara singkat sifat-sifat fisika dan kimia senyawa alkana serta kegunaan senyawa alkana tersebut?
eftatuliskan
salah satu reaksi pembentukan alkana?
[Nilai
12]
'
Klasifikasi grlgus fungsi ada 3, yaitu hidrokarbon (i), senyawa yang mengandung oksigen (ii) dan senyawa yang
tengandung
nitrogen (iii). Tuliskan pengelompokan untuk masing-masing senyawa tersebut berdasarkan gugus
ungsinya?
[Nitai
t0l
. a. Kualitas gasolin ditentukan oleh bilangan oktan. Apa yang anda ketahui tentang bilangan oktan? Tuliskan
truktur
dan nama kedua serlyawa yang dipakai dalam penentuan bilangarr tersebut?
[Nilai
10]
'.
Sebutkan
tiga
jenis
reaksi cracking dan
jelaskan
secara singkat?
[Nilai
10]
;'
Kubis
ungu merupakan tanaman penghasil r.l,arna yang dapat digunhkan sebagai indikator untuk titrasi asam
)asa.
l'
Menurut
anda, warna dar-r
jenis
senyawa apa yang dihasilkan dari kubis ungu tersebut? Gambarkan strLrktr-rr inti
Malna
yang
dihasilkan sefta senyawa ini termasuk pewarna alami atau buatan?
[Nilai
12]
;'
Adanya
faktor pH, suhu, udara dan cahaya dapat menyebabkan perubahan struktur warna tersebut. Menurut
tnda,
apa
yang
menyebabkan senyawa warna dari kubis ungu ini dapat digunakan sebagai indikator untuk titrasi
tsam-basa?
[Nilai
12]
CH,
CH.
l"
CH.-C-CH"
"l
_cH, _cH, _c1rl
-cH,
-cH3
CH"
-CH
"CH"
..C.
.CH"
"lt
-cH,
CH.
nti
z r
v I t?
i
:
:
i
t
i
I
I
f
E.
&...
Anda mungkin juga menyukai
- Biokimia Struktur Dan Fungsi BiomolekulDokumen346 halamanBiokimia Struktur Dan Fungsi BiomolekulDian Agus Setyawati100% (11)
- Biokima Harper Edisi 29 PDFDokumen116 halamanBiokima Harper Edisi 29 PDFDhea Aditiyani Putri67% (6)
- Buku Kimia Organik FullDokumen293 halamanBuku Kimia Organik FullSiti Zalikha Safani PutriBelum ada peringkat
- Kimia Organik Dasar untuk FarmasiDokumen226 halamanKimia Organik Dasar untuk FarmasiFeri FirmansyahBelum ada peringkat
- Kimia AnorganikDokumen202 halamanKimia AnorganikOpen Knowledge and Education Book Programs100% (187)
- Kimia OrganikDokumen258 halamanKimia Organikkamil_vid100% (8)
- Soal Dan Jawaban StereokimiaDokumen14 halamanSoal Dan Jawaban StereokimiaNursya AlmaIndah67% (3)
- Buku AnalisaDokumen87 halamanBuku AnalisaFiisyatir RodiyahBelum ada peringkat
- Kimia Organik FisikDokumen0 halamanKimia Organik FisikLinda Misnawati67% (3)
- Alauhdin PDFDokumen200 halamanAlauhdin PDFwahyu rahmansyah100% (1)
- Reaksi Substitusi NukleofilikDokumen58 halamanReaksi Substitusi NukleofilikRizky Arihta25% (4)
- Kimia OrganikDokumen3 halamanKimia OrganikUlfa Mustofa67% (3)
- Kimia OrganikDokumen30 halamanKimia OrganikMuhammad AzharBelum ada peringkat
- KIMIA ORGANIK X-1 EditDokumen280 halamanKIMIA ORGANIK X-1 Editilham0% (1)
- SN & E Kimia Organik IDokumen222 halamanSN & E Kimia Organik IPras AlfaBelum ada peringkat
- STEREOKIMIADokumen28 halamanSTEREOKIMIAJennifer MitchellBelum ada peringkat
- AlkenaDokumen42 halamanAlkenaGrace100% (1)
- Ester dan AmidaDokumen95 halamanEster dan AmidaShinta Novita SariBelum ada peringkat
- Hibridisasi Kimia dan Bentuk MolekulDokumen6 halamanHibridisasi Kimia dan Bentuk MolekulHeruYan100% (1)
- Mata Kuliah Kimia OrganikDokumen20 halamanMata Kuliah Kimia OrganikDermawan JrBelum ada peringkat
- Bahan Kuliah OrganologamDokumen34 halamanBahan Kuliah OrganologamsriBelum ada peringkat
- KA19 19030234044 Muklash Imaduddin Tugas 3Dokumen7 halamanKA19 19030234044 Muklash Imaduddin Tugas 3Mukhlash ImaduddinBelum ada peringkat
- Reaksi Bersaing SN1 Dan E1Dokumen3 halamanReaksi Bersaing SN1 Dan E1Regina TheresyaBelum ada peringkat
- Molekul Kiral Dan AkiralDokumen4 halamanMolekul Kiral Dan AkiralIkbal Priambodo100% (1)
- Soal Uas Kimia Organik IIDokumen2 halamanSoal Uas Kimia Organik IILaila SapitrihBelum ada peringkat
- OPTIMASI FISCHERDokumen7 halamanOPTIMASI FISCHERfaniiBelum ada peringkat
- LIGAN DAN TATA NAMADokumen24 halamanLIGAN DAN TATA NAMAEko NevriansyahBelum ada peringkat
- Uts Semester Ii - Kimia Organik PDFDokumen42 halamanUts Semester Ii - Kimia Organik PDFHusein ShahabBelum ada peringkat
- Diktat BioprosesDokumen84 halamanDiktat BioprosesDeviBelum ada peringkat
- Tutorial 1 Kimia - Satria Mandala Putra - J011221097Dokumen12 halamanTutorial 1 Kimia - Satria Mandala Putra - J011221097Satria MandalaBelum ada peringkat
- TEORI VSEPR DAN GEOMETRI MOLEKULDokumen4 halamanTEORI VSEPR DAN GEOMETRI MOLEKULNella Nabilah RendiBelum ada peringkat
- Zat P memiliki sifat-sifat sebagai berikut:- Daya hantar listrik tinggi- Larutan menghantarkan listrik- Cairan menghantarkan listrikTidakantarkanDokumen12 halamanZat P memiliki sifat-sifat sebagai berikut:- Daya hantar listrik tinggi- Larutan menghantarkan listrik- Cairan menghantarkan listrikTidakantarkanSilvia WulandariBelum ada peringkat
- OPTIMAL UNTUK DOKUMENDokumen19 halamanOPTIMAL UNTUK DOKUMENFithunder BpBelum ada peringkat
- AR10KIM0499Dokumen6 halamanAR10KIM0499frsiscamkak1Belum ada peringkat
- 20 Soal Ikatan KimiaDokumen4 halaman20 Soal Ikatan Kimiaumi lathifahBelum ada peringkat
- Kumpulan Soal Dan Pembahasan Materi Kimia Kelas XDokumen9 halamanKumpulan Soal Dan Pembahasan Materi Kimia Kelas XA̳̿f̳̿r̳̿i̳̿z̳̿a̳̿l̳̿R̳̿i̳̿z̳̿q̳̿i̳̿100% (1)
- Jawaban Idf, FIXDokumen18 halamanJawaban Idf, FIXNurulAnnisaBelum ada peringkat
- SMA Negeri 1 Muntilan Ulangan Bab 1 Struktur Atom dan Sistem PeriodikDokumen3 halamanSMA Negeri 1 Muntilan Ulangan Bab 1 Struktur Atom dan Sistem PeriodiklolBelum ada peringkat
- UNSUR_PERIODIKDokumen7 halamanUNSUR_PERIODIKIndah KurniasihBelum ada peringkat
- Soal Siap UN Fisika Teori AtomDokumen4 halamanSoal Siap UN Fisika Teori AtomMuhammad Endriski Agraenzopati HBelum ada peringkat
- ATOM DAN IKATANDokumen11 halamanATOM DAN IKATANLunamaya MayaBelum ada peringkat
- PRETES INTI ATOM - Print - QuizizzDokumen13 halamanPRETES INTI ATOM - Print - QuizizzPufa DjuartonoBelum ada peringkat
- 1SMA-SEM2-SOAL PTS KIMIA 2023-Kur Merdeka-Atruktur Atom-Spu-Persamaan Reaksi-Tata NamaDokumen13 halaman1SMA-SEM2-SOAL PTS KIMIA 2023-Kur Merdeka-Atruktur Atom-Spu-Persamaan Reaksi-Tata NamaSelloartizoprawiryaBelum ada peringkat
- FISIKA ATOM Dan INTI RADIOAKTIVITASDokumen7 halamanFISIKA ATOM Dan INTI RADIOAKTIVITASPF05Belum ada peringkat
- Soal DJJLDokumen8 halamanSoal DJJLMuhammad NursaidBelum ada peringkat
- Soal Olimpiade Berhubungan Ikatan KimiaDokumen3 halamanSoal Olimpiade Berhubungan Ikatan KimiaUmikyu Loverz0% (2)
- Soal PAS Kelas X KimiaDokumen7 halamanSoal PAS Kelas X Kimianurul haolBelum ada peringkat
- Kimia PG Saspas Des 2023Dokumen13 halamanKimia PG Saspas Des 2023jafarujinBelum ada peringkat
- SOAL Dan Pembahasan Fisika Atom Dan IntiDokumen11 halamanSOAL Dan Pembahasan Fisika Atom Dan Intisamsul bahri100% (2)
- IKATAN KIMIADokumen12 halamanIKATAN KIMIAJoshua MeloBelum ada peringkat
- Kimia X Pas Ganjil 2022Dokumen12 halamanKimia X Pas Ganjil 2022SriWahyuniBelum ada peringkat
- Evaluasi 8,23nabihahDokumen5 halamanEvaluasi 8,23nabihahAlya NabihahBelum ada peringkat
- Soal Kimia 30Dokumen10 halamanSoal Kimia 30ZulBelum ada peringkat
- Latihan Soal KimiaDokumen15 halamanLatihan Soal KimiaRisma SiahaanBelum ada peringkat
- Soal dan Pembahasan UN Kimia SMA Tahun 2017Dokumen31 halamanSoal dan Pembahasan UN Kimia SMA Tahun 2017Gavin Toy ArtBelum ada peringkat
- Butir Soal Usp Kimia Sma Kab - Bombana 2023Dokumen13 halamanButir Soal Usp Kimia Sma Kab - Bombana 2023ErvinaBelum ada peringkat
- Jurnal Praktikum 5 FixDokumen8 halamanJurnal Praktikum 5 FixAkun PESBelum ada peringkat
- Konsep Ikatan KimiaDokumen48 halamanKonsep Ikatan KimiaAmank RofiBelum ada peringkat
- Tugas 2 Ikatan KimiaDokumen17 halamanTugas 2 Ikatan KimiaNurwahyuniBelum ada peringkat
- Fisika TugasDokumen18 halamanFisika TugasArif BBelum ada peringkat
- Muchtazam Mulsiansyah - 1206221683 - Sintesis ProteinDokumen8 halamanMuchtazam Mulsiansyah - 1206221683 - Sintesis Proteinmifta_huda200495Belum ada peringkat
- Struktur ProteinDokumen12 halamanStruktur ProteinParamitha DonaBelum ada peringkat
- Aplikasi Asam NukleatDokumen14 halamanAplikasi Asam Nukleatmifta_huda200495Belum ada peringkat
- APLIKASI ASAM NUKLEAT DALAM KEHIDUPAN-PPT LukmanDokumen23 halamanAPLIKASI ASAM NUKLEAT DALAM KEHIDUPAN-PPT Lukmanmifta_huda200495Belum ada peringkat
- Makalah Biologi Molekuler PROTEINDokumen67 halamanMakalah Biologi Molekuler PROTEINmifta_huda200495Belum ada peringkat
- Fungsi Protein Harly Ilyasaakbar 1206263313Dokumen18 halamanFungsi Protein Harly Ilyasaakbar 1206263313mifta_huda200495Belum ada peringkat
- LTM Biologi Molekuler - Aplikasi Protein Dalam Bidang Kehidupan - Hasanuddin - 1206230725Dokumen19 halamanLTM Biologi Molekuler - Aplikasi Protein Dalam Bidang Kehidupan - Hasanuddin - 1206230725mifta_huda200495Belum ada peringkat
- LTM Analisis Protein ReyhanDokumen9 halamanLTM Analisis Protein ReyhanReyhan JonathanBelum ada peringkat
- Jawaban KuisDokumen4 halamanJawaban Kuismifta_huda200495Belum ada peringkat
- MakalahDokumen4 halamanMakalahmifta_huda200495Belum ada peringkat
- Slide Presentasi Humas UIDokumen22 halamanSlide Presentasi Humas UImifta_huda200495Belum ada peringkat
- Booklet EksplorasiDokumen17 halamanBooklet Eksplorasimifta_huda200495Belum ada peringkat
- Laporan Tugas MandiriDokumen2 halamanLaporan Tugas Mandirimifta_huda200495Belum ada peringkat
- Perpindahan Momentum Antar FasaDokumen23 halamanPerpindahan Momentum Antar Fasamifta_huda200495Belum ada peringkat
- Pembahasan Soal UN Matematika SMP 2013 Paket 1 PDFDokumen9 halamanPembahasan Soal UN Matematika SMP 2013 Paket 1 PDFAditya Marwenda100% (2)
- Panduan PKM Dikti 2013Dokumen61 halamanPanduan PKM Dikti 2013Muhammad RozikhinBelum ada peringkat