Tutor Hema
Diunggah oleh
Elvan Dwi WidyadiHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Tutor Hema
Diunggah oleh
Elvan Dwi WidyadiHak Cipta:
Format Tersedia
TUTOR HEMATOLOGI
PEMERIKSAAN FIBRINOGEN dengan SYSMEX Ca 600
Disusun Oleh :
Elvan Dwi Widyadi, dr.
Pembimbing :
Juli Soemarsono, dr, SpPK
PPDS I SMF PATOLOGI KLINIK FAKULTAS KEDOKTERAN UNIVERSITAS AIRLANGGA RSU DR SOETOMO SURABAYA 2014
DAFTAR ISI
BAB 1 PENDAHULUAN ....................................................................................... A. Sejarah ....................................................................................................... B. Morfologi ................................................................................................... C. Metabolisme fibrinogen ............................................................................. 3 3 4
BAB 2 PEMERIKSAAN FIBRINOGEN A. Metode pemeriksaan Fibrinogen ............................................................... B. Metode Clauss ............................................................................................ C. PT derrived (PT-Fg) tes .............................................................................. D. Clottable Protein ....................................................................................... E. Immunoassay .............................................................................................. F. Titer Fibrinogen .......................................................................................... G. Gravimetric assay....................................................................................... H. Teknik Presipitasi Sulfida .......................................................................... 5 6 6 7 7 7 8 8
BAB 3 PEMERIKSAAN FIBRINOGEN SYSMEX Ca 600 .................................. A. Preanalitik .................................................................................................. B. Analitik ..................................................................................................... C. Postanalitik................................................................................................. D. Quality Control .......................................................................................... 9 10 16 18
DAFTAR PUSTAKA
BAB I PENDAHULUAN
A. Sejarah Fibrinogen sebagai partikel larut air yang besar, memiliki peran yang sangat penting dalam proses hemostasis (1,3). Teori tentang koagulasi darah pertama kali diperkenalkan oleh seorang fisiologis bernama Johannes Muller (1801-1858) yang menjelaskan tentang fibrin sebagai subtansi pembentuk thrombus. Fibrin ini terbentuk oleh sebuah zat pendahulu yang mudah dipecah yakni fibrinogen yang pertama kali diperkenalkan oleh Rudolf Virchow (1821-1902), dan dapat dikumpulkan secara kimiawi oleh Prosper Sylvian Dennis (1733-1863). Kemudian Alexander Schmidt mengusulkan teori bahwa perubahan dari fibrinogen menjadi fibrin melalui suatu proses enzimatik, yang kemudian dilabel sebagai thrombin, dengan prothrombin sebagai ko-faktornya (1). Pada tahun 1958 International Commitee for Standarization of the
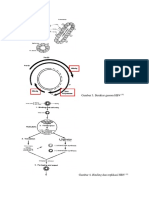
Nomenclatur of the Blood Clothing Factor memberikan penamaan terhadap faktor koagulan dengan angka romawi berdasarkan urutan yang pertama kali ditemukan dan didiskripsikan. Maka fibrinogen disebut dengan faktor I sebagai faktor koagulan yang pertama kali ditemukan(2). B. Morfologi Fibrinogen adalah glikoprotein dengan berat molekul 340.000 Da disintesa oleh hati dan bersikulasi dalam plasma dengan kadar ~200-400 mg/dL. Dia juga merupakan sebuah glikoprotein dimer dengan tiga pasang rantai peptide, dengan subunit yang membentuk rantai D domain yang mengandung daerah globular dan E domain mengandung ikatan disulfide yang berperan untuk menghubungkan kedua subunit diatas. Fibrinogen dalam tubuh manusia memiliki waktu paruh adalah 3 sampai 5 hari.
Gambar 1. Electron microscope menunjukkan 2 domain D, dan 1 domain E, dari Weisel (3).
Gambar 2. Gambar skematik susunan morfologi fibrinogen, dikutip dari Hantgan (3). 3
Perubahan fibrinogen yang soluebel menjadi suatu jaring-jaring fibrin yang insolubel merupakan hasil dari thrombin yang memediasi pelepasan fibrinopeptida A dan B dari N terminal rantai A dan rantai B. Thrombin adalah suatu proteasae serin yang diproduksi oleh liver dengan keadaan inaktif sebagai zymogen prothrombin dengan BM 70kDa. Waktu paruh dari thrombin hanya 14 detik. Dengan terlepasnya fibrinopeptin A diikuti dengan proses polimerisasi spontan (90).
Gambar 3. Proses perubahan fibrinogen menjadi fibrin yyang di mediasi oleh thrombin (3). C. Metabolisme Fibrinogen Fibrinogen dalam plasma diproduksi oleh liver, dengan waktu paruh dalam plasma 3 sampai 5 hari, sintesis fibrinogen yang paling rendah adalah 1,7 sampai 5 g/hari. Fibrinogen termasuk protein yang memiliki sifat akut fase dengan peningkatan kadar fibrinogen terjadi pada keadaan inflamasi, proses operasi besar, dan juga pada penderita kanker. Konsentrasi fibrinogen dalam plasma sangat bervariasi dipengaruhi oleh banyak hal misalnya kadar fibrinogen plasma pada wanita lebih tinggi dari pada pria, peningkatan konsentrasi fibrinogen plasma juga dapat ditemukan pada keadaan obesitas, postmenopause pada wanita, perokok, penderita diabetes militus, hipertensi dan hypercholesterolemia. Konsentrasi fibrinogen dalam keadaan tertentu dapat menurun diantara karena aktivitas tubuh yang berlebih, penurunan berat badan, konsumsi alkohol moderat, berhenti dari merokok. Obat golongan fibrat dan penghambat agregasi trombosit akan menurunkan konsentrasi fibrinogen plasma.variasi genetik darifibrinogen diturunkan sebesar 50%. Telah dilaporkan pengaruh pemberian terapi hormonal yang bervariasi terhadap kadar fibrinogen dalam darah. Dengan semakin berkembangnya penelitian terhadap penyakit-penyakit degenerative maka semakin banyak bukti yang menyatakan bahwa fibrinogen mempunyai peran sangat penting dalam menentukan tingkat keparahan serta prognosa terhadap penyakit yang berhubungan dengan atherosklerosis misal penyakit jantung dan stroke. 4
BAB II PEMERIKSAAN FIBRINOGEN
A. Metode Pemeriksaan Fibrinogen Beberapa teknik telah digunakan untuk menentukan konsentrasi fibrinogen dalam plasma. Metode yang dijelaskan oleh Jacobsson pada tahun 1955 mencerminkan total clottability fibrinogen. Assay berdasarkan tingkat pembekuan sampel plasma yang diencerkan digambarkan oleh Clauss di 1957, metode clauss ini mencerminkan konsentrasi fibrinogen dan sifat polimerisasi monomer fibrin. Metode lain, seperti garam atau pengendapan panas. Tes immunochemical didasarkan pada antibodi poliklonal bereaksi dengan epitop pada molekul fibrinogen. Metode imunologi lain yang termasuk pemeriksaan fibrinogen kuantitaif menggunakan teknik ELISA. Selain metode yang digunakan yang beragam, standar kalibrasi terhadap konsentrasi fibrinogen masih heterogen, menjadikan perbandingan tingkat fibrinogen yang diperoleh dari beberapa laboratorium berbeda. Dalam rangka penyeragaman tersebut Internasional First Fibrinogen Standard ( IS ) diperkenalkan oleh Institut Nasional untuk Standar Biologi di tahun 1992, dan diganti pada tahun 2000 oleh 2 IS untuk fibrinogen. A. Metode Clauss Konsentrasi tinggi dari trombin (mulai dari 35 sampai 200 U / ml, tetapi biasanya sekitar 100 U / ml) ditambahkan dalam plasma yang telah diencerkan dan waktu pembekuan diukur (Clauss, 1957). Hasil pengujian dibandingkan dengan kurva kalibrasi yang telah disiapkan dari serangkaian hasil pemeriksaan waktu pembekuan dari sampel fibrinogen yang telah diketahui konsentrasinya, dan konsentrasi fibrinogen yang diperoleh dalam g/l. Foto sistem optik tergantung pada perubahan densitas optik yang dihasilkan dari pembentukan fibrin, yang akan mengurangi transmisi cahaya dan meningkatkan cahaya yang tersebar. Metode ini cocok untuk mendeteksi fibrin dengan formasi yang lemah, namun hasil dapat memberikan nilai-nilai yang salah ketika fibrin monomer berpolimerisasi lambat. B. PT derrived (PT-Fg) tes Estimasi konsentrasi fibrinogen berdasarkan waktu protrombin (PT-Fg) telah banyak digunakan dalam beberapa tahun terakhir (Vermylenet al, 1963; Natelson & Dooley, 1974; Becker et al, 1984; CAMBAS et al, 1985; Chantarangkul et al, 1987; de Metz & van Wersch, 1987; Hoffmann & Verhappen, 1988; Rossi et al, 1988). Analyzer ini dikalibrasi dengan menetapkan waktu protrombin pada plasma (atau serangkaian pengenceran plasma ) yang diketahui konsentrasi fibrinogen dan dengan memplot grafik perubahan optik terhadap 5
konsentrasi fibrinogen. Perubahan optik dalam setiap sampel uji kemudian dikonversi menjadi nilai fibrinogen. Seperti teknik pengukuran tidak langsung fibrinogen, pemilihan kalibrator atau standar sangat penting. Daya tarik dari metode PT - Fg adalah bahwa hal itu cepat memberikan nilai fibrinogen tanpa biaya tambahan ( lainnya dibandingkan dengan reagen PT ), dan saat ini digunakan dalam sekitar 50 % dari Inggris Hematologi laboratorium [ UK Nasional External Quality Assessment Scheme ( NEQAS ) untuk Koagulasi Darah, 2000], meskipun ada kontroversi mengenai kesesuaian untuk penggunaan klinis. C. Protein Clottable Tes untuk pemeriksaan konsentrasi fibrinogen ini didasarkan pada konsentrasi protein bekuan darah. Tes ini dilakukan dengan menambahkan thrombin kedalam plasma yang miskin ion kalsium, kemudian bekuan yang terbentuk dicuci dan dilarutkan dalam urea alkali atau reagen lainnya, diikuti dengan uji protein spektrofotometri ( Ratnoff & Menzie, 1951; Jacobsson, 1955; Blomback & Blomback, 1956; Swain & feders, 1967; Gaffney & Wong, 1992). Karena sebagian besar protein dalam bekuan akan menjadi fibrin, maka konsentrasi protein akan setara dengan konsentrasi fibrinogen. Tes protein bekuan ini memakan waktu, dan teknis sulit, sehingga tidak cocok untuk penggunaan rutin dalam skrining koagulopati. Namun, dapat digunakan sesekali dalam penyelidikan kelainan fibrinogen kongenital. D. Immunoassay Berbagai tes imunologi yang tersedia: enzymelinked tes immunosorbent ( ELISA ), imunodifusi radial dan teknik elektroforesis, membutuhkan banyak waktu untuk
melakukannya. Beberapa alat analisa klinis (misalnya BN - 100, Dade Behring, Marburg , Jerman ) memiliki fasilitas untuk pengujian fibrinogen menggunakan immunonephelometry. Semua tes imunologi yang tersedia memiliki kelemahan dalam mengukur konsentrasi protein daripada aktivitas fungsional. Perkiraan yang meleset dapat dijumpai dalam beberapa metode di mana terdapat bentukan fibrinogen terdegradasi yang juga terhitung, hal ini disebabkan karena pada pemeriksaan dengan metode ini memiliki beda antigensitas dan dapat bermigrasi pada tingkat yang berbeda dalam imunodifusi dan teknik elektroforesis. E. Titer Fibrinogen Merupakan jenis pemeriksaan darurat dimana plasma darah diencerkan terlebih dahulu dengan buffer sebelum ditambahkan thrombin (Mackie & Machin, 1989). Titer yang dilaporkan adalah pengenceran terakhir dari plasma yang menampilkan penggumpalan setelah waktu inkubasi tertentu. Tes ini dilakukan dengan tanpa mempertimbangkan adanya berbagai inhibitor, seperti epsilon-amino-Asam N-kaproat (EACA), untuk memblokir plasmin, dan protamine untuk memblokir heparin dan FDP itu. Namun, hasilnya yang tidak teliti, dan tes ini 6
memakan waktu pemeriksaan yang lama serta susah diautomatisasi. Karena telah tersebar luasnya alat perhitungan otomatis maka tes ini hampir menghilang dari laboratorium klinis dan tidak dianjurkan. F. Gravimetrik assay Pada pemeriksaan fibrinogen dengan gravimetrik assay (Mackie & Machin, 1989), bekuan darah fibrinogen berasal dari plasma yang diencerkan dan penambahan larutan thrombin yang kuat serta calsium chloride. Bekuan ini kemudian dikompresi sampai mengekspresikan suatu cairan dan protein-protein diluar bekuan selanjutnya dicuci dengan larutan pz. Dan dikeringkan kemudian ditimbang dengan timbangan akurat mikrobalance (angka desimal yang terdapat pada timbangan mikrobalans menunjukkan akurasi dari timbangan tersebut). Teknik pemeriksaan ini sangat tergantung kepada kemampuan teknik yang tinggi untuk menghasilkan hasil yang dapat direproduksi dan pemeriksaan ini juga memakan waktu yang lama sebagaimana dia masih menunggu bekuan tersebut harus benarbenar kering untuk kemudian ditimbang, pemeriksaan ini tidak dapat digunakan untuk keadaan darurat, dengan metode ini tidak mampu menangani pemeriksaan dalam jumlah yang besar tidak dapat diautomatisasi dan tidak direkomendasikan sebagai pemeriksaan rutin. G. Teknik Presipitasi disulfida Teknik sulfit presipitasi (Rampling & Gaffney, 1976) telah dijelaskan, tetapi tidak dapat diandalkan dalam beberapa situasi klinis (terutama pada pasien dengan reaksi fase akut), dan biasanya tidak digunakan di rumah sakit laboratorium hematologi.(4)
BAB III FIBRINOGEN ASSAY dengan SYSMEX Ca 600
Beberapa hal yang harus diperhatikan dalam pemeriksaan konsentrasi fibrinogen mulai dari tahap: a. pre analitik: 1. Spesimen / sampel: berupa darah vena 2. Tabung Penampung (kotainer) dan Antikoagulan: dalam tabung dengan anti koagulan sitrat 32 g/L (0, 109 M) dengan perbandingan 9 bagian dari darah sampel ditambahkan sitrat 1 bagian ( 0,55 ml sitrat ditambah 5 ml sampeldarah)(5). 3. Sentrifuse: sampel di pusingkan dengan kecepatan 3000 rpm dalam waktu10 menit untuk mendapatkan platelet poor plasma sampel 4. Sumber kesalahan Preanalitik a. Salah dalam memilih tabung antikoagulan, atau anti koagulan yang kurang, Anticoagulant yang digunakan adalah Tri-sodium citrate (0,1050,109 mol l), dengan perbandingan 9 bagian sampel darah dan 1 sitrat. b. Jumlah sampel yang berlebih atau kurang dari yang dibutuhkan. c. Kesalahan dalam penambahan sitrat pada pasien dengan nilai hematokrit pvc sangat tinggi >60% d. Sampel beku, hemolisis, ikterik dan lipemik. e. Sampel yang inadekuat atau terlalu reaktif, cara pengambilan sampel yang bersih, cepat dan meminimalisasi kondisi stasis dari aliran darah. f. Sampel yang terkontaminasi atau kesalahan penyimpanan, pada spenyimpanan plasma suhu 40C untuk 48 jam (kecuali pada pasien DIC) -700C selama kurang lebih 18 bulan plasma dalam keadaan beku. g. Pencairan plasma beku dengan suhu 370C selama kurang lebih 5 menit dalam water bath sampai mencair dengan sempurna. h. Pengenceran yang tepat pada plasma sampel dengan kadar fibrinogen yang tinggi atau rendah, sehingga hasilnya sesuai dengan nilai kurva standard. (7)
b. Analitik: 1. Prinsip metode Clauss Instrumen ini menggunakan metode deteksi bekuan foto-optik dan juga didasari dengan metode pemeriksaan konsentrasi fibrinogen dengan metode Clauss. Dengan menggunakan lampu merah (660 nm) untuk menyinari sampel plasma & reagen yang tercampur, instrumen akan mendeteksi perubahan intensitas cahaya yang tersebar karena meningkatnya kekeruhan yang terjadi akibat adanya perubahan Fibrinogen ke fibrin. Kurva koagulasi digambar berdasarkan hasil pengukuran waktu koagulasi dan intensitas sinar yang terpencar pada sumbu X dan Y. Titk akhir (endpoint) waktu koagulasi ditentukan oleh metode deteksi persentase. A. Metode deteksi optik Instrumen ini menentukan waktu pembekuan dengan mengukur perubahan intensitas cahaya yang dihamburkan oleh sampel karena adanya peningkatan kekeruhan. Sinar dari Light Emiting Diode (LED) tercermin dan tersebar oleh sampel. Sebuah foto dioda menyerap cahaya yang disebarkan oleh sampel dan mengubah intensitasnya menjadi sinyal listrik. Sebuah monitor mikroprosesor menangkap sinyal-sinyal ini dan menggunakan mereka untuk menghitung waktu pembekuan sampel.
Gambar. Deteksi optik
B. koagulasi dan cahaya tersebar Korelasi antara intensitas cahaya yang terpencar dan perubahan waktu ditunjukkan pada gambar di bawah. Dengan menghangatkan plasma yang kemudian dicampurkan pada reagen yang hangat, maka segera setelah percampuran tersebut akan terbaca intensitas sinar pencaran yang rendah (langkah 1) intensitas cahaya tersebar rendah (langkah 1). Sebagai hasil proses koagulasi, sampel menjadi keruh karena pembentukan bekuan fibrin dan intensitas cahaya tersebar meningkat drastis (langkah 2-3). Ketika koagulasi selesai, intensitas cahaya tersebar
stabil (langkah 4). Instrumen ini dapat menyimpan perubahan dalam intensitas cahaya yang tersebar dalam memori, dan outputnya berupa kurva koagulasi.
Gambar. Langkah pembacaan kurva koagulasi C. metode deteksi persentase Penentuan waktu bekuan yaitu dengan mengukur intensitas cahaya yang terpencar segera setelah reagen ditambahkan ke dalam sampel didefinisikan sebagai 0%. Setelah sampel menjadi keruh dan penuh maka koagulasi stabil, intensitas cahaya tersebar didefinisikan sebagai 100%. Dalam penentuan perubahan prosentase sebagai end point dari waktu pembekuan tidak dibatasi, waktu pembekuan ini dapat dipilih antara 2% - 80 %, namun pada umumnya yang disepakati untuk dipakai sebagai end point waktu pembekuan adalah 50% dengan pertimbangan pada saat itu rata-rata perubahan intensitas scatter pada saat itu adalah yang terbesar dan reaksi polimerisasi dari fibrin monomer tertinggi pada titik ini. (5).
Gambar. Metode deteksi persen & konsentrasi fibrin
Untuk menghitung konsentrasi atau persen aktivitas protrombin, Fibrinogen dan faktor koagulasi lainnya, alat ini memanfaatkan kurva standar, dengan menggunakan analisis data atau nilai-nilai yang telah dimasukkan secara manual. Kurva standar menggunakan waktu
10
pembekuan untuk sumbu vertikal (Y), dan menggunakan logaritma dari aktivitas persen atau konsentrasi plasma referensi untuk sumbu horisontal (X). (5)
Gambar. Kurva waktu koagulasi dibanding konsentrasi Prinsip Perhitungan
1) Rumus regresi linier yang digunakan untuk mengekspresikan hubungan antara waktu
pembekuan dan aktivitas persen atau konsentrasi. Poin dinyatakan sebagai garis lurus bila diplot pada skala logaritmik. 2) Dalam contoh yang ditunjukkan pada gambar di bawah, analisis yang menghasilkan data untuk sampel tertentu (titik X) plot antara titik C dan D. Dalam hal ini, kegiatan persen atau konsentrasi dihitung dengan rumus logaritma, poin memanfaatkan C dan D. 3) Jika hasil analisis data petak di luar A sampai F, persen kegiatan atau konsentrasi dihitung dengan rumus logaritmik memanfaatkan terdekat dua poin. Misalnya, kegiatan persen atau konsentrasi titik Y dihitung dengan rumus logaritma, memanfaatkan titik A dan B, dan titik Z dihitung oleh rumus logaritmik memanfaatkan poin E dan F.
Gambar. Kurva koagulasi dengan perhitungan algoritmik.
11
2. Mekanisme Analisis Instrumen Sysmex Ca 600
instrumen melakukan analisis sesuai dengan prosedur yang dijelaskan di bawah ini: 1. Sampel diatur dalam rak sampel, menempatkannya pada posisi analisis yang tepat. Analisis dimulai pada sampel dalam tabung Posisi No 1 menurut urutan yang telah ditetapkan pada pengaturan untuk setiap sampel. Tabung reaksi dalam rak sampel kemudian ditempatkan pada posis untuk diaspirasi satu demi satu.
- Larutan pengencer berupa Buffer Owrens Veronal Buffer (OW Buffer), pengenceran ini harus dilakukan untuk menurunkan konsentrasi inhibitor (FDPs dan heparin) (5). - Regen berupa thrombin yang kuat 2 NIH unit/ml (1 WHO unit = 0.56 NIH unit, 1 NIH unit = 0.324 +/- 0.073 g) sehingga waktu pembekuan tidak tergantung pada konsentrasi thrombin yang bervariasi.(5) 12
2. Probe yang dipanasi mengaspirasi sejumlah volume plasma yang dibutuhkan dari sampel rak. Volume sampel + buffer yang diperlukan dihitung secara otomatis dari jumlah parameter uji yang ditentukan untuk masing-masing sampel. 3. Probe yang dipanasi kemudian membagi-bagikan sampel yang telah disedot tadi ke dalam tabung reaksi di rak reaksi. 4. Tabung reaksi yang berisi sampel plasma kemudian ditransfer ke sumuran inkubasi oleh sistim robotik, dan diinkubasi (hangat) dalam waktu tertentu. 5. Probe yang dipanasi mengaspirasi sejumlah reagen tertentu dari botol reagen di rak reagen. Reagen yang disedot adalah hangat untuk jangka waktu tertentu di dalam Heater Probe. 6. Alat catcher hand sampel memindahkan tabung reaksi pada posisi tempat pembagian reagen, dan reagen yang telah diinkubasi dituang saat tabung reaksi masih di catcher hand. 7. Catcher mencampur sampel dengan reagen dengan menggetarkan tabung reaksi sambil memegangnya. 8. Kemudian tabung reaksi diangkut ke sumur deteksi dan diterangi dengan lampu merah. 9. Dalam detektor, reaksi terdeteksi melalui perubahan cahaya tersebar. 10. Setelah prosedur, sampel catcher mengangkut tabung reaksi dan membuang itu di laci tabung sampah(5). 3. Sumber kesalahan Analitik 1. Ketidaktepatan penyiapan reagen Thrombin a. Buffer atau reagen yang terkontaminasi b. Rekonstitusi buffer yang tidak tepat. c. Menggunakan thrombin yang baru keluar dari freezer d. Kondisi thrombin yang rusak e. Penyimpanan dalam glass f. Perpanjangan penyimpanan thrombin yang telah diencerkan > 1 jam dalam suhu 80C. 2. Kondisi yang salah a. Waktu inkubasi yang salah b. Temperature yang tidak tepat c. pH buffer d. volume e. Prosedur Instrumentasi yang salah 13
3. Paraprotein Paraprotein yang tinggi dalam plasma dapat mempengaruhi proses polimerisasi dari fibrin monomer, hal ini dapat mempengaruhi hasil konsentrasi fibrinogen yang rendah palsu. 4. Bovine thrombin antibodies Penggunaan reagen ini dapat menimbulkan reduksi dari formasi thrombin dan dapat mengakibatkan kadar fibrinogen yang rendah palsu 5. Produk degradasi fibrin / fibrinogen (FDP). Produk proteolitik fibrinogen dan fibrin dalam konsentrasi tinggi dapat mengganggu polimerisasi fibrin. Pada konsentrasi fibrinogen di bawah 150 mg / dL (1,5 g / L), FDP lebih besar dari 75 mg / mL (75 mg / L) menurunkan laju polimerisasi fibrin dan konsentrasi fibrinogen rendah pula.17 6. Heparin Heparin, merupakan activator kuat dari antithrombin, yang mampu menghambat protease serin yang berperan dalam pembekuan-aktif termasuk thrombin secara irreversibel, dapat mengganggu waktu pembekuan trombin, sehingga menyebabkan false rendah konsentrasi fibrinogen. Memerlukan konsentrasi yang lebih tinggi dari heparin (lebih besar dari 5,0 U / mL) untuk mencapai inhibition.17 Meskipun konsentrasi ini jarang terlihat dalam penggunaan klinis dari heparin, konsentrasi ini dapat ditemukan dalam darah yang dikumpulkan dengan cara yang salah dalam tabung heparinized atau melalui baris heparinized (konsentrasi lokal yang tinggi), dan pada pasien yang menjalani operasi bypass cardiopulmonary, atau selama hemodialisis. 7. Dysfibrinogenemia Pada pasien tertentu baik dari kelainan dapatan atau warisan biokimia fibrinogen yang dapat menghambat aksi trombin pada fibrinogen dan / atau fibrin polimerisasi (yaitu, dysfibrinogenemia), maka pada keadaan ini konsentrasi fibrinogen dapat lebih rendah daripada keadaan aslinya. (7). c. Post analitik Intepretasi hasil pemeriksaan dengan metode clauss yang pada dasarnya tergantung dari fungsi fibrinogen sendiri yang dapat dipengaruhi oleh: Kadar FDPs yang tinggi >190 g/ml Kadar Heparin yang tinggi > 8 /ml Pada pemeriksaan dysfibrinogenemia akan rendah palsu karena fungsi fibrinogen yang tidak adakuat. Jadi apabila dicurigai terdapat kelainan dysfibrinogenemia turunan maka pemeriksaan secara fisikokemikal dilakukan (estimasi clot weight of fibrinogen, total 14
clottable fibrinogen, immunological) maka akan didapatkan hasil yang sangat berbeda bila dibandingkan dengan metode clauss. (5). Apabila hasil pemeriksaan sampel mengalami prolonged clotting time atau flag ERR (4) atau analisis time over maka langkah yang dilakukan adalah: a. Periksa sampel dengan kemungkinan terjadi kontaminasi antikoagulan, hemolisis, lipemik, dan lain sebagainya. b. Periksa transportasi sampel dan reagen c. Jika waktu memanjang kemungkinan terdapat konsentrasi fibrinogen yang randah maka pengenceran sampel dikurangi dengan perbandingan 1:5 kemudian di reanalisa. d. Bila hasil reanalisa tidak menunjukkan flag maka hasil dapat dilaporkan e. Apabila masih terjadi flag analisis time over maka lakukan pemeriksaan secara manual (5). Apabila terdapat waktu pembekuan yang memanjang diperkirakan konsentrasi fibrinogen yang randah, apabila waktu pembekuan yang terlalu cepat diperkirakan konsentrasi fibrinogen yang tinggi sehingga tidak terdeteksi oleh alat ini maka hal yang direkomendasikan adalah: Ketika menganalisis konsentrasi tinggi Fbg (+ Fbg), analisa dilakukan dengan perbandingan pengenceran plasma:buffer adalah 1:20. Dengan konsentrasi rendah Fbg (-Fbg), menganalisis dengan pengenceran
plasma:buffer adalah 1:5. Kemudian setelah itu kembali di reanalisa, bils msdih tidak terdeteksi lakukan dengan metode lain.
15
Pengguna haruslah mengikuti ketentuan-ketentuan yang telah diberlakukan dalam memasukkan hasil pemeriksaan kedalam Laboratory Information System (LIS) untuk meminimalisasi atau mengeliminasi kesalahan dan menjamin ketepatan serta keakuratan (6).
16
d. Quality Control Quality kontrol dilakukan untuk memperoleh data keandalan tinggi lebih lama periode dan juga untuk terus-menerus memantau status instrumen untuk mencegah masalah di muka. Alat ini menganalisis kontrol plasma dan sampel standar lainnya (QC sampel) dan melakukan kontrol statistik hasil. Hal ini dilakukan tiap 24 jam baserta memastikan keadaaan alat beroperasi sebagaimana mestinya. Pada alat sysmex Ca 600 terdapat 2 cara untuk melakukan quality kontrol Yaitu:
1. X Kontrol: Menggunakan data rata-rata dari dua analisis berturut-turut dilakukan pada
sampel QC (kontrol plasma atau plasma pooled). Karena rata-rata yang digunakan sebagai data kontrol, maka metode kontrol ini hampir tidak ada efek reproduksibilitas selama analisis. 2. kontrol LJ: Menggunakan data analisis tunggal pada sampel QC. The L-J kontrol rentan terhadap efek reproduksibilitas sehingga terjadi rentang kendali yang lebih lebar dari kontrol X . (6).
17
DAFTAR PUSTAKA 1. http://www.bionity.com/en/encyclopedia/Coagulation.html 2. Bernadette F.R. at. Al. Hematololy clinical principles and application 3rd ed p.575. 3. Torstein Jensen, MD. Studies of subfraction on fibrinogen, University of Oslo Norway 2008 4. GUIDELINES ON FIBRINOGEN ASSAYS: British Journal of Haematology, 2003, 121, 396404 5. SM Lewis, Decie and Lewis PRACTICAL HAEMATOLOGY 10thed. Churchil livingstone, 2006. 6. INSTRUCTIONS FOR USE Automated Blood Coagulation Analyzer CA-600 series symex, kobe, Japan 7. Procedure for the Determination of Fibrinogen in Plasma; Approved Guideline Second Edition NCCLS.
18
Anda mungkin juga menyukai
- Format Pedoman Pelayanan RMDokumen2 halamanFormat Pedoman Pelayanan RMHesti AnggrainiBelum ada peringkat
- Spo Orientasi DLLDokumen2 halamanSpo Orientasi DLLElvan Dwi WidyadiBelum ada peringkat
- Kebijakan Pelayanan CSSDDokumen4 halamanKebijakan Pelayanan CSSDElvan Dwi WidyadiBelum ada peringkat
- Kebijakan Pelayanan CSSDDokumen5 halamanKebijakan Pelayanan CSSDElvan Dwi WidyadiBelum ada peringkat
- Format Pedoman Pelayanan Rekam MedikDokumen2 halamanFormat Pedoman Pelayanan Rekam MedikElvan Dwi WidyadiBelum ada peringkat
- Spo OrientasiDokumen20 halamanSpo Orientasirohaya ayaBelum ada peringkat
- Format Pedoman Pelayanan DarahDokumen2 halamanFormat Pedoman Pelayanan DarahYoga KarsendaBelum ada peringkat
- Profil Indikator Mutu Pelayanan LaboratoriumDokumen7 halamanProfil Indikator Mutu Pelayanan LaboratoriumElvan Dwi Widyadi100% (1)
- Profil Indikator Mutu Pelayanan LaboratoriumDokumen7 halamanProfil Indikator Mutu Pelayanan LaboratoriumElvan Dwi WidyadiBelum ada peringkat
- Format Pedoman Pelayanan RadiologiDokumen2 halamanFormat Pedoman Pelayanan RadiologipucukjayaBelum ada peringkat
- Pemantauan Suhu Ruangan Pemeriksaan LaboratoriumDokumen1 halamanPemantauan Suhu Ruangan Pemeriksaan LaboratoriumElvan Dwi WidyadiBelum ada peringkat
- PK PD, Cakupan AB Sesuai Spektrum, Dan AB Pada Infeksi BeratDokumen7 halamanPK PD, Cakupan AB Sesuai Spektrum, Dan AB Pada Infeksi BeratElvan Dwi WidyadiBelum ada peringkat
- Pemantauan Suhu Ruangan Pemeriksaan LaboratoriumDokumen1 halamanPemantauan Suhu Ruangan Pemeriksaan LaboratoriumElvan Dwi WidyadiBelum ada peringkat
- Format Pedoman Pelayanan GiziDokumen1 halamanFormat Pedoman Pelayanan GizipucukjayaBelum ada peringkat
- Pedoman Pengorganisasi Unit LaboratoriumDokumen26 halamanPedoman Pengorganisasi Unit Laboratoriumtitik zunaidahBelum ada peringkat
- DRef - Dislipidemia 130715Dokumen28 halamanDRef - Dislipidemia 130715Elvan Dwi WidyadiBelum ada peringkat
- Ref KK Dislipidemia 130715Dokumen57 halamanRef KK Dislipidemia 130715Elvan Dwi WidyadiBelum ada peringkat
- BV DianDokumen22 halamanBV DianElvan Dwi WidyadiBelum ada peringkat
- Manejemen LabDokumen2 halamanManejemen LabelvanBelum ada peringkat
- Hepatitis BDokumen5 halamanHepatitis BElvan Dwi WidyadiBelum ada peringkat
- Ppra Smart Struktur OrganisasiDokumen14 halamanPpra Smart Struktur OrganisasiElvan Dwi Widyadi100% (1)
- Rasal Dan Raslan - Ronald Irwanto Raspro Indonesia (PDSPK JKT 11-12 Mei 2018)Dokumen37 halamanRasal Dan Raslan - Ronald Irwanto Raspro Indonesia (PDSPK JKT 11-12 Mei 2018)Elvan Dwi Widyadi100% (5)
- Pedoman Penggunaan AntibiotikDokumen15 halamanPedoman Penggunaan AntibiotikElvan Dwi Widyadi100% (1)
- Manejemen LabDokumen2 halamanManejemen LabelvanBelum ada peringkat
- BV DianDokumen22 halamanBV DianElvan Dwi WidyadiBelum ada peringkat
- Kemampuan ABDokumen3 halamanKemampuan ABElvan Dwi WidyadiBelum ada peringkat
- Infeksi ParuDokumen6 halamanInfeksi ParuElvan Dwi WidyadiBelum ada peringkat
- Format Pedoman OrganisasiDokumen2 halamanFormat Pedoman Organisasipucukjaya100% (1)
- PKPD AntibiotkDokumen8 halamanPKPD AntibiotkElvan Dwi WidyadiBelum ada peringkat
- Format Pedoman Pelayanan DarahDokumen2 halamanFormat Pedoman Pelayanan DarahYoga KarsendaBelum ada peringkat