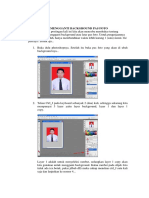
Teori Tumbukan
Diunggah oleh
Aris Tarchus0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
78 tayangan5 halamanteori tumbukan.docx
Judul Asli
teori tumbukan.docx
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Initeori tumbukan.docx
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
78 tayangan5 halamanTeori Tumbukan
Diunggah oleh
Aris Tarchusteori tumbukan.docx
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 5
teori tumbukan
Teori tumbukan menggambarkan pertemuan partikel-partikel pereaksi sebagai
suatu tumbukan. Tumbukan ada yang menghasilkan reaksi dan ada yang tidak
menghasilkan reaksi. Tumbukan yang menghasilkan partikel-partikel produk
reaksi disebut tumbukan efektif. Faktor-faktor yang menentukan tumbukan efektif
yaitu energi kinetik partikel (molekul) dan orientasi atau arah partikel.
Tumbukan antara pereaksi ada yang menghasilkan reaksi dan tidak, sebagai
contoh amati gambar reaksi antara hidrogen dan iodium berikut:
Gambar 1: Tumbukan hidrogen dan iodium yang tidak menghasilkan reaksi
Gambar 2 Tumbukan hidrogen dan iodium yang menghasilkan reaksi
Kemudian dijelaskan juga bahwa Laju reaksi kimia tergantung pada hasil kali
frekuensi tumbukan dengan fraksi molekul yang memiliki energi sama atau
melebihi energi pengaktifan. Karena fraksi molekul yang teraktifkan biasanya
sangat kecil, maka laju reaksi jauh lebih kecil daripada frekuensi tumbukannya
sendiri. Semakin tinggi nilai energi pengaktifan, semakin kecil fraksi molekul
yang teraktifkan dan semakin lambat reaksi berlangsung. Perhatikan contoh reaksi
berikut.
A2(g) + B2(g) 2AB(g)
Menurut pengertian teori tumbukan, selama tumbukan antara
molekul A2 dan B2 (dianggap) ikatan AA dan BB putus dan terbentuk ikatan
AB. Pada gambar 2. ditunjukkan bahwa anggapan itu tidak selamanya berlaku
untuk setiap tumbukan.
Molekul-molekul harus mempunyai orientasi tertentu agar tumbukan efektif untuk
menghasilkan reaksi kimia. Pada gambar 2. ditunjukkan bahwa jumlah tumbukan
yang orientasinya tidak memungkinkan terjadi reaksi umumnya lebih banyak
daripada jumlah tumbukan yang memungkinkan terjadinya reaksi. Hal itu berarti
peluang suatu tumbukan tertentu untuk menghasilkan reaksi umumnya kecil.
Faktor-faktor yang mempengaruhi laju reaksi seperti konsentrasi, luas permukaan,
suhu dan katalis berhubungan dengan tumbukan antar partikel. Mengapa demikian
? Hal ini dapat dijelaskan sebagai berikut :
1. PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
untuk lebih jelasnya perhatikan gambar berikut:
Gambar 4. pengaruh konsentrasi terhadap laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa konsentrasi pereaksi berkaitan
dengan jumlah partikel zat yang terlibat dalam tumbukan. Bila pereaksi
bertambah, maka jumlah partikel-partikel yang bertumbukan akan semakin
banyak/meningkat. Dengan demikian jarak antara partikel.zat tersebut menjadi
lebih dekat dan jumlah tumbukkan efektif juga akan meningkat. Hal ini berarti
terjadi peningkatan laju suatu reaksi. Dan sebaliknya, jika konsentrasi berkurang,
maka tumbukan akan sedikit dan laju reaksi juga akan berkurang.
2. PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Untuk massa yang sama, semakin halus bentuk suatu zat maka semakin luas
permukaan zat. Berdasarkan teori tumbukan: semakin luas permukaan partikel,
semakin besar kemungkinan terjadinya tumbukan antar partikel.
Perhatikan gambar berikut ini!
Gambar 5. pengaruh luas permukaan terhadap laju reaksi
Dari gambar 5 dapat dilihat bahwa serbuk Fe bereaksi lebih cepat dari pada batang
Fe. Hal ini disebabkan karena luas permukaan serbuk Fe lebih luas daripada
kepingan Fe, sehingga bidang sentuhnya lebih banyak untuk bertumbukan dengan
zat lain. Akibatnya laju reaksi zat berbentuk serbuk lebih cepat daripada zat yang
berbentuk kepingan. Untuk lebih jelasnya lihat gambar dibawah ini.
3. PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Pengaruh temperatur terhadap laju reaksi terkait dengan energi kinetik
partikel. Mengapa demikian ? Perhatikan gambar berikut ini:
Gambar 6. tumbukan partikel pada suhu tinggi dan rendah.
Berdasarkan gambar diatas dapat dilihat bahwa pada suhu tinggi, jumlah partikel
yang bertumbukan lebih banyak dibandingkan pada suhu rendah. Hal ini
disebabkan karena pada suhu tinggi energi kinetik partikel akan lebih besar. Hal
ini menyebabkan jumlah tumbukan semakin banyak sehingga laju reaksi akan
meningkat.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Pengaruh katalis dalam mempengaruhi laju reaksi terkait dengan energi
pengaktifan reaksi (Ea). Katalis yang digunakan untuk mempercepat reaksi
memberikan suatu mekanisme reaksi alternatif dengan nilai Ea yang lebih rendah
dibandingkan dengan nilai Ea reaksi tanpa katalis. Semakin rendah nilai Ea maka
lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi
halangan Ea yang rendah ini. Hal ini menyebabkan jumlah tumbukan efektif akan
bertambah, sehingga laju reaksi juga akan meningkat. Zat yang mempercepat laju
reaksi disebut katalisator. Sedangkan zat yang memperlambat laju reaksi disebut
umum disebut Inhibitor.
Pada kenyataannya molekul-molekul dapat bereaksi jika terdapat tumbukan dan
molekul-molekul mempunyai energi minimum untuk bereaksi. Energi minimum
yang diperlukan untuk bereaksi pada saat molekul bertumbukan disebut energi
aktivasi. Energi aktivasi digunakan untuk memutuskan ikatan-ikatan pada
pereaksi sehingga dapat membentuk ikatan baru pada hasil reaksi. Misalnya
energi aktivasi pada reaksi gas hidrogen dan iodium dengan persamaan reaksi:
digambarkan pada grafik sebagai berikut.
Gambar 7 : Grafik energi potensial dan waktu pada reaksi H2 dan I2
Energi aktivasi pada reaksi tersebut adalah 170 kJ per mol. Untuk terjadi
tumbukan antara H2 dan I2 diperlukan energi 170 kJ. Pada saat reaksi terjadi
energi sebesar 170 kJ diserap dan digunakan untuk memutuskan ikatan H H dan
I I selanjutnya ikatan H I terbentuk. Pada saat terbentuk H I ada energy yang
dilepaskan sehingga reaksi tersebut termasuk reaksi eksoterm.
Untuk mengetahui bagaimana kerja katalis sehingga dapat mempercepat reaksi,
Perhatikan Gambar berikut:
Gambar 8 : Grafik energi potensial reaksi tanpa katalis dan dengan bantuan
katalis
Pada Gambar diatas, proses reaksi tanpa katalis digambarkan dengan satu kurva
yang tinggi sedangkan dengan katalis menjadi kurva dengan dua puncak yang
rendah sehingga energi aktivasi pada reaksi dengan katalis lebih rendahdaripada
energi aktivasi pada reaksi tanpa katalis. Berarti secara keseluruhan katalis dapat
menurunkan energi aktivasi dengan cara mengubah jalannya reaksi atau
mekanisme reaksi sehingga reaksi lebih cepat.
Hubungan antara katalis dan energi pengaktifan dapat dilihat pada gambar
dibawah ini :
Anda mungkin juga menyukai
- Soal Teori TumbukanDokumen4 halamanSoal Teori Tumbukanfahmik11Belum ada peringkat
- Teori Tumbukan Dan Teori Pembentukan Keadaan TransisiDokumen23 halamanTeori Tumbukan Dan Teori Pembentukan Keadaan TransisiNadiratul KhairahBelum ada peringkat
- Teori Tumbukan Dan Teori Pembentukan Keadaan TransisiDokumen22 halamanTeori Tumbukan Dan Teori Pembentukan Keadaan TransisiNadiratul KhairahBelum ada peringkat
- Kelas XI KD 3.6 (013 Dan 039)Dokumen7 halamanKelas XI KD 3.6 (013 Dan 039)SariBelum ada peringkat
- Bahan Ajar Aksi 1Dokumen9 halamanBahan Ajar Aksi 1Hari BowoBelum ada peringkat
- Laju Reaksi (Teori Tumbukan) .Dokumen36 halamanLaju Reaksi (Teori Tumbukan) .Nur HirdayantiBelum ada peringkat
- Teori Tumbukan Pada Laju ReaksiDokumen11 halamanTeori Tumbukan Pada Laju ReaksiAlfa Jr.Belum ada peringkat
- Teori Tumbukan Dan Energi AktivasiDokumen10 halamanTeori Tumbukan Dan Energi AktivasiHidayatur RahmanBelum ada peringkat
- Teori TumbukanDokumen10 halamanTeori TumbukanriefahBelum ada peringkat
- (Composed) Laju ReaksiDokumen7 halaman(Composed) Laju ReaksiAprian Rudina SukmaBelum ada peringkat
- Factor Frekuensi TumbukanDokumen20 halamanFactor Frekuensi TumbukanwynneralphBelum ada peringkat
- Teori TumbukanDokumen7 halamanTeori TumbukanPuput ElshirazyBelum ada peringkat
- Bahan Ajar Laju Reaksi - 1Dokumen8 halamanBahan Ajar Laju Reaksi - 1Tabrani TabraniBelum ada peringkat
- Laju ReaksiDokumen10 halamanLaju ReaksiEjawantah PikiranBelum ada peringkat
- Jelaskan Hal-Hal Yang Dapat Berpengaruh Terhadap Laju Reaksi, Penjelasannya Sebaiknya Dikaitkan Dengan Contoh-ContohDokumen10 halamanJelaskan Hal-Hal Yang Dapat Berpengaruh Terhadap Laju Reaksi, Penjelasannya Sebaiknya Dikaitkan Dengan Contoh-ContohRomarisna Fransiska SimalangoBelum ada peringkat
- Energi AktivsiDokumen8 halamanEnergi AktivsiAknasasia Virginia KrisantiBelum ada peringkat
- LKS Laju Reaksi 2Dokumen11 halamanLKS Laju Reaksi 2May Darma SyariiBelum ada peringkat
- Laju ReaksiDokumen8 halamanLaju ReaksiBali32Gede Wisnu Ambara PutraBelum ada peringkat
- Kelompok 4: Laju Reaksi Dan Teori TumbukanDokumen17 halamanKelompok 4: Laju Reaksi Dan Teori TumbukanMuhammad Raihan BahtiarBelum ada peringkat
- P1 XI KD34 PandemiDokumen6 halamanP1 XI KD34 PandemiBelaBelum ada peringkat
- Konsep Laju ReaksiDokumen14 halamanKonsep Laju ReaksiEdii SupartawanBelum ada peringkat
- Bahan Ajar Kimia KA 3.6Dokumen8 halamanBahan Ajar Kimia KA 3.6Kamil AhmadBelum ada peringkat
- Laju Reaksi FixDokumen27 halamanLaju Reaksi FixWini Rizky GustianiBelum ada peringkat
- Ayo Baca M6Dokumen7 halamanAyo Baca M6Rahma FitriaBelum ada peringkat
- LKPD Teori TumbukanDokumen5 halamanLKPD Teori TumbukanEma Putri LestariBelum ada peringkat
- Laju ReaksiDokumen10 halamanLaju ReaksiYusuf AhfazBelum ada peringkat
- Laju ReaksiDokumen34 halamanLaju ReaksiRusdianaDewiBelum ada peringkat
- Bahan Ajar Aksi 1Dokumen20 halamanBahan Ajar Aksi 1Servas ParihiBelum ada peringkat
- Pekan 7 - Teknik Reaksi Kimia 1 - Pengaruh Tumbukan Terhadap Kecepatan Reaksi PDFDokumen21 halamanPekan 7 - Teknik Reaksi Kimia 1 - Pengaruh Tumbukan Terhadap Kecepatan Reaksi PDFHafis DalimBelum ada peringkat
- Pengaruh Konsentrasi Dan Suhu Terhadap Laju ReaksiDokumen5 halamanPengaruh Konsentrasi Dan Suhu Terhadap Laju ReaksiMegha HermanBelum ada peringkat
- Laju Reaksi Pertemuan 1-2Dokumen20 halamanLaju Reaksi Pertemuan 1-2nikeishacahyaniBelum ada peringkat
- Modul Laju ReaksiDokumen4 halamanModul Laju ReaksiAlvian DengoBelum ada peringkat
- 01Dokumen7 halaman01Nurul KhairunnisaBelum ada peringkat
- Bahan Ajar Konsep Laju ReaksiDokumen5 halamanBahan Ajar Konsep Laju ReaksiFita62 PusBelum ada peringkat
- Kelompok 7 Kimfis FIXDokumen22 halamanKelompok 7 Kimfis FIXsilviaBelum ada peringkat
- PERCOBAAN IV Pengaruh Kosentrasi Dan Temperatur Terhadap Laju ReaksiDokumen20 halamanPERCOBAAN IV Pengaruh Kosentrasi Dan Temperatur Terhadap Laju ReaksiNita Anggraeni100% (1)
- Bahan Ajar FullDokumen21 halamanBahan Ajar FullFarihatul UmmahBelum ada peringkat
- Laju Reaksi Dan PembahasannyaDokumen16 halamanLaju Reaksi Dan PembahasannyaNurul Aini NazlaBelum ada peringkat
- Laporan Praktikum 1 1918 - 18.6Dokumen56 halamanLaporan Praktikum 1 1918 - 18.6rindiyani anggun lestariBelum ada peringkat
- Modul Pembelajaran Kimia Dasar 2 - Afadil - Kinetika KimiaDokumen30 halamanModul Pembelajaran Kimia Dasar 2 - Afadil - Kinetika KimiaMuhammad amiruddinBelum ada peringkat
- Modul Laju ReaksiDokumen15 halamanModul Laju Reaksievan131006Belum ada peringkat
- Dokumen - Tips - Jawaban Pertanyaan 5782b567b60f1Dokumen4 halamanDokumen - Tips - Jawaban Pertanyaan 5782b567b60f1Rhe floBelum ada peringkat
- Laju Reaksi RPPDokumen15 halamanLaju Reaksi RPPYuni Sstt ChemistBelum ada peringkat
- Pengertian Laju ReaksiDokumen5 halamanPengertian Laju ReaksiRISHAD BAIHAQIBelum ada peringkat
- Faktor-Faktor Yang Mempengaruhi Kecepatan ReaksiDokumen5 halamanFaktor-Faktor Yang Mempengaruhi Kecepatan ReaksiChristine Juliana Ciembolonz33% (3)
- Faktor Yang Memengaruhi Laju ReaksiDokumen16 halamanFaktor Yang Memengaruhi Laju ReaksiKaunaini ChusnaBelum ada peringkat
- Makalah Kimia Laju ReaksiDokumen16 halamanMakalah Kimia Laju ReaksiArjul FauLtBelum ada peringkat
- LKPD Laju ReaksiDokumen5 halamanLKPD Laju ReaksiRahma LindaBelum ada peringkat
- 3.7 RPP Laju Reaksi (Faktor-Faktor)Dokumen48 halaman3.7 RPP Laju Reaksi (Faktor-Faktor)Kholida Handayani50% (2)
- TRK 1901093 Azza ZemiaDokumen3 halamanTRK 1901093 Azza ZemiaZemia SurbaktiBelum ada peringkat
- Laju Reaksi PDFDokumen21 halamanLaju Reaksi PDFK1llerbooBelum ada peringkat
- Laju Reaksi Dan PembahasannyaDokumen43 halamanLaju Reaksi Dan PembahasannyayusnitaBelum ada peringkat
- Percobaan 1 Faktor Laju ReaksiDokumen36 halamanPercobaan 1 Faktor Laju ReaksiSisilia Fil JannatiBelum ada peringkat
- FisikaDokumen4 halamanFisikaSatnis PutriBelum ada peringkat
- Bahan Ajar Laju ReaksiDokumen11 halamanBahan Ajar Laju ReaksiAlbi GifaniBelum ada peringkat
- TEKNIK REAKSI KIMIA (Tentang Kinetika Reaksi Kimia)Dokumen4 halamanTEKNIK REAKSI KIMIA (Tentang Kinetika Reaksi Kimia)Martha DewiBelum ada peringkat
- Format Jurnal Praktikum Kimia Faktor-Faktor Yang Mempengaruhi Laju ReaksiDokumen7 halamanFormat Jurnal Praktikum Kimia Faktor-Faktor Yang Mempengaruhi Laju ReaksiKostantins AninamBelum ada peringkat
- 9Dokumen2 halaman9Aris TarchusBelum ada peringkat
- An-Nur 32-34Dokumen14 halamanAn-Nur 32-34Aris Tarchus50% (2)
- Written by Idoel Idoel On SabtuDokumen7 halamanWritten by Idoel Idoel On SabtuAris TarchusBelum ada peringkat
- Batang GunugDokumen1 halamanBatang GunugAris TarchusBelum ada peringkat
- Happy WeddingDokumen2 halamanHappy WeddingAris TarchusBelum ada peringkat
- Ragam MusikDokumen24 halamanRagam MusikAris TarchusBelum ada peringkat
- Jenis Jenis Flora Di Indonesia1Dokumen9 halamanJenis Jenis Flora Di Indonesia1Aris TarchusBelum ada peringkat
- Cara Mudah Mengganti Background Pas FotoDokumen4 halamanCara Mudah Mengganti Background Pas FotoAris TarchusBelum ada peringkat
- Makalah Administrasi ManajemenDokumen17 halamanMakalah Administrasi ManajemenAris TarchusBelum ada peringkat
- Pelajaran 2Dokumen2 halamanPelajaran 2Aris TarchusBelum ada peringkat
- Cere WetDokumen6 halamanCere WetAris TarchusBelum ada peringkat
- Makala HDokumen8 halamanMakala HAris TarchusBelum ada peringkat
- Hak SewaDokumen5 halamanHak SewaAris TarchusBelum ada peringkat