Laju Reaksi (Teori Tumbukan) .
Diunggah oleh
Nur Hirdayanti0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
4 tayangan36 halamanJudul Asli
Laju Reaksi (Teori Tumbukan).
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
4 tayangan36 halamanLaju Reaksi (Teori Tumbukan) .
Diunggah oleh
Nur HirdayantiHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 36
Dosen Pengampu :
NOFRIYANTI, M.Farm., Apt
SEKOLAH TINGGI ILMU FARMASI RIAU
Pendahuluan “Kinetika Kimia”
Teori Tumbukan
Faktor Yang Mempengaruhi Terjadinya
Tumbukan
Hubungan Tumbukan dengan Energi Aktivasi
(Ea)
Hubungan Tumbukan dengan Laju Reaksi
Bidang kimia yang mengkaji laju terjadinya
reaksi kimia dinamakan Kinetika Kimia.
Kata “Kinetik” menyiratkan gerakan atau
perubahan.
Dapat didefinisikan bahwa energi kinetik
sebagai energi yang tersedia karena gerakan
suatu benda.
Kinetika itu sendiri merujuk pada laju reaksi
yaitu perubahan konsentrasi pereaksi atau
hasil reaksi terhadap watu (M/s)
Reaksi kimia terjadi dari arah reaktan
menuju produk, dan selama reaksi kimia
berlangsung, reaktan digunakan (dikonsumsi)
bersamaan dengan pembentukan sejumlah
hasil reaksi.
Secara umum, bila reaksi telah berlangsung
cukup lama maka akan terjadi penurunan
laju reaksi.
Maka, Kecepatan reaksi tergantung pada
konsentrasi zat-zat yang bereaksi.
Kecepatan reaksi kimia hampir selalu
berbanding lurus dengan konsentrasi reaktan
dengan pangkat tertentu yang merupakan
orde suatu reaksi.
Besarnya konsentrasi reaktan berpengaruh
terhadap tumbukan yang terjadi.
Molekul-molekul reaktan yang bertumbukan
akan diaktivasi oleh adanya energi aktivasi
atau energi pengaktifan.
Pertemuan partikel-partikel reaktan sebagai
suatu tumbukan.
Proses tumbukan dapat menghasilkan reaksi
maupun tidak menghasilkan reaksi.
Jika menghasilkan reaksi tumbukan
efektif.
Efektifitas tumbukan dipengaruhi oleh faktor
energi kinetik partikel (molekul) dan arah
partikel.
Tumbukan Hidrogen dan Iodium yang tidak menghasilkan
reaksi
Tumbukan Hidrogen dan Iodium yang menghasilkan
reaksi
Hasil kali frekuensi tumbukan dengan fraksi
molekul yang memiliki energi sama atau
melebihi energi aktivasi, menentukan laju
reaksi kimia.
Jika nilai pengaktifan semakin tinggi, maka
molekul yang teraktifkan akan semakin kecil
semakin lambat reaksi berlangsung.
Partikel zat yang saling bertumbukan tidak
langsung berubah menjadi produk.
Partikel tersebut terlebih dahulu membentuk
molekul kompleks molekul kompleks
teraktivasi, di mana ada hubungannya
dengan energi aktivasi.
Energi aktivasi (Ea) energi tumbukan
terendah yang dibutuhkan supaya bisa
terbentuk molekul kompleks teraktivasi.
1. Gas merupakan partikel molekul gas yang
ukurannya lebih kecil daripada jarak
antarmolekulnya
2. Gerakan molekul-molekul gas selalu lurus
ke segala arah
3. Tumbukan yang terjadi antara molekul gasl
dengan dinding wadah bersifat elastis
sempurna, artinya molekul gas akan
dipantulkan kembali tanpa kehilangan
energi.
4. Perubahan temperatur mempengaruhi
kecepatan gerak molekul gas. Semakin
tinggi temperatur, maka akan semakin cepat
gerakan molekul gas.
5. Harga energi kinetik rata-rata molekul gas
sama besar pada temperatur yang sama atau
tidak dipegaruhi oleh massanya.
Konsentrasi, luas permukaan, temperatur
dan katalis. Berhubungan erat dengan
tumbukan antar partikel, dan merupakan
faktor-faktor yang berpengaruh pada laju
reaksi.
Dapat diilustrasikan sebagai berikut :
Dari gambar di atas, diketahui bahwa konsentrasi
reaktan berhubungan erat dengan jumlah partikel
zat yang terlibat dalam tumbukan.
Jika jumlah reaktan bertambah banyak, maka
akan semakin banyak jumlah partikel-partikel
yang bertumbukan akan semakin dekat jarak
antara partikel sehingga jumlah tumbukan efektif
juga akan meningkat laju reaksi meningkat.
Semakin halus bentuk suatu zat untuk massa
yang sama, maka akan semakin luas
permukaan zat tersebut.
Semakin luas permukaan partikel semakin
besar kemungkinan terjadinya tumbukan.
Kondisi tersebut dapat diilustrasikan pada
gambar berikut :
Gambar di atas menginformasikan, bahwa
serbuk Fe bereaksi lebih cepat dibandingkan
dengan batang Fe.
Hal tersebut, karena serbuk Fe memiliki
permukaan yang lebih luas daripada kepingan
Fe, sehingga memiliki bidang sentuh yang
lebih banyak agar terjadi tumbukan laju
reaksi akan berlangsung cepat.
Gambar di atas menginformasikan bahwa
pada temperatur tinggi lebih banyak
jumlah partikel yang bertumbukan,
dibandingkan pada temperatur rendah.
Karena pada temperatur tinggi energi kinetik
partikel akan lebih besar tumbukan
semakin banyak laju reaksi meningkat.
Pengaruh katalis pada laju reaksi berakaitan
dengan energi aktivasi (Ea).
Katalis positif (+) mempercepat reaksi
dengan Ea lebih rendah.
Semakin rendah Ea lebih banyak partikel
memiliki cukup energi kinetik
meningkatnya jumlah tumbukan laju
reaksi pun akan meningkat.
Agar molekul dapat bereaksi harus terjadi
tumbukan, di mana molekul harus memiliki
energi minimum untuk bereaksi.
Energi aktivasi (Ea) energi minimum yang
diperlukan untuk bereksi pada saat molekul
bertumbukan.
Fungsi Ea memutuskan ikatan-ikatan pada
reaktan, sehingga terbentuk ikatan baru
pada hasil reaksi (produk).
Contoh energi aktivasi pada reaksi gas hidrogen dan
iodium yang mempunyai persamaan reaksi :
Penggambaran grafiknya sebagai berikut :
Besarnya energi aktivasi pada reaksi tersebut
adalah 170 kJ per mol, maka diperlukan
energi ≥ 170 kJ agar terjadi tumbukan.
Ketika reaksi berlangsung, diserap energi
sebesar 170 Kl dan digunakan untuk
memutuskan ikatan H - H dan I - I,
selanjutnya terbentuk ikatan H - I.
Reaksi tersebut termasuk reaksi eksoterm
karena pada saat terbentuk H – I ada energi
yang dilepaskan.
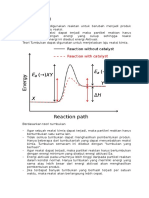
Gambar di atas menginformasikan bahwa proses
reaksi tanpa katalis satu kurva yang tinggi (Ea
tinggi), sedangkan dengan katalis kurva memiliki
dua puncak yang rendah (Ea rendah).
Katalis dapat menurunkan Ea menu=gubah jalan /
mekanisme reaksi reaksi lebih cepat terjadi.
Homogenitas katalis dapat dilihat dari fasenya, di
mana katalis yang homogen mempunyai fase yang
sama dengan fase reaktan.
Pada umumnya katalis heterogen digunakan
dalam wujud padat, sementara reaktan berwujud
gas atau cairan.
Teori kinetik gas merupakan dasar teori
tumbukan dalam membahas terjadinya suatu
reaksi kimia.
Berdasarkan teori kinetik gas, laju reaksi antara
dua jenis molekul A dan B sama dengan jumlah
tumbukan yang terjadi per satuan waktu antara
kedua jenis molekul tersebut.
Jumlah tumbukan yang terjadi persatuan waktu
sebanding dengan konsentrasi A dan B.
Maka, semakin besar konsentrasi A dan B
semakin besar pula tumbukan yang terjadi
semakin cepat laju reaksi.
1. Tidak semua tumbukan menghasilkan
reaksi, karena untuk menghasilkan reaksi
diperlukan energi aktivasi. Jika energi
tumbukan lebih besar atau sama dengan Ea
reaksi baru bisa terjadi.
2. Rumitnya struktur ruang suatu molekul
mengakibatkan tumbukan yang tidak sama
jumlahnya jika dibandingkan dengan
molekul yang sederhana struktur ruangnya.
Molekul bergerak memiliki energi kinetik.
Semakin cepat geraknya, semakin besar
energi kinetik yang diubah menjadi vibrasi.
Jika energi kinetik besar, maka tumbukan
akan bergetar kuat memutuskan ikatan
kimia.
Terbentuknya hasil reaksi (produk) diawali
dengan putusnya ikatan.
Tumbukan efektif terjadi jika tumbukan
memiliki energi lebih besar atau sama
dengan Ea.
Teori tumbukan dan Ea sangat bermanfaat untuk
menjelaskan faktor-faktor yang mempengaruhi
laju reaksi.
Dengan menaikkan harga energi kinetik molekul
atau menurunkan harga Ea-nya, laju reaksi kimia
dapat dipercepat.
Ea dengan menggunakan katalis akan lebih kecil
jika dibandingkan dengan tanpa menggunakan
katalis.
Semakin kecil nilai Ea, maka reaksi akan lebih
mudah terjadi.
Oleh karena itu, reaksi dengan menggunakan
katalis akan semakin cepat menghasilkan zat hasil
reaksi (laju reaksinya semakin cepat).
Dalam suatu reaksi, katalis tidak mengalami
perubahan kimia (tidak ikut bereaksi) tetapi
dimungkinkan terjadi perubahan fisik katalis.
Terdapat banyak reaksi yang memerlukan
katalis, tetapi jumlahnya relatif sedikit.
Katalis bermanfaat untuk menurunkan Ea suatu
reaksi dan meningkatkan laju reaksi.
Katalis bekerja dengan meningkatkan frekuensi
tumbukan antar reaktan, mengubah arah
tumbukan reaktan sehingg memperbanyak
jumlah tumbukan efektif, menurunkan ikatan
intermolekuler antara molekul reaktan atau
mendonorkan densitas elektron kepada reaktan.
Katalis membantu reaksi untuk berlangsung
lebih cepat menuju arah kesetimbangan.
Ketika reaksi sedang berlangsung akan
terbentuk zat kompleks teraktivasi dan
letaknya berada pada puncak energi.
Jika reaksi dapat terjadi, maka penguraian
zat kompleks teraktivasi akan memberikan
zat hasil reaksi (produk).
Hubungan antara energi pengaktifan dengan
energi yang dilepaskan atau diserap selama
berlangsungnya reaksi ditunjukkan padagambar
berikut ini:
Laju reaksi dinyatakan sebagai besarnya
perubahan konsentrasi hasil reaksi atau reaktan
dalam satuan waktu, atau dapat dinyatakan
sebagai pertambahan konsentrasi molar salah
satu produk tiap satuan waktu atau laju
pengurangan konsentrasi molar salah satu
pereaksi. (Dogra, 2008)
Pada beberapa kasus, semakin besar konsentrasi
reaktan tidak selalu mempercepat reaksi atau
tidak sebanding dengan peningkatan laju
reaksinya akibat semakin besarnya konsentrasi.
Atas dasar teori tumbukan, adanya energi yang
cukup dari suatu tumbukan akan menghasilkan
suatu reaksi.
Disamping adanya energi yang cukup, jumlah
tumbukan juga berpengaruh. Jika tumbukan
antara partikel yang berhasil lebih banyak maka
akan lebih cepat laju reaksinya.
Kinetika kimia ditinjau dari segi teori tumbukan,
dapat kita perkirakan laju reaksi akan berbanding
lurus dengan banyaknya tumbukan molekul tiap
detik atau berbanding lurus dengan frekuensi
tumbukan molekul.
Gambar di atas menunjukkan, terdapat
perbedaan ukuran besarnya lubang untuk
aliran kedua botol.
Pada percobaan tersebut terlihat bahwa laju
dapat ditentukan dengan 2 cara; mengukur
volume air yang bertambah dari botol tiap
satuan waktu dan volume air yang berkurang
pada gelas kimia tiap satuan waktu.
Dari gambaran sebelumnya, maka untuk mennetukan
laju reaksi dapat ditentukan dengan 2 cara :
1. Jumlah reaktan yang bereaksi atau digunakan tiap
satuan waktu
2. Jumlah hasil reaksi yang diperoleh tiap satuan
waktu.
Sebagai contoh reaksi antara logam magnesium
dengan asam klorida dengan persamaan reaksi:
Mg(s) + 2 HCl(aq) ® MgCl2(aq) + H2(g)
Laju reaksi dapat ditentukan dengan mengukur
jumlah magnesium atau asam klorida yang digunakan
pada satuan waktu tertentu atau jumlah gas hidrogen
atau magnesium klorida yang terbentuk pada satu
satuan waktu.
Anda mungkin juga menyukai
- Teori Tumbukan Dan Teori Pembentukan Keadaan TransisiDokumen23 halamanTeori Tumbukan Dan Teori Pembentukan Keadaan TransisiNadiratul KhairahBelum ada peringkat
- Teori Tumbukan Dan Teori Pembentukan Keadaan TransisiDokumen22 halamanTeori Tumbukan Dan Teori Pembentukan Keadaan TransisiNadiratul KhairahBelum ada peringkat
- Gambar 5: Tumbukan Yang Efektif Terjadi Bila Atom K: Bertumbukan Dengan Atom I, Karena Ukuran Atomnya SamaDokumen9 halamanGambar 5: Tumbukan Yang Efektif Terjadi Bila Atom K: Bertumbukan Dengan Atom I, Karena Ukuran Atomnya SamaAyu Sartika Koesuma NingrasBelum ada peringkat
- Laju ReaksiDokumen15 halamanLaju ReaksiVina AnggrainiBelum ada peringkat
- KinetikaDokumen23 halamanKinetikaFbfbcn DjfjBelum ada peringkat
- Kinetika-2Dokumen28 halamanKinetika-2Fbfbcn DjfjBelum ada peringkat
- FisikaDokumen4 halamanFisikaSatnis PutriBelum ada peringkat
- Energi AktivsiDokumen8 halamanEnergi AktivsiAknasasia Virginia KrisantiBelum ada peringkat
- Bahan Ajar Aksi 1Dokumen9 halamanBahan Ajar Aksi 1Hari BowoBelum ada peringkat
- PERCOBAAN IV Pengaruh Kosentrasi Dan Temperatur Terhadap Laju ReaksiDokumen20 halamanPERCOBAAN IV Pengaruh Kosentrasi Dan Temperatur Terhadap Laju ReaksiNita Anggraeni100% (1)
- Kelas XI KD 3.6 (013 Dan 039)Dokumen7 halamanKelas XI KD 3.6 (013 Dan 039)SariBelum ada peringkat
- Laju Reaksi Dan PembahasannyaDokumen16 halamanLaju Reaksi Dan PembahasannyaNurul Aini NazlaBelum ada peringkat
- (Composed) Laju ReaksiDokumen7 halaman(Composed) Laju ReaksiAprian Rudina SukmaBelum ada peringkat
- Kinetika KimiaDokumen8 halamanKinetika Kimiananda chaerunnisa kusnadiBelum ada peringkat
- Pekan 7 - Teknik Reaksi Kimia 1 - Pengaruh Tumbukan Terhadap Kecepatan Reaksi PDFDokumen21 halamanPekan 7 - Teknik Reaksi Kimia 1 - Pengaruh Tumbukan Terhadap Kecepatan Reaksi PDFHafis DalimBelum ada peringkat
- Teori TumbukanDokumen5 halamanTeori TumbukanAris TarchusBelum ada peringkat
- Laju ReaksiDokumen2 halamanLaju ReaksiAkhior Nugraha PamurdawanBelum ada peringkat
- Bab Ii & DapusDokumen10 halamanBab Ii & DapusVika MelindaBelum ada peringkat
- TRK 1901093 Azza ZemiaDokumen3 halamanTRK 1901093 Azza ZemiaZemia SurbaktiBelum ada peringkat
- Pembahasan Kecepatan ReaksiDokumen4 halamanPembahasan Kecepatan ReaksifebriBelum ada peringkat
- Jelaskan Hal-Hal Yang Dapat Berpengaruh Terhadap Laju Reaksi, Penjelasannya Sebaiknya Dikaitkan Dengan Contoh-ContohDokumen10 halamanJelaskan Hal-Hal Yang Dapat Berpengaruh Terhadap Laju Reaksi, Penjelasannya Sebaiknya Dikaitkan Dengan Contoh-ContohRomarisna Fransiska SimalangoBelum ada peringkat
- Teori TumbukanDokumen2 halamanTeori TumbukanNurul MaulidaBelum ada peringkat
- Pengaruh Suhu Terhadap Laju ReaksiDokumen2 halamanPengaruh Suhu Terhadap Laju ReaksiHilya Nurul AmaliaBelum ada peringkat
- KimiaDokumen11 halamanKimiafransBelum ada peringkat
- Penentuan Energi Pengaktifan Reaksi IonikDokumen5 halamanPenentuan Energi Pengaktifan Reaksi IoniknandaBelum ada peringkat
- Teori Tumbukan Dan Energi AktivasiDokumen10 halamanTeori Tumbukan Dan Energi AktivasiHidayatur RahmanBelum ada peringkat
- Teori Tumbukan Kimia Kelompok 4Dokumen13 halamanTeori Tumbukan Kimia Kelompok 4Rinjaya TeguhBelum ada peringkat
- Laporan Arrhenius NilaDokumen21 halamanLaporan Arrhenius NilaPutri AzzahraBelum ada peringkat
- Soal Teori TumbukanDokumen4 halamanSoal Teori Tumbukanfahmik11Belum ada peringkat
- Pertanyaan Dan Jawaban Diskusi Presentasi Kelompok 4Dokumen6 halamanPertanyaan Dan Jawaban Diskusi Presentasi Kelompok 4Nadiratul KhairahBelum ada peringkat
- Laju Reaksi Dan PembahasannyaDokumen43 halamanLaju Reaksi Dan PembahasannyayusnitaBelum ada peringkat
- Teori TumbukanDokumen8 halamanTeori TumbukanIka ParamithaBelum ada peringkat
- Teori TumbukanDokumen10 halamanTeori TumbukanriefahBelum ada peringkat
- Teori TumbukanDokumen5 halamanTeori TumbukanHamidah Hannum NasutionBelum ada peringkat
- Pengaruh Konsentrasi Dan Suhu Terhadap Laju ReaksiDokumen5 halamanPengaruh Konsentrasi Dan Suhu Terhadap Laju ReaksiMegha HermanBelum ada peringkat
- Teori TumbukanDokumen4 halamanTeori TumbukanEls ManuBelum ada peringkat
- Kinetika ReaksiDokumen14 halamanKinetika ReaksiyunitaBelum ada peringkat
- LKS Laju Reaksi 2Dokumen11 halamanLKS Laju Reaksi 2May Darma SyariiBelum ada peringkat
- Kinetika 4-Teori-Teori Reaksi KimiaDokumen14 halamanKinetika 4-Teori-Teori Reaksi KimiaIsman AgradávelBelum ada peringkat
- BAB II KinetikaDokumen13 halamanBAB II KinetikaPutri Elvira 1707113849Belum ada peringkat
- Kinetika RXDokumen17 halamanKinetika RXRizkirul Azzam MarkhozzamBelum ada peringkat
- Laporan Praktikum 1 1918 - 18.6Dokumen56 halamanLaporan Praktikum 1 1918 - 18.6rindiyani anggun lestariBelum ada peringkat
- Laju ReaksiDokumen10 halamanLaju ReaksiEjawantah PikiranBelum ada peringkat
- Teori TumbukanDokumen7 halamanTeori TumbukanPuput ElshirazyBelum ada peringkat
- 3.7 RPP Laju Reaksi (Faktor-Faktor)Dokumen48 halaman3.7 RPP Laju Reaksi (Faktor-Faktor)Kholida Handayani50% (2)
- Teori Tumbukan Pada Laju ReaksiDokumen11 halamanTeori Tumbukan Pada Laju ReaksiAlfa Jr.Belum ada peringkat
- Persamaan ARHENIUSDokumen16 halamanPersamaan ARHENIUSIrvan AbdillahBelum ada peringkat
- Percobaan 1 Faktor Laju ReaksiDokumen36 halamanPercobaan 1 Faktor Laju ReaksiSisilia Fil JannatiBelum ada peringkat
- Laju Reaksi FixDokumen27 halamanLaju Reaksi FixWini Rizky GustianiBelum ada peringkat
- Bahan Ajar Laju Reaksi - 1Dokumen8 halamanBahan Ajar Laju Reaksi - 1Tabrani TabraniBelum ada peringkat
- Kinetika ReaksiDokumen7 halamanKinetika ReaksiRonna PuspitaBelum ada peringkat
- Laju Reaksi FullDokumen21 halamanLaju Reaksi FullIchsan BalistikBelum ada peringkat
- Bahan Ajar LAJU REAKSI Ringkasan 22Dokumen11 halamanBahan Ajar LAJU REAKSI Ringkasan 22charlene alysaBelum ada peringkat
- Unit 2Dokumen5 halamanUnit 2Putri AzzahraBelum ada peringkat
- ARRHENIUSDokumen10 halamanARRHENIUSSitti Alwiyah maulani desiBelum ada peringkat
- LKPD Laju ReaksiDokumen5 halamanLKPD Laju ReaksiRahma LindaBelum ada peringkat
- Kinetika SaponifikasiDokumen17 halamanKinetika SaponifikasiAriffahNuurUswatunHasanah100% (1)
- Teknik Evaluasi Bioaktivita: Program Studi S1 Sekolah Tinggi Ilmu Farmasi Riau Yayasan Univ Riau September 2021Dokumen80 halamanTeknik Evaluasi Bioaktivita: Program Studi S1 Sekolah Tinggi Ilmu Farmasi Riau Yayasan Univ Riau September 2021Nur HirdayantiBelum ada peringkat
- Parameter FarmakokinetikaDokumen14 halamanParameter FarmakokinetikaNur HirdayantiBelum ada peringkat
- FarmakokinetikaDokumen8 halamanFarmakokinetikaNur HirdayantiBelum ada peringkat
- Jaminan KualitasDokumen33 halamanJaminan KualitasNur HirdayantiBelum ada peringkat