0% menganggap dokumen ini bermanfaat (0 suara)
228 tayangan8 halamanLaju Reaksi Kimia: Faktor & Teori
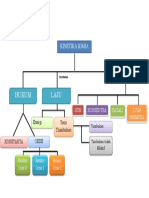
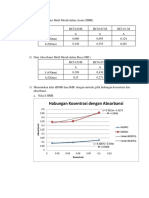
Dokumen tersebut membahas tentang laju reaksi kimia dan faktor-faktor yang mempengaruhinya. Faktor-faktor tersebut antara lain suhu, luas permukaan, konsentrasi, dan penambahan katalis. Laju reaksi dipengaruhi oleh energi aktivasi dan teori tumbukan antar partikel zat yang bereaksi.
Diunggah oleh
Bali32Gede Wisnu Ambara PutraHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online di Scribd
0% menganggap dokumen ini bermanfaat (0 suara)
228 tayangan8 halamanLaju Reaksi Kimia: Faktor & Teori
Dokumen tersebut membahas tentang laju reaksi kimia dan faktor-faktor yang mempengaruhinya. Faktor-faktor tersebut antara lain suhu, luas permukaan, konsentrasi, dan penambahan katalis. Laju reaksi dipengaruhi oleh energi aktivasi dan teori tumbukan antar partikel zat yang bereaksi.
Diunggah oleh
Bali32Gede Wisnu Ambara PutraHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online di Scribd