Struktur Atom
Diunggah oleh
Orin Je Ravi0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
10 tayangan3 halamanTeori atom berkembang dari gagasan Demokritus bahwa materi terdiri dari partikel yang tidak terbagi (atom) hingga model atom modern yang menjelaskan struktur inti dan elektron. John Dalton memperkenalkan konsep atom sebagai partikel yang tidak dapat dihancurkan, sedangkan J.J. Thomson menemukan elektron. Model Rutherford menyatakan inti bermuatan positif di tengah atom. Teori Bohr menjelaskan elektron berada pada orbit tertentu
Deskripsi Asli:
Judul Asli
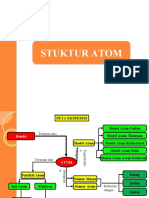
1. Struktur Atom
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniTeori atom berkembang dari gagasan Demokritus bahwa materi terdiri dari partikel yang tidak terbagi (atom) hingga model atom modern yang menjelaskan struktur inti dan elektron. John Dalton memperkenalkan konsep atom sebagai partikel yang tidak dapat dihancurkan, sedangkan J.J. Thomson menemukan elektron. Model Rutherford menyatakan inti bermuatan positif di tengah atom. Teori Bohr menjelaskan elektron berada pada orbit tertentu
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
10 tayangan3 halamanStruktur Atom
Diunggah oleh
Orin Je RaviTeori atom berkembang dari gagasan Demokritus bahwa materi terdiri dari partikel yang tidak terbagi (atom) hingga model atom modern yang menjelaskan struktur inti dan elektron. John Dalton memperkenalkan konsep atom sebagai partikel yang tidak dapat dihancurkan, sedangkan J.J. Thomson menemukan elektron. Model Rutherford menyatakan inti bermuatan positif di tengah atom. Teori Bohr menjelaskan elektron berada pada orbit tertentu
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 3
STRUKTUR ATOM Kelemahan:
Tidak dapat menjelaskan sifat listrik materi
A. Perkembangan Teori Atom Tidak dapat menjelaskan cara atom saling berikatan
B. Partikel Penyusun Atom Tidak dapat menjelaskan perbedaan antara satu
C. Nomor Atom dan Nomor Massa atom dengan atom lain
D. Bilangan Kuantum 3. J. J. Thomson
E. Konfigurasi Elektron Menemukan elektron yang bermuatan negatif dari Sebagian besar massa atom terpusat di tengah,
percobaan tabung sinar katoda disebut inti atom yang bermuatan positif
A. Perkembangan Teori Atom Sebagian besar atom merupakan ruang kosong
1. Demokritus dan Aristoteles
Demokritus dan beberapa filsuf lainnya
mengungkapkan bahwa materi terbentuk dari
partikel yang tidak dapat dibagi lagi, yang disebut
atom (a = tidak, tomos = terbagi)
Plato dan Aristoteles berpendapat tidak ada yang
Atom berbentuk seperti bola bermuatan positif yang Kelemahan:
tidak bisa dibagi
di dalamnya tersebar elektron secara merata Tidak dapat menjelaskan mengapa elektron tidak
Kelemahan:
(seperti roti kismis) jatuh ke dalam inti atom
Belum menjelaskan atom secara mendetail karena
belum melalui percobaan Tidak dapat menjelaskan spektrum garis pada atom
2. John Dalton hidrogen
Penemuan inti atom:
Materi terdiri atas partikel terkecil yang disebut
atom Eugen Goldstein melakukan percobaan tabung sinar
Atom penyusun unsur bersifat identik katoda, dan menemukan sinar anoda yang
bermuatan positif yang disebut proton
Atom suatu unsur tidak dapat diubah menjadi atom Kelemahan:
James Chadwick menemukan neutron yang
unsur lain Tidak dapat menjelaskan susunan muatan positif
bermuatan netral, dari percobaan penembakan inti
Senyawa tersusun atas 2 atom atau lebih dengan dan negatif dalam bola atom tersebut
berilium dengan sinar α
perbandingan tetap dan tertentu 4. Ernest Rutheford
5. Niels Bohr
Pada reaksi kimia hanya terjadi penataulangan atom Percobaan penembakan lempeng emas tipis dengan
Atom terdiri atas inti atom yang bermuatan positif
yang bereaksi sinar α (inti helium yang bermuatan +)
(terdapat proton dan neutron) dan dikelilingi oleh
Sebagian besar diteruskan, ada yang dibelokkan,
elektron yang bergerak pada lintasan energi
ada yang dipantulkan
bola pejal tertentu (disebut juga kulit atom)
Pada keadaan normal, elektron menempati tingkat
energi terendah
Elektron dapat berpindah dari tingkat energi rendah C. Nomor Atom dan Nomor Massa Isoelektronik = jumlah elektron sama
(ground state/dasar) ke tingkat energi yang lebih Nomor atom menyatakan jumlah proton dalam suatu 23 + 19 -
11Na dan 9F
tinggi (excited state/eksitasi) jika menyerap energi, atom, sedangkan nomor massa menyatakan jumlah
dan sebaliknya proton dan neutron dalam suatu atom D. Bilangan Kuantum
1. Notasi Atom Menunjukkan letak elektron pada suatu atom
A = nomor massa berdasarkan model mekanika kuantum.
A Z = nomor atom 1. Bilangan Kuantum Utama (n)
X
Z Jika atom netral, maka jumlah proton Menunjukkan nomor kulit dalam atom
Kelemahan: = elektron n = 1, 2, 3, 4 dst.... atau K, L, M, N, dst....
Hanya dapat menjelas spektrum atom hidrogen, Contoh: 2. Bilangan Kuantum Azimuth (l)
tidak dapat menjelaskan spektrum atom dengan proton = 12 Menunjukkan jenis subkulit dan bentuk orbital.
24
elektron banyak 12 Mg elektron = 12 Masing-masing orbital dapat diisi 2 elektron
subkulit s l = 0, memiliki 1 orbital
6. Teori Atom Modern neutron = 24 – 12 = 12
Hipotesis dualisme partikel-gelombang Louis de 2. Ion subkulit p l = 1, memiliki 3 orbital
Broglie. Jika cahaya memiliki sifat partikel, maka Ion adalah partikel yang bermuatan, disebabkan subkulit d l = 2, memiliki 5 orbital
partikel juga memiliki sifat seperti gelombang karena adanya penangkapan/pelepasan sejumlah subkulit f l = 3, memiliki 7 orbital
Asas ketidakpastian Heisenberg. Keterbatasan elektron dalam suatu atom. dst
dalam menentukan posisi elektron dalam atom Kation (ion positif) melepas elektron
Teori Mekanika Kuantum: peluang untuk Contoh:
24
menentukan elektron pada setiap titik di sekitar inti 12Mg p = 12, n = 12, e = 12
24 2+
12Mg p = 12, n = 12, e = 10
Anion (ion negatif) menangkap elektron
Contoh:
32
16S p = 16, n = 16, e = 16
32 2-
16S p = 16, n = 16, e = 18
3. Isotop, Isoton, Isobar, Isoelektronik
Isotop = jumlah proton sama, namun nomor massa 3. Bilangan Kuantum Magnetik (m)
beda Menunjukkan nomor orbital. Nilainya dari –l sampai
B. Partikel Penyusun Atom
Muatan Massa
12
6C dan 6C
13 +l
Partikel Lambang Penemu
Relatif Relatif Isoton = jumlah neutron sama s=
Elektron E -1 0 J. J. Thomson 13 14 0
6C dan 7N
Proton P +1 1 E. Goldstein p=
Isobar = nomor massa sama
Neutron N 0 1 J. Chadwick 14 14
-1 0 1
6C dan 7N
Contoh: Konfigurasi elektron dapat disingkat dengan bantuan
d= 11Na = 2)8)1 konfigurasi gas mulia, acuannya adalah nomor
-2 -1 0 1 2 11Na + = 2)8 atomnya.
f= 17Cl = 2)8)7 Nomor atom He = 2
-3 -2 -1 0 1 2 3 17Cl— = 2)8)8 Nomor atom Ne = 10
4. Bilangan Kuantum Spin (s)
Nomor atom Ar = 18
Menunjukkan arah putaran elektron 2. Konfigurasi Elektron Mekanika Kuantum Nomor atom Kr = 36
↑, s = +1/2, arah rotasi searah jarum jam Distribusi elektron dalam orbital pada suatu atom, Nomor atom Xe = 54
↓, s = -1/2, arah rotasi berlawanan jarum jam sesuai dengan beberapa aturan. Nomor atom Rn = 86
Asas Aufbau Contoh:
E. Konfigurasi Elektron Pengisian elektron berdasarkan urutan tingkatan 26Fe = 1s2 2s2 2p6 3s2 3p6 4s2 3d6
1. Konfigurasi Elektron Bohr energi = [Ar] 4s2 3d6
Distribusi elektron dalam kulit atom sesuai dengan
tingkat energi/kulitnya
Konfigurasi Ion:
Dimulai dari kulit yang paling dekat dengan inti
Awal disusun berdasarkan keadaan dasar
(kulit K)
Jika ion positif, elektron dilepas dari kulit terluar
Jumlah maksimum elektron pada kulit tertentu = 2
sesuai muatannya
x n2, di mana n adalah nomor kulitnya
Jika ion negatif, elektron ditambahkan ke kulit
- Kulit-1 (K) = 2
Urutan: 1s 2s 2p 3s 3p 4s 3d 4p dst.... terluar sesuai muatannya
- Kulit-2 (L) = 8
Aturan Hund Contoh:
- Kulit-3 (M) = 18
- Kulit-4 (N) = 32 Pengisian satu persatu elektron pada setiap orbital. Kation: 26Fe = [Ar] 4s2 3d6
Pada kondisi tertentu (subkulit d), orbital penuh dan 26Fe2+ = [Ar] 3d6
dst
setengah penuh lebih stabil Anion: 17Cl = [Ne] 3s2 3p5
Jumlah maksimum elektron pada kulit terluar
Contoh: 17Cl— = [Ne] 3s2 3p6
adalah 8
Hanya berlaku untuk unsur golongan A Jika konfigurasi terakhir 4s2 3d4, maka lebih stabil
Contoh: jika 4s1 3d5
16S = 2)8)6
Jika konfigurasi terakhir 4s2 3d9, maka lebih stabil
54Xe = 2)8)18)18)8
jika 4s1 3d10
Jika membentuk ion, elektron dilepas atau Larangan Pauli
ditambahkan pada kulit terluar Tidak boleh ada elektron yang memiliki 4 bilangan
kuantum yang sama (max 3). Bilangan kuantum yang
diizinkan:
n>l
m = -l s.d. +l
Anda mungkin juga menyukai
- Tugaskimia 2Dokumen4 halamanTugaskimia 2Tesya TesyaBelum ada peringkat
- Soal & Pembahasan Struktur Atom & Sistem Periodik UnsurDokumen20 halamanSoal & Pembahasan Struktur Atom & Sistem Periodik UnsurCristy SusiBelum ada peringkat
- Struktur AtomDokumen3 halamanStruktur AtomHana SummerBelum ada peringkat
- PPT Kimia XDokumen57 halamanPPT Kimia XErlita RatnasariBelum ada peringkat
- Struktur Atom 1Dokumen30 halamanStruktur Atom 1Nanda AnnisaBelum ada peringkat
- 3 Model Atom RutherfordDokumen22 halaman3 Model Atom RutherfordPaimanBelum ada peringkat
- Bab 2 - Struktur Atom Dan Sistem Periodik EditDokumen58 halamanBab 2 - Struktur Atom Dan Sistem Periodik EditPutri LangitanBelum ada peringkat
- Kimia Bab 2Dokumen35 halamanKimia Bab 2Rahmadan NorBelum ada peringkat
- Struktur AtomDokumen35 halamanStruktur AtomBima Sakti Surya PermanaBelum ada peringkat
- Struktur Atom & Sistem Periodik Unsur-2018Dokumen20 halamanStruktur Atom & Sistem Periodik Unsur-2018Yetri ElisyaBelum ada peringkat
- Struktur Atom Pertemua IIDokumen57 halamanStruktur Atom Pertemua IIMiranda WaodeBelum ada peringkat
- Struktur AtomDokumen42 halamanStruktur Atomkiki edryaniBelum ada peringkat
- BAB I Modul KimiaDokumen45 halamanBAB I Modul Kimiatuti maryaniBelum ada peringkat
- Struktur AtomDokumen26 halamanStruktur AtomSyahla Az-ZahraBelum ada peringkat
- Partikel Penyusun AtomDokumen14 halamanPartikel Penyusun AtomSemy Lewedalu100% (1)
- Bab Sistem Periodik UnsurDokumen57 halamanBab Sistem Periodik UnsurAbedBelum ada peringkat
- Struktur AtomDokumen69 halamanStruktur AtomPutraBelum ada peringkat
- Bab 2 - Struktur Atom Dan Sistem PeriodikDokumen58 halamanBab 2 - Struktur Atom Dan Sistem PeriodikFicky Fajar100% (1)
- Struktur Atom Karangturi SMA KarangturiDokumen41 halamanStruktur Atom Karangturi SMA KarangturiFIENGKY PRIYO SETIYONO,S.TBelum ada peringkat
- Struktur AtomDokumen32 halamanStruktur AtomRisyda Qudsia 32Belum ada peringkat
- Struktur AtomDokumen69 halamanStruktur Atomcahyo arionoBelum ada peringkat
- Kimia BAB 2Dokumen33 halamanKimia BAB 2ausatdillaBelum ada peringkat
- Rangkuman Kimia SMADokumen18 halamanRangkuman Kimia SMAyayaBelum ada peringkat
- Modul Struktur AtomDokumen47 halamanModul Struktur AtomvegavergiagaraBelum ada peringkat
- Ufi 21Dokumen69 halamanUfi 21Ufi DamayantiBelum ada peringkat
- Nama Teori AtomDokumen3 halamanNama Teori Atomsutantyo100% (10)
- Fisika IntiDokumen10 halamanFisika IntiIsrawatiBelum ada peringkat
- BAB 2. Struktur Atom Dan SPU (Materi Struktur Atom)Dokumen8 halamanBAB 2. Struktur Atom Dan SPU (Materi Struktur Atom)Evlin Suzanna PakpahanBelum ada peringkat
- Kimia Bab 2Dokumen3 halamanKimia Bab 2Reyna RenataBelum ada peringkat
- Partikel Dan Teori AtomDokumen21 halamanPartikel Dan Teori AtomHaechiBelum ada peringkat
- LK 0.1 - Modul 1 - Profesional - Sri HandiniDokumen5 halamanLK 0.1 - Modul 1 - Profesional - Sri HandiniSri HandiniBelum ada peringkat
- Ufi 2Dokumen68 halamanUfi 2Ufi DamayantiBelum ada peringkat
- Bab 2Dokumen35 halamanBab 2leorima 8720Belum ada peringkat
- Perkembangan Teori AtomDokumen2 halamanPerkembangan Teori AtomArbiWidiyantoroBelum ada peringkat
- STRUKTUR ATOM - Renata Sheehan (Xii Mipa 1)Dokumen28 halamanSTRUKTUR ATOM - Renata Sheehan (Xii Mipa 1)renaBelum ada peringkat
- Fisika Atom Dan Fisika Inti NewDokumen57 halamanFisika Atom Dan Fisika Inti Newdiahai.wikromoBelum ada peringkat
- BAB 2-Kimia MADokumen16 halamanBAB 2-Kimia MAnatasyadian300Belum ada peringkat
- Kimia OrganikkDokumen97 halamanKimia OrganikkArindita Audi MarettaBelum ada peringkat
- Hakikat Dan Peran Ilmu KimiaDokumen60 halamanHakikat Dan Peran Ilmu KimiaSih TitaniaBelum ada peringkat
- Struktur Atom Dan Sistem Periodik UnsurDokumen18 halamanStruktur Atom Dan Sistem Periodik UnsurRina AgustiniBelum ada peringkat
- Kimia Dasar Pertemuan 2 (Struktur Atom)Dokumen20 halamanKimia Dasar Pertemuan 2 (Struktur Atom)Muh PriawibawaBelum ada peringkat
- 2-Model Atom - 2Dokumen13 halaman2-Model Atom - 2AzhariBelum ada peringkat
- Struktur Atom Dan Sistem PeriodikDokumen65 halamanStruktur Atom Dan Sistem PeriodikAhmad FaizilBelum ada peringkat
- Power Point Bab 2 Struktur Atom Dan SistDokumen56 halamanPower Point Bab 2 Struktur Atom Dan SistRomen PurbaBelum ada peringkat
- LK 1 Modul 1 ProfesionalDokumen7 halamanLK 1 Modul 1 ProfesionalDian Ubaedillah NuraeniBelum ada peringkat
- Struktur AtomDokumen3 halamanStruktur Atomrizkha sman1dlingoBelum ada peringkat
- Struktur AtomDokumen3 halamanStruktur AtomLdred Dyllian TanBelum ada peringkat
- Materi Pengenalan Ilmu Kimia Dan Perkembangan Teori AtomDokumen31 halamanMateri Pengenalan Ilmu Kimia Dan Perkembangan Teori AtomTrisda MilaBelum ada peringkat
- Bab 2 Struktur Atom Dan Spu (Ipa Kimia X Kurmer)Dokumen14 halamanBab 2 Struktur Atom Dan Spu (Ipa Kimia X Kurmer)Atariq WalidBelum ada peringkat
- Struktur AtomDokumen10 halamanStruktur AtomHizkia HolongBelum ada peringkat
- Hizkia YogatamaDokumen10 halamanHizkia YogatamaDenny MaulanaBelum ada peringkat
- BAB 2 Struktur AtomDokumen11 halamanBAB 2 Struktur AtomAfifah S NBelum ada peringkat
- Bab 2 Struktur Atom Dan Sistem Periodik BohrDokumen31 halamanBab 2 Struktur Atom Dan Sistem Periodik BohrAcha SilmyBelum ada peringkat
- Power Point Bab 2 Struktur Atom Dan SistDokumen56 halamanPower Point Bab 2 Struktur Atom Dan Sistachmad tamimiBelum ada peringkat
- HahahaDokumen14 halamanHahahaMuh WalwalddinBelum ada peringkat
- Struktur AtomDokumen4 halamanStruktur AtomyusBelum ada peringkat
- Materi 1 Hakikat Ilmu KimiaDokumen2 halamanMateri 1 Hakikat Ilmu KimiaOrin Je RaviBelum ada peringkat
- Fungsi EksponenDokumen5 halamanFungsi EksponenOrin Je RaviBelum ada peringkat
- Ikatan KimiaDokumen3 halamanIkatan KimiaOrin Je RaviBelum ada peringkat
- Sistem Periodik UnsurDokumen2 halamanSistem Periodik UnsurOrin Je RaviBelum ada peringkat