Ika Nila - Diskusi3 Kimia Dasar PDF
Diunggah oleh
Ika Nila0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
5 tayangan2 halamanJudul Asli
Ika Nila _Diskusi3 Kimia Dasar.pdf
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
5 tayangan2 halamanIka Nila - Diskusi3 Kimia Dasar PDF
Diunggah oleh
Ika NilaHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
Nama : Ika Nila Astuti
NIM : 049634243
Jawaban Diskusi 3
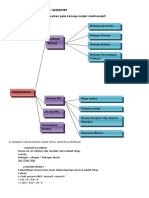
1. Gambarkan peta konsep materi stoikiometri!
STOIKIOMETRI
RUMUS SENYAWA REAKSI KIMIA & PERHITUNGAN STOIKIOMETRI
MASA ATOM RELATIF, MASA
BILANGAN OKSIDASI, PERHITUNGAN
HUKUM DASAR KIMIA MOLEKUL RELATIF, KONSEP RUMUS SENYAWA REAKSI KIMIA APLIKASI STOIKIOMETRI
KEMOLARAN & EKIVALEN PERHITUNGAN STOIKIOMETRI
MOL
1. Hukum Kekekalan Massa
2. Hukum Perbandingan Tetap 1. Bilangan Oksidasi
3. Hukum Kelipatan Perbandingan 2. Kemolaran
4. Hukum Pernyataan Volume 3. Ekivalen
2. Jelaskan hukum-hukum dasar kimia, beserta contohnya!
a. Hukum Kekelan Masa (Lavoiser, 1777)
“Pada setiap reaksi kimia, massa zat-zat yang bereaksi adalah sama dengan masa zat-zat hasil
reaksi” artinya dalam reaksi kimia, massa bersifat kekal. Contoh :
2H2 (g) + O2 (g) → 2H2O (l)
1 gr + 8 gr → 9 gr
b. Hukum Perbandingan Tetap (Proust)
Suatu senyawa murni selalu tersusun dari unsur-unsur yang tetap dengan perbandingan massa
yang tetap” Contoh: air mengandung perbandingan massa oksigen dan hidrogen selalu 1 : 8.
c. Hukum kelipatan Perbandingan
Jika dua senyawa yang berbeda dibentuk oleh dua unsur yang sama, maka bila massa salah
satu unsur dalam kedua senyawa sama maka unsur lainnya dalam kedua senyawa itu akan
mempunyai perbandingan masssa sebagai bilangan bulat dan sederhana.
Contoh :
Senyawa Massa Nitrogen Massa Oksigen
A 28 gr 32 gr
B 28 gr 64 gr
C 28 gr 80 gr
Jadi perbandingan massa oksigen untuk massa nitrogen yang sama masing masing senyawa
A,B dan C adalah 32 : 64 : 80 atau 2:5
d. Hukum Pernyataan Volume (Hukum Gay Lussac)
Pada tekanan dan suhu yang sama (P, T) perbandingan volume gas-gas pereaksi dan hasil
reaksi merupakan bilangan bulat dan sederhana.
e. Hukum pernyataan Volume (Hukum Avogadro)
Pada tekanan dan suhu yang sama (P,T) gas-gas yang bervolume sama mengandung jumlah
molekul yang sama. (V ~ n)
3. Jelaskan langkah-langkah penyetaraan reaksi kimia disertai contoh!
a. Menuliskan semua zat yang beraksi disebelah kiri hasil dan hasilnya di tulis disebelah kanan
dengan benar.
b. Setarakan koefisien reaksi dengan menuliskan koefisien reaksi untuk senyawa dengan jumlah
atom terbanyak tetapi bukan hydrogen, oksigen atau ion poliatomik.
c. Memperhatikan unsur yang hanya muncul satu kali setiap sisi, rumus yang mengandung
unsur pasti mempunyai koefisien yang sama.
d. Memeriksa kembali persamaan reaksi tersebut dan memastikan banyaknya atom pada tiap
unsur sama untuk pereaksi dan merupakan perbandingan terkecil koefisien.
Contoh :
Fe + O2 → FeO3
KCIO3 → KCl + O2 (Belum setara)
Mengalikan 2 pada untur KCL Sehingga
2 KClO3 → 2 KCl + 3O2
Sumber : BMP – Kimia Dasar
Anda mungkin juga menyukai
- Diskusi 3 Sesi 3Dokumen3 halamanDiskusi 3 Sesi 3awalBelum ada peringkat
- Diskusi3 - Kimia Dasar 1 - LINTANG SATITI (043060153)Dokumen4 halamanDiskusi3 - Kimia Dasar 1 - LINTANG SATITI (043060153)Lintang SatitiBelum ada peringkat
- MURID - KD.3.10 - Stoikiometri - Hukum-Hukum Dasar Kimia & Tugas 7Dokumen10 halamanMURID - KD.3.10 - Stoikiometri - Hukum-Hukum Dasar Kimia & Tugas 7Etnomat Kepulauan SeribuBelum ada peringkat
- STOIKIOMTERIDokumen19 halamanSTOIKIOMTERIAndyka RaihanBelum ada peringkat
- Diskusi Tugas 1Dokumen2 halamanDiskusi Tugas 1Hari AntoBelum ada peringkat
- Makalah Kimdas StoikiometriDokumen23 halamanMakalah Kimdas StoikiometriSeptian Setia GunansyahBelum ada peringkat
- BAB III Stoikiometri Reaksi - WWW - Kakakiky.idDokumen7 halamanBAB III Stoikiometri Reaksi - WWW - Kakakiky.idRahmad ArfandiBelum ada peringkat
- DASAR TEORI StokiometriDokumen7 halamanDASAR TEORI StokiometriAdi SagitariusBelum ada peringkat
- Laporan Praktikum Kimia Dasar2Dokumen15 halamanLaporan Praktikum Kimia Dasar2alskjdhhBelum ada peringkat
- Persamaan Kimia Dan StoikiometriDokumen18 halamanPersamaan Kimia Dan StoikiometriAndresilitonga silitongaBelum ada peringkat
- Makalah Kimia DasarDokumen9 halamanMakalah Kimia DasarJessy Nabil JacindaBelum ada peringkat
- MAKALAHDokumen21 halamanMAKALAHDermawan Jr0% (1)
- Makalah Kimdas StoikiometriDokumen20 halamanMakalah Kimdas Stoikiometrijanetbela014Belum ada peringkat
- Diskusi 3 Kimd4110Dokumen6 halamanDiskusi 3 Kimd4110NitaBelum ada peringkat
- Diskusi 3 Kimia Dasar (HARUN ASYAKIRI)Dokumen9 halamanDiskusi 3 Kimia Dasar (HARUN ASYAKIRI)HarunAsyakiriBelum ada peringkat
- Diskusi 3 Kimia Dasar 1Dokumen3 halamanDiskusi 3 Kimia Dasar 1Shefya AnBelum ada peringkat
- KIMIADokumen29 halamanKIMIANaswa KhoirunnisaBelum ada peringkat
- Diskusi 3 Kimia DasarDokumen5 halamanDiskusi 3 Kimia Dasarlailatul fitriyahBelum ada peringkat
- Makalah StoikiometriDokumen14 halamanMakalah StoikiometriIrma IYBelum ada peringkat
- Laporan Kimia Dasar I StoikiometriDokumen16 halamanLaporan Kimia Dasar I StoikiometriAshila Defa RahmaniBelum ada peringkat
- STOKIOMETRIDokumen9 halamanSTOKIOMETRIJerny ManaluBelum ada peringkat
- Tugas PPT KimiaDokumen15 halamanTugas PPT Kimiamuhammadayubpermana7Belum ada peringkat
- Laporan Stoikio LengkapDokumen16 halamanLaporan Stoikio LengkapZulfindira Septri Ruudevi0% (1)
- StoikiometriDokumen3 halamanStoikiometrisyarovinaBelum ada peringkat
- Modul VDokumen29 halamanModul VShinta RazakBelum ada peringkat
- Analisis Jurnal StokiometriDokumen14 halamanAnalisis Jurnal StokiometrikurniawanBelum ada peringkat
- Hukum Dasar KimiaDokumen16 halamanHukum Dasar KimiaDarul FiqriBelum ada peringkat
- RPP Konsep MolDokumen21 halamanRPP Konsep MolUlfa Kirana UplaBelum ada peringkat
- StoikiometriDokumen10 halamanStoikiometriJekiBelum ada peringkat
- Makalah Stoikiometri OlehDokumen20 halamanMakalah Stoikiometri OlehMuhammad HarsyaBelum ada peringkat
- RPP Konsep MolDokumen21 halamanRPP Konsep Molardi kurniaBelum ada peringkat
- Makalah Kimia Dasar Stoikiometri-2Dokumen19 halamanMakalah Kimia Dasar Stoikiometri-2Desi AstiyasariBelum ada peringkat
- 2 Presentation2Dokumen36 halaman2 Presentation2RadenMas Fathul Umar PakuningratanBelum ada peringkat
- Acc Laprak Stoikiometri Kimdas Rahma Anggraeni Saing Betul Sekali Mi IniiiDokumen28 halamanAcc Laprak Stoikiometri Kimdas Rahma Anggraeni Saing Betul Sekali Mi IniiiIndo GameBelum ada peringkat
- Laporan Praktikum Kimia DasarDokumen23 halamanLaporan Praktikum Kimia DasaragillfitraBelum ada peringkat
- Dasar Teori StoikiometriDokumen5 halamanDasar Teori StoikiometriFitri Tutink RachmawatiBelum ada peringkat
- LaporanDokumen30 halamanLaporanLam Izat RamadhanBelum ada peringkat
- LKMDokumen10 halamanLKMWikrama PutraBelum ada peringkat
- RPP KD 3.10 HK DASAR KimiaDokumen9 halamanRPP KD 3.10 HK DASAR KimiaNurul HidayahBelum ada peringkat
- Jurnal StoikiometriDokumen30 halamanJurnal StoikiometriHanifah Hanun100% (1)
- Kata Pengantar KimiaDokumen16 halamanKata Pengantar KimiaCelana JeansBelum ada peringkat
- Hukum Dasar KimiaDokumen6 halamanHukum Dasar KimiaMoloponyBelum ada peringkat
- Hukum Dasar KimiaDokumen11 halamanHukum Dasar Kimiadolphinet patraBelum ada peringkat
- Hukum - Hukum Dasar KimiaDokumen6 halamanHukum - Hukum Dasar KimiaElsa MahardikaBelum ada peringkat
- Jurnal StoikiometriDokumen30 halamanJurnal Stoikiometriwahyuni teresia94% (16)
- Stoikiom Etri: Dosen Pengampu Kimia Fisika: Hermawan Dwi Aryanto, S.T.,M.SC.,PH.DDokumen14 halamanStoikiom Etri: Dosen Pengampu Kimia Fisika: Hermawan Dwi Aryanto, S.T.,M.SC.,PH.DTiiBelum ada peringkat
- Makalah Stoikiometri LengkapDokumen23 halamanMakalah Stoikiometri LengkapfarhanBelum ada peringkat
- Bab 1 Dan 2 StoiDokumen5 halamanBab 1 Dan 2 Stoi05Yudha PramudyaBelum ada peringkat
- StoikiometriDokumen39 halamanStoikiometriHidayati KardenaBelum ada peringkat
- Laporan Praktikum StoikiometriDokumen21 halamanLaporan Praktikum StoikiometriNajma AtiqaBelum ada peringkat
- Ringkasan StoikiometriDokumen4 halamanRingkasan StoikiometriGracella KolondamBelum ada peringkat
- Laporan Praktikum StoikiometriDokumen21 halamanLaporan Praktikum StoikiometriAswar0% (1)
- LAPORAN - 3 Stoikiometri NabilaDokumen17 halamanLAPORAN - 3 Stoikiometri NabilaNabila AngreaniBelum ada peringkat
- Laporan Praktikum Kimia Dasar I: StoikiometriDokumen40 halamanLaporan Praktikum Kimia Dasar I: StoikiometriIsmi Amaliya Magfira AchmadBelum ada peringkat
- Laporan Kimia Dasar I StoikiometriDokumen16 halamanLaporan Kimia Dasar I StoikiometriESTUARY100% (11)
- Bab 1 PendahuluanDokumen22 halamanBab 1 PendahuluanlitapratamaBelum ada peringkat