STOIKIOMETRI
Diunggah oleh
awalDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
STOIKIOMETRI
Diunggah oleh
awalHak Cipta:
Format Tersedia
TUGAS 1 SESI 3
Nama Mahasiswa : Awal Aminuddin
NIM : 044187647
Nama Mata Kuliah : Kimia Dasar I
Kode Mata Kuliah : KIMD4110
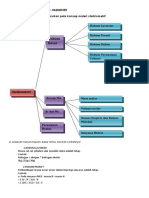
1. Gambarkan peta konsep materi stoikiometri
Ekivalen:
- Ekivalen asam basa
- Ekivalen redoks
Volume-Volume
Kemolaran:
Jumlah mol zat terlarut
dalam 1 liter larutan Massa-Volume
Bilangan Oksidasi:
Bilangan yang menyatakan Massa-Massa
satuan afinitas suatu unsur
APLIKASI STOIKIOMETRI SATUAN STOIKIOMETRI PERHITUNGAN STOIKIOMETRI
STOIKIOMETRI
REAKSI KIMIA ilmu yang menghitung hubungan kuantitatif
dari reaktan dan produk dalam reaksi kimia (Alfian, 2009:1)
HUKUM-HUKUM DASAR KIMIA KONSEP MOL RUMUS SENYAWA
perbandingan atom-atom
yang bersenyawa tepat sama
Hukum Kekekalan Massa dengan perbandingan mol Rumus Struktur Senyawa:
(Lavoiser,1777) atom yang bersenyawa menunjukkan bagaimana
Atom-atom membentuk molekul
Hukum Perbandingan Tetap
(Proust)
Rumus Molekul :
menunjukkan jumlah sebenarmya
Hukum Kelipatan Perbandingan Atom unsur yang terdapat
(Hukum Perbandingan Berganda) dalam molekul senyawa
Hukum Pernyataan Volume Rumus Empiris
Joseph Louis Gay Lussac (1808) menunjukkan perbandingan yang
Hukum Avogadro (1811) Sederhana dari atom-atom unsur
dalam senyawa
2. Jelaskan hukum-hukum dasar kimia, beserta contohnya!
Jawab:
a. Hukum Kekekalan massa (Lavoiser,1777)
Pada setiap reaksi kimia, massa zat-zat yang bereaksi adalah sama dengan massa zat-zat
hasil reaksi. Contoh:
- Reaksi pembentukan air (H2O) yang berasal dari reaksi H2 dan O2 :
2H2 (g) + O2(g)-> 2H2O
b. Hukum Perbandingan Tetap (Proust)
Suatu senyawa murni selalu terjadi atas unsur-unsur tertentu, yang bergabung dengan
perbandingan tertentu. Contoh:
- Senyawa air yang murni selalu terjadi atas unsur tertentu yaitu hydrogen dan
oksigen yang bergabung dengan perbandingan tertentu yaitu 11,19% buat
hydrogen dan 88,81% buat oksigen atau dengan perbandingan 1:8, perbandingan
ini selalu tetap, yaitu 1:8
c. Hukum Kelipatan Perbandingan
Apabila dua unsur dapat membentuk lebih dari satu senyawa, maka perbandingan massa
kedua unsur tersebut pada senyawa yang satu merupakan kelipatan dari perbandingan
kedua tersebut pada senyawa yang lain.
Contoh:
- Nitrogen dan Oksigen dapat membentuk 2 macam senyawaan dengan komposisi
sebagai berikut:
Perbandingan
Senyawa %berat Nitrogen : Perbandingan
%berat Oksigen
I 63,7 : 36,3 = 1,75 : 1
II 46,7 : 53,3 = 1,75 : 2
III 36,9 : 63,1 = 1,75 : 3
IV 30,5 : 69,5 = 1,75 : 4
V 25,9 : 74,1 = 1,75 : 5
Perbandingan massa oksigen yang bersenyawa dengan satu barisan nitrogen adalah:
0,57 : 1,14: 1,74: 2,28: 2,86 = 1:2:3:4:5, terlihat bahwa bilangannya bilangan yang mudah dan bulat,
sehingga hokum kelipatan perbandingan terpenuhi. Dengan demikian senyawaan antara nitrogen dan
oksigen yang dapat terbentuk adalah: N2O,NO,N2O3, dan N2O5
d. Hukum Pernyataan Volume.
Ada dua hokum yang menyatakan volume, yaitu:
- Hukum Gay Lussac
Volume-volume gas yang ikut serta dalam suatu reaksi kimia diukur pada
temperatur dan tekanan yang sama, berbanding sebagai bilangan yang mudah dan
bulat”. Hubungan volume yang sederhana antara gas bereaksi dan gas yang
dihasilkan menyatakan adanya hubungan sederhana antara volume gas dengan
jumlah molekul gas. Contoh:
Propan : Oksigen : Karbon dioksida = 40 : 200 : 120 : 160 = 1:5:3:4.
- Hukum avogrado
Pada kondisi temperature dan tekanan yang sama, volume yang sama berbagai
macam gas mempunyai jumlah molekul yang sama”. Pada temperatur dan tekanan
standar (STP,standart temperature pressure), volume suatu gas adalah 22,4L.
Contoh:
3. Tuliskan Langkah-langkah penyetaraan reaksi kimia
Jawab:
- Menuliskan semua zat yang bereaksi di sebelah kiri dan hasil reaksi di sebelah kanan
Al + H2SO4 → Al2(SO4)3 + H2 2)
- Menyetarakan koefisien reaksi dengan menuliskan koefisien reaksi untuk senyawa dengan
jumlah atom terbanyak 2 Al + H2SO4 → Al2(SO4)3 + H2 3)
- Setarakan atom S dengan menambahkan koefisien di depan
- H2SO4 2 Al + 3H2SO4 → Al2(SO4)3 + H2 4)
- Setarakan atom H 2 Al + 3H2SO4 → Al2(SO4)3 + 3H2 5)
- Periksa kembali persamaan reaksi pastikan banyaknya atom sama di kedua sisi Al :
Atom sebelah kiri 2, unsur sebelah kanan 2 SO4 :
Senyawa sebelah kiri 3, senyawa sebelah kanan 3 H :
Atom sebelah kiri 3 x 2 = 6, unsur sebelah kanan 3 x 2 = 6
Sehingga hasil penyetaraan koefisien reaksi menjadi 2 Al + 3H2SO4 → Al2(SO4)3 + 3H2
Sumber:
- BMP KIMD4110
- Inisiasi 3 “Stoikiometri”
Anda mungkin juga menyukai
- Makalah Kimdas StoikiometriDokumen20 halamanMakalah Kimdas Stoikiometrijanetbela014Belum ada peringkat
- STOIKIOMETRI REAKSI KIMIADokumen23 halamanSTOIKIOMETRI REAKSI KIMIASeptian Setia GunansyahBelum ada peringkat
- Diskusi 3 Kimia DasarDokumen5 halamanDiskusi 3 Kimia Dasarlailatul fitriyahBelum ada peringkat
- Tugas PPT KimiaDokumen15 halamanTugas PPT Kimiamuhammadayubpermana7Belum ada peringkat
- LKM StoikiometriDokumen10 halamanLKM StoikiometriWikrama PutraBelum ada peringkat
- Ika Nila - Diskusi3 Kimia Dasar PDFDokumen2 halamanIka Nila - Diskusi3 Kimia Dasar PDFIka NilaBelum ada peringkat
- Makalah Kimia Dasar Stoikiometri-2Dokumen19 halamanMakalah Kimia Dasar Stoikiometri-2Desi AstiyasariBelum ada peringkat
- Analisis Jurnal StokiometriDokumen14 halamanAnalisis Jurnal StokiometrikurniawanBelum ada peringkat
- STOIKIOMTERIDokumen19 halamanSTOIKIOMTERIAndyka RaihanBelum ada peringkat
- Michell KimiaDokumen14 halamanMichell KimiaプラタマBelum ada peringkat
- STOIKIOMETRI REAKSIDokumen7 halamanSTOIKIOMETRI REAKSIRahmad ArfandiBelum ada peringkat
- KIMIADokumen29 halamanKIMIANaswa KhoirunnisaBelum ada peringkat
- MAKALAHDokumen21 halamanMAKALAHDermawan Jr0% (1)
- Trans StoikiometriDokumen11 halamanTrans Stoikiometriainun_putriBelum ada peringkat
- KD 3.11 Kelas 10 KimiaDokumen6 halamanKD 3.11 Kelas 10 KimiaSintia NingsihBelum ada peringkat
- Diskusi 3 Kimia Dasar 1Dokumen3 halamanDiskusi 3 Kimia Dasar 1Shefya AnBelum ada peringkat
- Bab 4 - Hukum Dasar Dan Perhitungan Kimia (Ipa Kimia X Kurmer)Dokumen22 halamanBab 4 - Hukum Dasar Dan Perhitungan Kimia (Ipa Kimia X Kurmer)nellaBelum ada peringkat
- STOIKIOMETRI KIMIA DASARDokumen16 halamanSTOIKIOMETRI KIMIA DASARAshila Defa RahmaniBelum ada peringkat
- Capaian PembelajaranDokumen20 halamanCapaian PembelajaranyunitaBelum ada peringkat
- StoikiometriDokumen7 halamanStoikiometriMelita meicahyaniBelum ada peringkat
- Modul VDokumen29 halamanModul VShinta RazakBelum ada peringkat
- Hukum Dasar KimiaDokumen10 halamanHukum Dasar KimiaSyarifudin AmmarBelum ada peringkat
- MURID - KD.3.10 - Stoikiometri - Hukum-Hukum Dasar Kimia & Tugas 7Dokumen10 halamanMURID - KD.3.10 - Stoikiometri - Hukum-Hukum Dasar Kimia & Tugas 7Etnomat Kepulauan SeribuBelum ada peringkat
- STOIKIOMETRI DAN HUKUM KIMIA DASARDokumen22 halamanSTOIKIOMETRI DAN HUKUM KIMIA DASARDodik SetiawanBelum ada peringkat
- STOIKIOMETRIDokumen7 halamanSTOIKIOMETRIAdi SagitariusBelum ada peringkat
- Hukum Dasar-Dasar Kimia: Tugas Merangkum Armelia Dwi Putri (07) Xmipa4Dokumen13 halamanHukum Dasar-Dasar Kimia: Tugas Merangkum Armelia Dwi Putri (07) Xmipa4armeliaBelum ada peringkat
- Bab 4 Hukum Dasar KimiaDokumen22 halamanBab 4 Hukum Dasar Kimiaapanjin79707Belum ada peringkat
- 2. Stoikhiometri (1)Dokumen33 halaman2. Stoikhiometri (1)Wina Septia UtariBelum ada peringkat
- Rangkuman Bab Iv. M. Asyraf Mubarak. D131201018Dokumen2 halamanRangkuman Bab Iv. M. Asyraf Mubarak. D131201018Muhammad AsyrfBelum ada peringkat
- 6-7 Kimia StoikiometriDokumen14 halaman6-7 Kimia StoikiometriIzal MuriduBelum ada peringkat
- Laporan PraktikumDokumen13 halamanLaporan PraktikumtiaspramonoBelum ada peringkat
- 2 Presentation2Dokumen36 halaman2 Presentation2RadenMas Fathul Umar PakuningratanBelum ada peringkat
- Laporan Stoikio LengkapDokumen16 halamanLaporan Stoikio LengkapZulfindira Septri Ruudevi0% (1)
- Review Lengkap StoikiometriDokumen7 halamanReview Lengkap StoikiometrifaisalBelum ada peringkat
- StoikhiometriDokumen28 halamanStoikhiometriDicky Alawy RahmanBelum ada peringkat
- Jurnal StoikiometriDokumen30 halamanJurnal Stoikiometriwahyuni teresia94% (16)
- Laporan Praktikum StoikiometriDokumen21 halamanLaporan Praktikum StoikiometriAswar0% (1)
- Kapsel StoikiometriDokumen16 halamanKapsel StoikiometriyunitaBelum ada peringkat
- Laporan Praktikum Kimia Dasar2Dokumen15 halamanLaporan Praktikum Kimia Dasar2alskjdhhBelum ada peringkat
- KIMIADokumen32 halamanKIMIAAdagaki AkiBelum ada peringkat
- Laporan Praktikum StoikiometriDokumen21 halamanLaporan Praktikum StoikiometriNajma AtiqaBelum ada peringkat
- Reaksi Dan StoikiometriDokumen25 halamanReaksi Dan StoikiometriNur HafizahBelum ada peringkat
- Persamaan Kimia Dan StoikiometriDokumen18 halamanPersamaan Kimia Dan StoikiometriAndresilitonga silitongaBelum ada peringkat
- STOIKIOMETRI KIMIADokumen23 halamanSTOIKIOMETRI KIMIAagillfitraBelum ada peringkat
- Stoikiometri: A. Hukum-Hukum Dasar Ilmu Kimia 1. Hukum Kekekalan Massa (Hukum Lavoisier)Dokumen12 halamanStoikiometri: A. Hukum-Hukum Dasar Ilmu Kimia 1. Hukum Kekekalan Massa (Hukum Lavoisier)Zappir HaBelum ada peringkat
- STOIKIOMETRI DAN HUKUM KIMIADokumen10 halamanSTOIKIOMETRI DAN HUKUM KIMIAIrsyad IlatoBelum ada peringkat
- STOKIOMETRIDokumen9 halamanSTOKIOMETRIJerny ManaluBelum ada peringkat
- Materi Kimdas Stokiometri, Kesetimbangan, Karbohidrat, Protein, LemakDokumen25 halamanMateri Kimdas Stokiometri, Kesetimbangan, Karbohidrat, Protein, LemakWahyu TriwidiyastutiBelum ada peringkat
- REAKSI KIMIADokumen34 halamanREAKSI KIMIASugimin RaharjoBelum ada peringkat
- Kawaii Food Vocabulary For Pre-K by SlidesgoDokumen22 halamanKawaii Food Vocabulary For Pre-K by SlidesgoChintya EglesyesBelum ada peringkat
- PERTEMUAN KE 6 - Persamaan Reaksi RederhanaDokumen6 halamanPERTEMUAN KE 6 - Persamaan Reaksi RederhanaNasrizal zakaria Al-BantaniBelum ada peringkat
- Modul Hukum Dasar Dan Perhitungan KimiaDokumen18 halamanModul Hukum Dasar Dan Perhitungan KimiaMuh FadliBelum ada peringkat
- StoikiometriDokumen23 halamanStoikiometriDian'z Abimakznyuzz100% (1)
- Jurnal StoikiometriDokumen30 halamanJurnal StoikiometriHanifah Hanun100% (1)
- BAHAN AJAR HUKUM DASAR KIMIA (Revisi)Dokumen7 halamanBAHAN AJAR HUKUM DASAR KIMIA (Revisi)Nurul KholisahBelum ada peringkat
- Diskusi Tugas 1Dokumen2 halamanDiskusi Tugas 1Hari AntoBelum ada peringkat
- Agroekosistem Komponen Dan Macam-MacamnyaDokumen6 halamanAgroekosistem Komponen Dan Macam-MacamnyaQueen ZCXBelum ada peringkat
- Sejarah Perkembangan PertanianDokumen3 halamanSejarah Perkembangan Pertanianhandy dantonBelum ada peringkat
- Ekosistem Pertanian (Agroekosistem)Dokumen3 halamanEkosistem Pertanian (Agroekosistem)EJaenahBelum ada peringkat
- Ekosistem Pertanian (Agroekosistem)Dokumen3 halamanEkosistem Pertanian (Agroekosistem)EJaenahBelum ada peringkat
- Sistem Pertanian BerkelanjutanDokumen12 halamanSistem Pertanian BerkelanjutanawalBelum ada peringkat
- Tugas DiskusiDokumen1 halamanTugas DiskusiawalBelum ada peringkat
- Kuesioner Perbaikan Perangkat Mata Kuliah Kimia Dasar IDokumen14 halamanKuesioner Perbaikan Perangkat Mata Kuliah Kimia Dasar IawalBelum ada peringkat
- BJU UAS THE 2021.2Dokumen10 halamanBJU UAS THE 2021.2awalBelum ada peringkat
- Kuesioner Perbaikan Perangkat Mata Kuliah Kimia Dasar IDokumen14 halamanKuesioner Perbaikan Perangkat Mata Kuliah Kimia Dasar IawalBelum ada peringkat
- Ujian Komunikasi 1-DikonversiDokumen2 halamanUjian Komunikasi 1-DikonversiawalBelum ada peringkat
- Jawaban Diskusi 1 Awal AminuddinDokumen2 halamanJawaban Diskusi 1 Awal AminuddinawalBelum ada peringkat
- 1628 5303 1 SPDokumen17 halaman1628 5303 1 SPSarif SubarkahBelum ada peringkat
- Tugas Diskusi 2.Dokumen4 halamanTugas Diskusi 2.awalBelum ada peringkat
- Pengantar Sesi 3Dokumen2 halamanPengantar Sesi 3awalBelum ada peringkat
- Jawaban Diskusi 2Dokumen1 halamanJawaban Diskusi 2awalBelum ada peringkat