Diskusi Tugas 1
Diunggah oleh
Hari AntoJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Diskusi Tugas 1
Diunggah oleh
Hari AntoHak Cipta:
Format Tersedia
1.
)
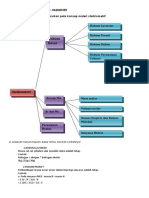
STOIKIOMETRI
REAKSI KIMIA DAN PERHITUNGAN-PERHITUNGAN STOIKIOMETRI RUMUS SENYAWA
HUKUM-HUKUM MASSA ATOM RELATIF, MASSA RUMUS SENYAWA
REAKSI KIMIA Perhitungan- Aplikasi stoikiometri
DASAR KIMIA MOLEKUL, KONSEP MOLEKUL
Perhitungan
Bilangan oksidasi stoikiometri
Rumus Struktur
Hukum kekekalan Massa
kemolaran
Rumus Molekul
Massa-massa
Hukum perbandingan Tetap
Massa volume
Ekivalen:
Rumus Empiris
Volume-
- Ekivalen asam basa volume
Hukum Kelipatan Perbandingan
- Ekivalen redoks
HUKUM PERNYATAAN VOLUME
Massa-massa: mol=Gram/Mr - Hukum Gay Lussac
Massa-volume (STP) = V= n x 22,4 L - Hukum Avogadro
Volume-volume: perbandingan koef. Pada reaksi setara
2.) HUKUM KEKEKAKALAN MASSA ( HUKUM LAVOISIER, 1743-1794 )
Antoine Laurent Lavoisier berpendapat bahwa massa zat – zat sebelum dan sesudah reaksi yakni tetap.Jika kita mencampurkan atau mereaksikan hidrogen
dengan massa 4 gram dan oksigen dengan massa 32 gram. Maka akan menghasilkan hidrogen oksida dengan massa 36 gram
Contoh: Massa hidrogen oksida = massa hidrogen + massa oksigen
Massa hidrogen oksida = 4 gram + 32 gram
Massa hidrogen oksida = 36 gram
Namun, untuk beberapa kasus seperti membakar kertas lalu menjadi abu.
Bisa saja abu lebih ringan daripada kertas, sehingga reaksinya di hasilkan dari reaksi lainnya seperti abu dan gas CO² yang hilang terbawa angin.Lalu pada
tahun 1779, Lavoisier melakukan uji coba dengan memanaskan 530 gram logam merkuri dalam sebuah wadah yang terhubung dengan udara di dalam
silindernya dengan sebuah wadah tertutup.Ternyata volume udara di dalam silinder berkurang sebanyak 1/5 bagian, sedangkan logam merkurinya berubah
menjadi calx merkuri (oksida merkuri) dengan massa 572,4 gram.Terjadi kenaikan massa sebesar 42, 4 gram. Besaran kenaikan massa merkuri ini sebesar
42, 4 gram yakni sama dengan 1/5 bagian udara yang telah hilang yakni oksigen.
Lalu kemudian Lavoiser mengambil sebuah kesimpulan yang dikenal dengan hukum kekekalan massa yakni:
“Massa zat – zat sebelum dan sesudah reaksi yakni tetap”
HUKUM PERBANDINGAN TETAP ( HUKUM PROUST, 1754-1826 )
Joseph Louist Proust berpendapat bahwa perbandingan massa unsur – unsur penyusun sebuah senyawa selalu tetap.Contohnya adalah perbandingan
massa hidrogen dengan oksigen yaitu 1 : 8. Misalkan massa jenis hidrogen yaitu 4 gram. Maka massa oksigennya ialah 4 gram x 8 gram = 32 gram.
Hal ini membuktikan bahwa massa hidrogen dan massa oksigen yang terkandung di dalam air memiliki perbandingan yang tetap yaitu 1 : 8.Berapapun
banyaknya air yang terbentuk dari percobaan yang dilakukannya, Proust mengemukakan teorinya yang terkenal dengan sebutan hukum perbandingan tetap
yang berbunyi:
“Perbandingan massa unsur – unsur dalam sebuah senyawa yakni tetap”
HUKUM PERBANDINGAN BERGANDA ( HUKUM DALTON, 1766-1844 )
Dalton menyelidiki bahwa perbandingan massa unsur – unsur pada setiap senyawa dan mendapatkan sebuah pola keteraturan.Pola tersebut dinyatakan
sebagai hukum perbandingan berganda yang menegaskan bahwa kedua unsur yang dapat membentuk 2 senyawa atau lebih memiliki perbandingan
komponen yang mudah dan sederhana.Pada percobaan yang pertama:
1,33 gram oksigen direaksikan dengan 1 gram karbon. Reaksi ini menghasilkan 2, 33 gram karbon monoksida.
Pada percobaan yang kedua:
Massa oksigen diubah menjadi 2,66 gram sementara massa karbonnya tetap. Reaksi ini menghasilkan suatu senyawa yang berbeda, yakni karbon dioksida.
Dengan massa oksigen yang sama, perbandingan massa karbon dalam senyawa karbon monoksida dan karbon dioksida adalah bilangan bulat dan
sederhana.
Dalton mengemukakan teorinya yang terkenal dengan sebutan Hukum Perbandingan Berganda yang berbunyi :
“Jika 2 jenis unsur bergabung dan membentuk lebih dari 1 senyawa dan jika massa salah satu dari unsur di dalam senyawa tersebut sama, sedangkan
massa unsur lainnya berbeda, maka perbandingan massa unsur lainnya dalam senyawa tersebut ialah bilangan bulat sederhana”
Sumber: https://gurubelajarku.com/hukum-dasar-kimia/
3.)
Cara langsung
a. Tulis persamaan reaksi kimia untuk reaksi kimia yang bersangkutan menggunakan lambang-lambang kimia unsur yang bersangkutan. Misalnya persamaan
reaksi kimia MgO:
Mg(s) + O2(g) → MgO(s)
b. Tentukan koefisien yang menyetarakan persamaan reaksi kimia tersebut. Langkah ini merupakan langkah yang cukup sensitif, biar kamu tidak salah
dalam menyetarakan persamaan reaksi kimia. Ada hal yang harus kamu ingat! Jangan pernah mengubah koefisien pada rumus kimia yang sudah benar.
c. Kembali lagi pada reaksi kimia di atas, seperti yang terlihat dalam tabel, yang belum setara adalah O di dalam MgO sehingga kita perlu menambahkan
koefisien 2 didepan MgO. Namun, Karena sekarang terdapat 2 MgO itu artinya atom Mg di ruas kanan perlu kita beri koefisien 2.
Cara subsitusi
Cara menyetarakan persamaan reaksi kimia ini dilakukan dengan memberi koefisien sementara dengan huruf a,b,c, dan seterusnya. Kemudian disubstitusi
dengan berpedoman bahwa jumlah masing-masing atom di ruas reaktan jumlahnya sama dengan atom di ruas produk. Kemudian menuliskan hasil akhir.
Perhatikan contoh penyetaraan persamaan reaksi kimia berikut ini:
Setarakan reaksi pembentukan magnesium oksida berikut ini:
Mg(s) + O2(g) → MgO(s]
Langkah 1
a Mg(s) + b O2(g) → 1 MgO(s)
Langkah 2
Atom Jumlah Reaktan = Jumlah Produk Hasil
Mg a=1 a=1
O 2b = 1 b=½
Langkah 3. menuliskan hasil reaksi
Mg(s) + ½ O2(g) → MgO(s)
supaya hasilnya tidak berupa angka pecahan, maka kita perlu mengalikan 2. Sehingga reaksi kimianya menjadi:
2Mg(s) + O2(g) → 2MgO(s)
Sumber: https://materikimia.com/2-cara-menyetarakan-persamaan-reaksi-kimia/
Anda mungkin juga menyukai
- StoikiometriDokumen39 halamanStoikiometriHidayati KardenaBelum ada peringkat
- Ika Nila - Diskusi3 Kimia Dasar PDFDokumen2 halamanIka Nila - Diskusi3 Kimia Dasar PDFIka NilaBelum ada peringkat
- Diskusi 3 Sesi 3Dokumen3 halamanDiskusi 3 Sesi 3awalBelum ada peringkat
- Diskusi 3 Kimia Dasar (HARUN ASYAKIRI)Dokumen9 halamanDiskusi 3 Kimia Dasar (HARUN ASYAKIRI)HarunAsyakiriBelum ada peringkat
- Diskusi 3 Kimia DasarDokumen5 halamanDiskusi 3 Kimia Dasarlailatul fitriyahBelum ada peringkat
- Diskusi3 - Kimia Dasar 1 - LINTANG SATITI (043060153)Dokumen4 halamanDiskusi3 - Kimia Dasar 1 - LINTANG SATITI (043060153)Lintang SatitiBelum ada peringkat
- Diskusi 3 Kimd4110Dokumen6 halamanDiskusi 3 Kimd4110NitaBelum ada peringkat
- Bab 4 Hukum Dasar KimiaDokumen22 halamanBab 4 Hukum Dasar Kimiaapanjin79707Belum ada peringkat
- Hukum Dasar KimiaDokumen11 halamanHukum Dasar Kimiadolphinet patraBelum ada peringkat
- Diskusi 3 Kimia Dasar 1Dokumen3 halamanDiskusi 3 Kimia Dasar 1Shefya AnBelum ada peringkat
- Tugas PPT KimiaDokumen15 halamanTugas PPT Kimiamuhammadayubpermana7Belum ada peringkat
- KIMIADokumen29 halamanKIMIANaswa KhoirunnisaBelum ada peringkat
- Laporan Praktikum Kimia Dasar2Dokumen15 halamanLaporan Praktikum Kimia Dasar2alskjdhhBelum ada peringkat
- Bab 4 - Hukum Dasar Dan Perhitungan Kimia (Ipa Kimia X Kurmer)Dokumen22 halamanBab 4 - Hukum Dasar Dan Perhitungan Kimia (Ipa Kimia X Kurmer)nellaBelum ada peringkat
- Peta Konsep Hukum DasarDokumen3 halamanPeta Konsep Hukum DasarMalati Amalia Malik50% (6)
- LKMDokumen10 halamanLKMWikrama PutraBelum ada peringkat
- Laporan Praktikum Kimia DasarDokumen23 halamanLaporan Praktikum Kimia DasaragillfitraBelum ada peringkat
- Modul VDokumen29 halamanModul VShinta RazakBelum ada peringkat
- MURID - KD.3.10 - Stoikiometri - Hukum-Hukum Dasar Kimia & Tugas 7Dokumen10 halamanMURID - KD.3.10 - Stoikiometri - Hukum-Hukum Dasar Kimia & Tugas 7Etnomat Kepulauan SeribuBelum ada peringkat
- Kimia Dasar - Kel6 - 1Dokumen24 halamanKimia Dasar - Kel6 - 1muhabizartrigandi14Belum ada peringkat
- StoikiometriDokumen10 halamanStoikiometriJekiBelum ada peringkat
- Laporan Stoikio LengkapDokumen16 halamanLaporan Stoikio LengkapZulfindira Septri Ruudevi0% (1)
- Laporan PraktikumDokumen13 halamanLaporan PraktikumtiaspramonoBelum ada peringkat
- MAKALAH KIMDAS KELOMPOK 5 Hukum Dasar KimiaDokumen15 halamanMAKALAH KIMDAS KELOMPOK 5 Hukum Dasar KimiaElsa Mahardika92% (39)
- Makalah Kimdas StoikiometriDokumen23 halamanMakalah Kimdas StoikiometriSeptian Setia GunansyahBelum ada peringkat
- Jurnal StoikiometriDokumen30 halamanJurnal Stoikiometriwahyuni teresia94% (16)
- DASAR TEORI StokiometriDokumen7 halamanDASAR TEORI StokiometriAdi SagitariusBelum ada peringkat
- Laporan Kimia Dasar I StoikiometriDokumen16 halamanLaporan Kimia Dasar I StoikiometriAshila Defa RahmaniBelum ada peringkat
- Bahan Ajar Konsep MolDokumen23 halamanBahan Ajar Konsep Moldwivanty arianiBelum ada peringkat
- BAB III Stoikiometri Reaksi - WWW - Kakakiky.idDokumen7 halamanBAB III Stoikiometri Reaksi - WWW - Kakakiky.idRahmad ArfandiBelum ada peringkat
- Hdmol Kim1 3 240217 094833Dokumen4 halamanHdmol Kim1 3 240217 094833silalahiyonathan6Belum ada peringkat
- 2 1 Hukum Hukum Dasar KimiaDokumen7 halaman2 1 Hukum Hukum Dasar KimiaKholilBelum ada peringkat
- 2 1 Hukum Hukum - Dasar - KimiaDokumen7 halaman2 1 Hukum Hukum - Dasar - KimiaBayu Dwi PartantoBelum ada peringkat
- Penyetaraan ReaksiDokumen6 halamanPenyetaraan ReaksiTheresia RondonuwuBelum ada peringkat
- Ringkasan StoikiometriDokumen4 halamanRingkasan StoikiometriGracella KolondamBelum ada peringkat
- Inisiasi 3 (KIMD)Dokumen2 halamanInisiasi 3 (KIMD)Asmaningrum SetyawatiBelum ada peringkat
- Makalah Kimia Dasar Stoikiometri-2Dokumen19 halamanMakalah Kimia Dasar Stoikiometri-2Desi AstiyasariBelum ada peringkat
- Hukum Perbandingan Tetap (Hukum Proust) - Kelompok 3 x.7Dokumen5 halamanHukum Perbandingan Tetap (Hukum Proust) - Kelompok 3 x.7Agus SunaryoBelum ada peringkat
- Makalah Kimdas StoikiometriDokumen20 halamanMakalah Kimdas Stoikiometrijanetbela014Belum ada peringkat
- Laporan Kimia Dasar I StoikiometriDokumen16 halamanLaporan Kimia Dasar I StoikiometriESTUARY100% (11)
- Persamaan Kimia Dan StoikiometriDokumen18 halamanPersamaan Kimia Dan StoikiometriAndresilitonga silitongaBelum ada peringkat
- Bab 8 Hukum Dasar Dan Perhitungan KmiaDokumen9 halamanBab 8 Hukum Dasar Dan Perhitungan Kmiaaryadwinugroho3Belum ada peringkat
- STOIKIOMTERIDokumen19 halamanSTOIKIOMTERIAndyka RaihanBelum ada peringkat
- StoikiometriDokumen23 halamanStoikiometriDian'z Abimakznyuzz100% (1)
- Laporan Artikel Variasi KontinyuDokumen5 halamanLaporan Artikel Variasi KontinyuCitra OcthaBelum ada peringkat
- Rangkuman Materi StoikiometriDokumen4 halamanRangkuman Materi StoikiometriHilmi Nur RaharjaBelum ada peringkat
- Konsep MolDokumen44 halamanKonsep MolFarij AbdurrohmanBelum ada peringkat
- Hukum LavoisierDokumen4 halamanHukum LavoisierMuammar RifqiBelum ada peringkat
- Simulasi Materi Kelas X-1Dokumen3 halamanSimulasi Materi Kelas X-1Lisa Dwi PurnamasariBelum ada peringkat
- Analisis Jurnal StokiometriDokumen14 halamanAnalisis Jurnal StokiometrikurniawanBelum ada peringkat
- STOKIOMETRIDokumen9 halamanSTOKIOMETRIJerny ManaluBelum ada peringkat
- Silabus Stoikiometri FixDokumen6 halamanSilabus Stoikiometri FixDick Alfreda Al-Han SarabitiBelum ada peringkat
- PPTDokumen28 halamanPPTBella ApriliaBelum ada peringkat
- Rangkuman Stoikiometri PDFDokumen10 halamanRangkuman Stoikiometri PDFRatna SariBelum ada peringkat
- 2 Presentation2Dokumen36 halaman2 Presentation2RadenMas Fathul Umar PakuningratanBelum ada peringkat
- Hukum Dasar KimiaDokumen16 halamanHukum Dasar KimiaDarul FiqriBelum ada peringkat
- Dasar Teori StoikiometriDokumen5 halamanDasar Teori StoikiometriFitri Tutink RachmawatiBelum ada peringkat
- Bab 1 PendahuluanDokumen22 halamanBab 1 PendahuluanlitapratamaBelum ada peringkat